1 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,并比较其氧化性。
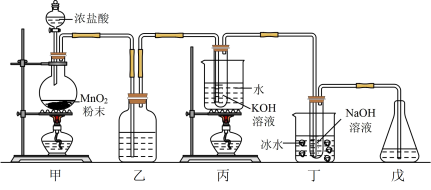
回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是
(2)丙中采用的加热方式是
(3)丁中化学反应的离子方程式是
(4)戊的作用是
(5)反应结束后,取出丙中试管,经冷却结晶、
(6)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力
您最近一年使用:0次
解题方法
2 . 高纯镓广泛用于半导体、光电材料等领域。一种利用炼锌渣(主要含ZnO、CuO、 和一定量的
和一定量的 、不溶性杂质)为原料制备高纯镓的流程如图所示:
、不溶性杂质)为原料制备高纯镓的流程如图所示:

已知:①电解制取镓时,溶液中的 会影响镓的析出,通常先形成CuCl沉淀而除去。
会影响镓的析出,通常先形成CuCl沉淀而除去。
② 与
与 的各物种的分布分数随pH的变化如下图所示。
的各物种的分布分数随pH的变化如下图所示。

③室温时, ,
, 。
。
(1)黄钠铁矾的化学式为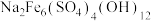 ,“沉铁”时的离子方程式为
,“沉铁”时的离子方程式为_______ 。
(2)“还原除杂”时先向溶液中加入一定量的Cu粉,反应一段时间后再加入稍过量Zn粉。沉淀X中含有的主要元素有_______ 。
(3)“调节pH”时,调节pH为8.2,但不能过高的原因是________ 。
(4)已知:
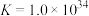 ,为判断氨水能否溶解
,为判断氨水能否溶解 ,计算反应
,计算反应 的平衡常数为
的平衡常数为________ 。
(5)直接电解“沉锌”后的溶液可制备镓,阴极的电极反应式为_______ 。
 和一定量的
和一定量的 、不溶性杂质)为原料制备高纯镓的流程如图所示:
、不溶性杂质)为原料制备高纯镓的流程如图所示:
已知:①电解制取镓时,溶液中的
 会影响镓的析出,通常先形成CuCl沉淀而除去。
会影响镓的析出,通常先形成CuCl沉淀而除去。②
 与
与 的各物种的分布分数随pH的变化如下图所示。
的各物种的分布分数随pH的变化如下图所示。
③室温时,
 ,
, 。
。(1)黄钠铁矾的化学式为
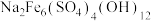 ,“沉铁”时的离子方程式为
,“沉铁”时的离子方程式为(2)“还原除杂”时先向溶液中加入一定量的Cu粉,反应一段时间后再加入稍过量Zn粉。沉淀X中含有的主要元素有
(3)“调节pH”时,调节pH为8.2,但不能过高的原因是
(4)已知:

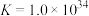 ,为判断氨水能否溶解
,为判断氨水能否溶解 ,计算反应
,计算反应 的平衡常数为
的平衡常数为(5)直接电解“沉锌”后的溶液可制备镓,阴极的电极反应式为
您最近一年使用:0次
解题方法
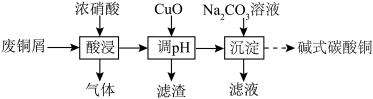
3 . 实验室以废铜屑(杂质为CuO、Al2O3、Fe2O3、FeO和SiO2)为原料制取碱式碳酸铜[aCu(OH)2·bCuCO3]的流程如下:
已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
(1)按如图所示的装置加料后进行“酸浸”操作。

①提高Cu元素浸出速率的方法还有___________ 。
②与使用如图所示漏斗相比,使用漏斗Y的优点是___________ 。
(2)“调pH”的合理范围是___________ 。
(3)“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是___________ 。
(4)可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。
①滴定法涉及的部分反应:2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6。请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。___________ ;根据数据计算Cu元素含量(须使用的试剂:KI溶液、0.1000mol/LNa2S2O3溶液、淀粉溶液)。
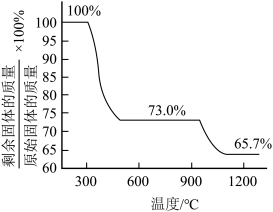
②测得碱式碳酸铜的热重分析结果如图所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知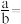
___________ (保留3位有效数字)。

已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 6.5 | 4.2 | 3.4 |
| 沉淀完全pH | 3.2 | 9.7 | 6.7 | 4.0 |
(1)按如图所示的装置加料后进行“酸浸”操作。

①提高Cu元素浸出速率的方法还有
②与使用如图所示漏斗相比,使用漏斗Y的优点是

(2)“调pH”的合理范围是
(3)“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是
(4)可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。
①滴定法涉及的部分反应:2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6。请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。
②测得碱式碳酸铜的热重分析结果如图所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知
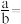

您最近一年使用:0次
4 . 连二亚硫酸钠(Na2S2O4)广泛应用于造纸等行业。Na2S2O4易被氧化,129℃时分解,在碱性条件下较稳定,易溶于水,不溶于乙醇。
实验室用NaBH4碱性溶液和NaHSO3酸性溶液制取Na2S2O4,实验室制备装置如图1所示。

(1)实验前需打开K通入一段时间氮气,其目的是___________ 。
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2,制备Na2S2O4的化学方程式为___________ 。
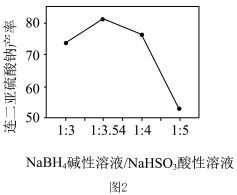
(3)Na2S2O4产率与加入NaBH4溶液与NaHSO3溶液质量比的关系如图2所示,NaBH4碱性溶液与NaHSO3酸性溶液加料质量比增大时,Na2S2O4产率下降的原因是___________ 。
(4)称量5.0g含Na2S2O4•2H2O晶体粗品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,再滴加几滴淀粉溶液,用0.2000mol•L-1标准碘溶液滴定至反应终点,重复实验三次后,平均消耗标准碘溶液20.00mL。有关反应如下:Na2S2O4+2CH2O+H2O=NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O=NaHSO4+4HI+CH2O,计算该粗品中Na2S2O4•2H2O晶体质量分数为___________ 。(写出计算过程)
实验室用NaBH4碱性溶液和NaHSO3酸性溶液制取Na2S2O4,实验室制备装置如图1所示。

(1)实验前需打开K通入一段时间氮气,其目的是
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2,制备Na2S2O4的化学方程式为
(3)Na2S2O4产率与加入NaBH4溶液与NaHSO3溶液质量比的关系如图2所示,NaBH4碱性溶液与NaHSO3酸性溶液加料质量比增大时,Na2S2O4产率下降的原因是

(4)称量5.0g含Na2S2O4•2H2O晶体粗品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,再滴加几滴淀粉溶液,用0.2000mol•L-1标准碘溶液滴定至反应终点,重复实验三次后,平均消耗标准碘溶液20.00mL。有关反应如下:Na2S2O4+2CH2O+H2O=NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O=NaHSO4+4HI+CH2O,计算该粗品中Na2S2O4•2H2O晶体质量分数为
您最近一年使用:0次
名校
解题方法
5 . 实验室以软锰矿粉(含 及少量Fe、Al、Si、Mg等的氧化物)为原料制备
及少量Fe、Al、Si、Mg等的氧化物)为原料制备 ,其实验过程可表示为
,其实验过程可表示为

(1)浸取。在如图的实验装置中,搅拌下,使一定量软锰矿粉与 溶液、
溶液、 溶液充分反应,
溶液充分反应, 转化为
转化为 的化学方程式为
的化学方程式为___________ 。软锰矿粉与 、
、 溶液的加料方式是
溶液的加料方式是___________ ;加料完成后,以一定速率搅拌反应,提高锰元素浸出率的方法还有___________ 。

(2)除杂。对已经除去Fe、Al、Si的 溶液,可通过萃取、反萃取等过程除去溶液中的
溶液,可通过萃取、反萃取等过程除去溶液中的 、
、 。已知:
。已知: 被萃取剂HA萃取的原理可表示为
被萃取剂HA萃取的原理可表示为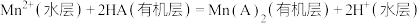 ;
; 的萃取率(
的萃取率( )
) 。
。
①萃取时,在一定温度和pH下, 在有机层和水层中的浓度之比称为分配比(用D表示,为常数)。若25℃、
在有机层和水层中的浓度之比称为分配比(用D表示,为常数)。若25℃、 时,分配比
时,分配比 ,现用20mLHA萃取100mL含
,现用20mLHA萃取100mL含 溶液,按两种方法进行萃取:Ⅰ.用20mLHA萃取一次;Ⅱ.分两次萃取,每次用10mLHA,试通过计算说明哪种方法更好?
溶液,按两种方法进行萃取:Ⅰ.用20mLHA萃取一次;Ⅱ.分两次萃取,每次用10mLHA,试通过计算说明哪种方法更好?_______ (写出计算过程)
②反萃取是利用稀硫酸将有机层中的 转移到水层,需将稀硫酸和有机层共同加入到
转移到水层,需将稀硫酸和有机层共同加入到_______ (填仪器名称)中进行实验操作。为使 尽可能多地发生上述转移,应选择的实验条件或采取的操作有
尽可能多地发生上述转移,应选择的实验条件或采取的操作有_______ (填序号)。
A.适当提高 浓度B.加足量蒸馏水C.用适量稀硫酸分多次反萃取D.充分振荡
浓度B.加足量蒸馏水C.用适量稀硫酸分多次反萃取D.充分振荡
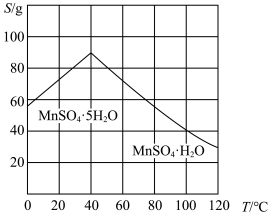
(3)制取 晶体。补充完整制取
晶体。补充完整制取 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中,_______ ,在真空干燥箱中低温干燥,得到 。(已知:
。(已知: 、
、 在
在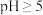 时完全转化为氢氧化物沉淀:
时完全转化为氢氧化物沉淀: 的溶解度曲线如图所示;实验中须使用的试剂有:
的溶解度曲线如图所示;实验中须使用的试剂有: 粉末、无水乙醇)
粉末、无水乙醇)
 及少量Fe、Al、Si、Mg等的氧化物)为原料制备
及少量Fe、Al、Si、Mg等的氧化物)为原料制备 ,其实验过程可表示为
,其实验过程可表示为
(1)浸取。在如图的实验装置中,搅拌下,使一定量软锰矿粉与
 溶液、
溶液、 溶液充分反应,
溶液充分反应, 转化为
转化为 的化学方程式为
的化学方程式为 、
、 溶液的加料方式是
溶液的加料方式是
(2)除杂。对已经除去Fe、Al、Si的
 溶液,可通过萃取、反萃取等过程除去溶液中的
溶液,可通过萃取、反萃取等过程除去溶液中的 、
、 。已知:
。已知: 被萃取剂HA萃取的原理可表示为
被萃取剂HA萃取的原理可表示为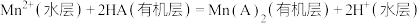 ;
; 的萃取率(
的萃取率( )
) 。
。①萃取时,在一定温度和pH下,
 在有机层和水层中的浓度之比称为分配比(用D表示,为常数)。若25℃、
在有机层和水层中的浓度之比称为分配比(用D表示,为常数)。若25℃、 时,分配比
时,分配比 ,现用20mLHA萃取100mL含
,现用20mLHA萃取100mL含 溶液,按两种方法进行萃取:Ⅰ.用20mLHA萃取一次;Ⅱ.分两次萃取,每次用10mLHA,试通过计算说明哪种方法更好?
溶液,按两种方法进行萃取:Ⅰ.用20mLHA萃取一次;Ⅱ.分两次萃取,每次用10mLHA,试通过计算说明哪种方法更好?②反萃取是利用稀硫酸将有机层中的
 转移到水层,需将稀硫酸和有机层共同加入到
转移到水层,需将稀硫酸和有机层共同加入到 尽可能多地发生上述转移,应选择的实验条件或采取的操作有
尽可能多地发生上述转移,应选择的实验条件或采取的操作有A.适当提高
 浓度B.加足量蒸馏水C.用适量稀硫酸分多次反萃取D.充分振荡
浓度B.加足量蒸馏水C.用适量稀硫酸分多次反萃取D.充分振荡(3)制取
 晶体。补充完整制取
晶体。补充完整制取 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中, 。(已知:
。(已知: 、
、 在
在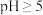 时完全转化为氢氧化物沉淀:
时完全转化为氢氧化物沉淀: 的溶解度曲线如图所示;实验中须使用的试剂有:
的溶解度曲线如图所示;实验中须使用的试剂有: 粉末、无水乙醇)
粉末、无水乙醇)
您最近一年使用:0次
名校
解题方法
6 . 反应 可用于
可用于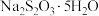 晶体的制备。下列装置能达到实验目的的是
晶体的制备。下列装置能达到实验目的的是
 可用于
可用于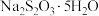 晶体的制备。下列装置能达到实验目的的是
晶体的制备。下列装置能达到实验目的的是
| A.用装置甲制备SO2 |
| B.用装置乙制备Na2S2O3 |
| C.用装置丙处理尾气 |
D.用装置丁蒸干溶液得到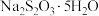 晶体 晶体 |
您最近一年使用:0次
2024-01-22更新
|
298次组卷
|
2卷引用:江苏省泰州中学2023-2024学年高一下学期4月期中考试化学试题
7 . 一氧化二氯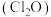 是国际公认的高效安全灭菌消毒剂,其部分性质如下:
是国际公认的高效安全灭菌消毒剂,其部分性质如下: 是棕黄色、有刺激性气味的气体,易溶于水,熔点:-120.6℃,沸点2.0℃;热稳定性差,常温下即可分解。现用如图所示装置制备少量
是棕黄色、有刺激性气味的气体,易溶于水,熔点:-120.6℃,沸点2.0℃;热稳定性差,常温下即可分解。现用如图所示装置制备少量 。
。

(1)盛有浓盐酸的仪器名称是___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中饱和食盐水的作用是___________ 。
(3)装置C中盛装含水碳酸钠(即 与水按照质量比106:9调制而成),用来吸收氯气制备
与水按照质量比106:9调制而成),用来吸收氯气制备 。如果用
。如果用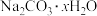 表示含水碳酸钠,则x的值为
表示含水碳酸钠,则x的值为___________ 。C中的固体产物为NaCl和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
(4)装置E的作用是___________ ,装置E中 的收率与装置C的温度和纯碱的含水量关系如表所示,下列结论合理的是
的收率与装置C的温度和纯碱的含水量关系如表所示,下列结论合理的是___________ 。
A.温度较低时,纯碱含水量越高, 的收率越高
的收率越高
B.温度较高时,纯碱含水量越高, 的收率越低
的收率越低
C.纯碱含水量越高, 的收率越高
的收率越高
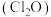 是国际公认的高效安全灭菌消毒剂,其部分性质如下:
是国际公认的高效安全灭菌消毒剂,其部分性质如下: 是棕黄色、有刺激性气味的气体,易溶于水,熔点:-120.6℃,沸点2.0℃;热稳定性差,常温下即可分解。现用如图所示装置制备少量
是棕黄色、有刺激性气味的气体,易溶于水,熔点:-120.6℃,沸点2.0℃;热稳定性差,常温下即可分解。现用如图所示装置制备少量 。
。
(1)盛有浓盐酸的仪器名称是
(2)装置B中饱和食盐水的作用是
(3)装置C中盛装含水碳酸钠(即
 与水按照质量比106:9调制而成),用来吸收氯气制备
与水按照质量比106:9调制而成),用来吸收氯气制备 。如果用
。如果用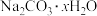 表示含水碳酸钠,则x的值为
表示含水碳酸钠,则x的值为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置E的作用是
 的收率与装置C的温度和纯碱的含水量关系如表所示,下列结论合理的是
的收率与装置C的温度和纯碱的含水量关系如表所示,下列结论合理的是| 温度/℃ | 纯碱含水量/% |  收率/% 收率/% |
| 0~10 | 5.44 | 67.85 |
| 0~10 | 7.88 | 89.26 |
| 10~20 | 8.00 | 64.24 |
| 30~40 | 10.25 | 52.63 |
| 30~40 | 12.50 | 30.38 |
 的收率越高
的收率越高B.温度较高时,纯碱含水量越高,
 的收率越低
的收率越低C.纯碱含水量越高,
 的收率越高
的收率越高
您最近一年使用:0次
名校
解题方法
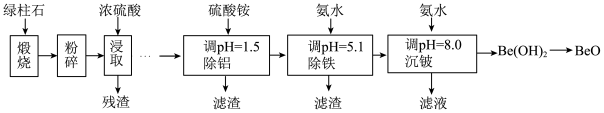
8 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(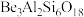 ),还含有一定量的FeO和
),还含有一定量的FeO和 )生产BeO的一种工艺流程如下。下列说法
)生产BeO的一种工艺流程如下。下列说法错误 的是
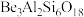 ),还含有一定量的FeO和
),还含有一定量的FeO和 )生产BeO的一种工艺流程如下。下列说法
)生产BeO的一种工艺流程如下。下列说法
A.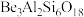 中Be的化合价为+2 中Be的化合价为+2 |
| B.粉碎的目的是增大反应物的接触面积加快反应速率,提高浸取率 |
C.该流程中能循环使用的物质是 |
D.无水 可用作聚合反应的催化剂。BeO、 可用作聚合反应的催化剂。BeO、 与足量C在600~800℃制备 与足量C在600~800℃制备 的化学方程式为: 的化学方程式为: |
您最近一年使用:0次
2024-01-07更新
|
107次组卷
|
2卷引用:江苏省盐城中学2023-2024学年高二上学期期中考试化学试题
名校
9 . 钛酸钡(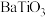 )是制备电子陶瓷材料的基础原料。
)是制备电子陶瓷材料的基础原料。
(1)实验室模拟制备钛酸钡的过程如下:

已知: 能水解生成
能水解生成 ,
, 能进一步水解生成
能进一步水解生成 ;
;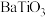 能与浓硫酸反应生成
能与浓硫酸反应生成 。草酸氧钛钡晶体的化学式为
。草酸氧钛钡晶体的化学式为 。
。
①写出基态Ti原子的价电子排布式:___________
②Ti(IV)的存在形式(相对含量分数)与溶液pH的关系如图所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是___________ 。


③由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段II发生反应的化学方程式为___________ 。
(2)利用 将浅紫色
将浅紫色 氧化为无色Ti(IV)的反应可用于测定钛酸钡的纯度。
氧化为无色Ti(IV)的反应可用于测定钛酸钡的纯度。
①请补充完整实验方案:称量2.33g钛酸钡样品完全溶于浓硫酸后,加入过量铝粉,充分振荡,使其完全反应(A1将 转化为
转化为 );
);___________ ;将待测钛液转移到100mL容量瓶中后定容,取20.00mL待测钛液于锥形瓶中,___________ ,记录消耗标准液的体积,重复滴定实验操作3次,平均消耗标准液19.50mL。(实验时须使用的试剂有:稀硫酸、 溶液、KSCN溶液)
溶液、KSCN溶液)
②计算钛酸钡样品的纯度(写出计算过程)___________ 。
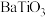 )是制备电子陶瓷材料的基础原料。
)是制备电子陶瓷材料的基础原料。(1)实验室模拟制备钛酸钡的过程如下:

已知:
 能水解生成
能水解生成 ,
, 能进一步水解生成
能进一步水解生成 ;
;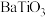 能与浓硫酸反应生成
能与浓硫酸反应生成 。草酸氧钛钡晶体的化学式为
。草酸氧钛钡晶体的化学式为 。
。①写出基态Ti原子的价电子排布式:
②Ti(IV)的存在形式(相对含量分数)与溶液pH的关系如图所示。“沉钛”时,需加入氨水调节溶液的pH在2~3之间,理由是


③由草酸氧钛钡晶体(相对分子质量为449)煅烧制得钛酸钡分为三个阶段。现称取44.9g草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图所示。C点残留固体中含有碳酸钡和钛氧化物,则阶段II发生反应的化学方程式为
(2)利用
 将浅紫色
将浅紫色 氧化为无色Ti(IV)的反应可用于测定钛酸钡的纯度。
氧化为无色Ti(IV)的反应可用于测定钛酸钡的纯度。①请补充完整实验方案:称量2.33g钛酸钡样品完全溶于浓硫酸后,加入过量铝粉,充分振荡,使其完全反应(A1将
 转化为
转化为 );
); 溶液、KSCN溶液)
溶液、KSCN溶液)②计算钛酸钡样品的纯度(写出计算过程)
您最近一年使用:0次
名校
解题方法
10 .  是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或浓度较大时加热会发生燃烧并爆炸。制取
是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或浓度较大时加热会发生燃烧并爆炸。制取 的装置如下图所示。(已知:氨气易液化)
的装置如下图所示。(已知:氨气易液化)

已知: 的熔点为
的熔点为 ℃,沸点为3.8℃,
℃,沸点为3.8℃, 的沸点为
的沸点为 ℃;
℃; 。
。
根据题给信息,请回答下列问题:
(1)装置②盛装的试剂是__________ ,装置③的作用__________ 。
(2)过程中通入干燥空气的目的是__________ ,装置④与⑤之间不用橡皮管连接,目的是__________ 。
(3)写出工业制备 的化学方程式
的化学方程式__________ 。
(4)工业上常以 为原料制备“84”消毒液,现设计以下实验探究消毒液的性质:
为原料制备“84”消毒液,现设计以下实验探究消毒液的性质:
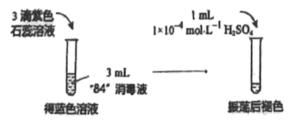
根据实验现象,可得“84”消毒液呈__________ (填“酸性”或“碱性”);
溶液褪色的原因是__________ (用离子方程式和必要文字说明)。
 是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或浓度较大时加热会发生燃烧并爆炸。制取
是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或浓度较大时加热会发生燃烧并爆炸。制取 的装置如下图所示。(已知:氨气易液化)
的装置如下图所示。(已知:氨气易液化)
已知:
 的熔点为
的熔点为 ℃,沸点为3.8℃,
℃,沸点为3.8℃, 的沸点为
的沸点为 ℃;
℃; 。
。根据题给信息,请回答下列问题:
(1)装置②盛装的试剂是
(2)过程中通入干燥空气的目的是
(3)写出工业制备
 的化学方程式
的化学方程式(4)工业上常以
 为原料制备“84”消毒液,现设计以下实验探究消毒液的性质:
为原料制备“84”消毒液,现设计以下实验探究消毒液的性质:
根据实验现象,可得“84”消毒液呈
溶液褪色的原因是
您最近一年使用:0次
2024-01-06更新
|
52次组卷
|
3卷引用:江苏省盐城市第一中学2023-2024学年高一上学期第二次校标考试化学试题



