解题方法
1 . 草酸 是一种白色粉末,
是一种白色粉末,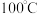 左右开始少量升华,熔点为
左右开始少量升华,熔点为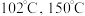 左右分解产生
左右分解产生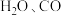 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为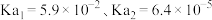 。
。
1.草酸可用于实验室制备少量 气体,应选择的发生装置为
气体,应选择的发生装置为___________ 。
常温下,向某浓度的草酸溶液中加入一定量等浓度的 溶液。
溶液。
3.当 时,溶液呈___________。
时,溶液呈___________。
A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中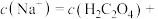
___________ 。
4.当 时,计算该溶液的
时,计算该溶液的
___________ 。(结果保留两位小数)计算过程。
 是一种白色粉末,
是一种白色粉末,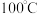 左右开始少量升华,熔点为
左右开始少量升华,熔点为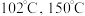 左右分解产生
左右分解产生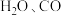 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为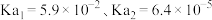 。
。1.草酸可用于实验室制备少量
 气体,应选择的发生装置为
气体,应选择的发生装置为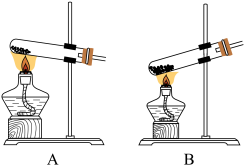
A.用足量的 溶液充分吸收后,可收集得到纯净的 溶液充分吸收后,可收集得到纯净的 |
| B.通过灼热的氧化铜,若出现黑色变红色现象,则产生的气体中一定有CO |
C.通入足量的澄清石灰水中,若能产生白色沉淀,则产生的气体中一定有 |
D.通入酸性 溶液中,若能使溶液褪色,说明草酸具有还原性 溶液中,若能使溶液褪色,说明草酸具有还原性 |
常温下,向某浓度的草酸溶液中加入一定量等浓度的
 溶液。
溶液。3.当
 时,溶液呈___________。
时,溶液呈___________。A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中
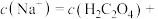
4.当
 时,计算该溶液的
时,计算该溶液的
您最近半年使用:0次
名校
2 . 氯气和亚氯酸钠(NaClO2)都是重要的漂白剂。
(I)某小组以KMnO4和浓盐酸为原料制备干燥、纯净的氯气___________ 。
(2)制备氯气时,可选用的发生装置为___________ (填序号),选择上述合适的装置,其连接顺序为:发生装置→___________ →i(按气流方向,用小写字母表示)。
(3)F装置所盛溶液是___________ (填溶液名称)。
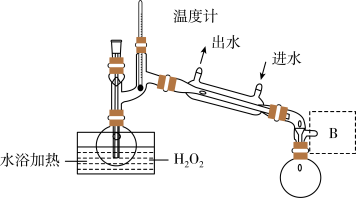
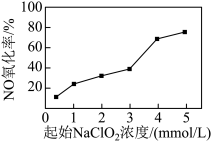
(II)工业上NaClO2可由ClO2、H2O2和NaOH溶液混合制得,实验流程如下:___________ 。
(5)已知H2O2(沸点150℃)浓度对反应速率有影响。通过下图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是___________ 。___________ 。
(I)某小组以KMnO4和浓盐酸为原料制备干燥、纯净的氯气
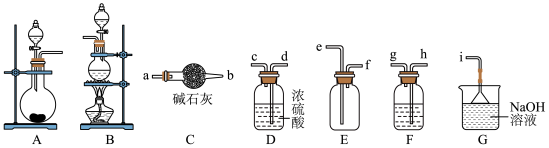
(2)制备氯气时,可选用的发生装置为
(3)F装置所盛溶液是
(II)工业上NaClO2可由ClO2、H2O2和NaOH溶液混合制得,实验流程如下:

(5)已知H2O2(沸点150℃)浓度对反应速率有影响。通过下图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 叠氮化钠(NaN3)可用作汽车安全气囊的气体发生剂。某小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:①叠氮化钠可以由氨基钠(NaNH2)和N2O为原料加热制得,其中N2O的制备反应为 。
。
②氨基钠易氧化、易潮解;NaN3能与强酸反应生成HN3,HN3不稳定,易爆炸。
③N2O有强氧化性,不与酸、碱反应。
回答下列问题:
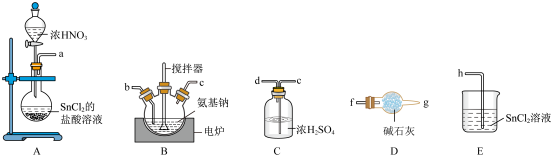
Ⅰ.制备NaN3_______ →h。
查阅资料:①叠氮化钠可以由氨基钠(NaNH2)和N2O为原料加热制得,其中N2O的制备反应为
 。
。②氨基钠易氧化、易潮解;NaN3能与强酸反应生成HN3,HN3不稳定,易爆炸。
③N2O有强氧化性,不与酸、碱反应。
回答下列问题:
Ⅰ.制备NaN3
您最近半年使用:0次
2024高三下·全国·专题练习
4 . 盐湖卤水(主要含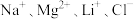 、
、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如下:
的工艺流程如下: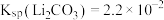 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。
(1)含硼固体中的 在水中存在平衡:
在水中存在平衡: (常温下,
(常温下,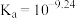 );
); 与
与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为_____ ,该溶液
_____ 。
(2)滤渣Ⅰ的主要成分是_____ (填化学式);精制Ⅰ后溶液中 的浓度为
的浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在_____  以下。若脱硼后直接进行精制Ⅰ,除无法回收
以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加
外,还将增加_____ 的用量(填化学式)。
 、
、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如下:
的工艺流程如下:
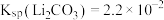 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。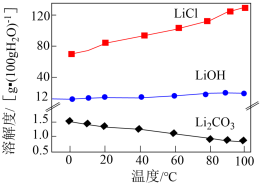
(1)含硼固体中的
 在水中存在平衡:
在水中存在平衡: (常温下,
(常温下,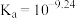 );
); 与
与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为
(2)滤渣Ⅰ的主要成分是
 的浓度为
的浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收
以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加
外,还将增加
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为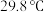 ;
;
② (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
回答下列问题:
(1)“电解精炼”装置如图所示,电解池温度控制在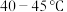 的原因是
的原因是_______ ,阴极的电极反应式为_______ ;
 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: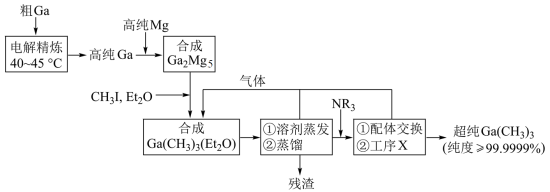
 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为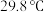 ;
;②
 (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;③相关物质的沸点:
| 物质 | 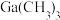 |  | 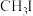 | 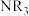 |
沸点/ | 55.7 | 34.6 | 42.4 | 365.8 |
(1)“电解精炼”装置如图所示,电解池温度控制在
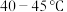 的原因是
的原因是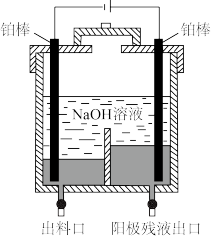
您最近半年使用:0次
2024高三下·全国·专题练习
6 . 稀土(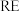 )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 熔点为
熔点为 ;月桂酸和
;月桂酸和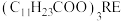 均难溶于水。该工艺条件下,稀土离子保持
均难溶于水。该工艺条件下,稀土离子保持 价不变;
价不变;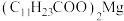 的
的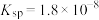 ,
, 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是_______ 。
(2)“过滤1”前,用 溶液调pH至
溶液调pH至_______ 的范围内,该过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)①“加热搅拌”有利于加快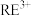 溶出、提高产率,其原因是
溶出、提高产率,其原因是_______ 。
②“操作X”的过程为:先_______ ,再固液分离。
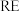 )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: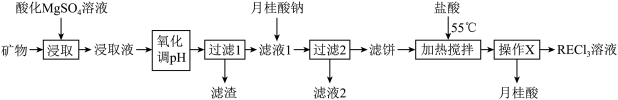
 熔点为
熔点为 ;月桂酸和
;月桂酸和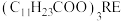 均难溶于水。该工艺条件下,稀土离子保持
均难溶于水。该工艺条件下,稀土离子保持 价不变;
价不变;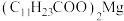 的
的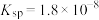 ,
, 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。| 离子 |  |  |  | 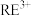 |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
(1)“氧化调pH”中,化合价有变化的金属离子是
(2)“过滤1”前,用
 溶液调pH至
溶液调pH至 发生反应的离子方程式为
发生反应的离子方程式为(3)①“加热搅拌”有利于加快
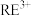 溶出、提高产率,其原因是
溶出、提高产率,其原因是②“操作X”的过程为:先
您最近半年使用:0次
2024高三下·全国·专题练习
7 . 学习小组利用废银催化剂制备乙炔银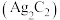 和酸性乙炔银
和酸性乙炔银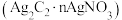 。已知乙炔银和酸性乙炔银在受热时均易发生分解。
。已知乙炔银和酸性乙炔银在受热时均易发生分解。
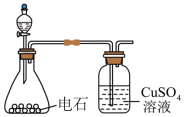
①制取乙炔。利用如图装置制取纯净的乙炔。 的溶液中通入乙炔可得到乙炔银沉淀。
的溶液中通入乙炔可得到乙炔银沉淀。
(1)将过滤所得滤渣置于小烧杯中,利用丙酮反复多次冲洗沉淀。检验滤渣已经洗净的实验方案是_______ 。
(2)准确称取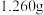 样品,用浓硝酸完全溶解后,定容得
样品,用浓硝酸完全溶解后,定容得 溶液,取
溶液,取 于锥形瓶中,以
于锥形瓶中,以 作指示剂,用
作指示剂,用 标准溶液进行滴定
标准溶液进行滴定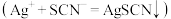 ,终点时消耗标准溶液的体积为
,终点时消耗标准溶液的体积为 。
。
滴定终点的现象为_______ 。通过计算确定n的数值_______ (写出计算过程)。
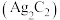 和酸性乙炔银
和酸性乙炔银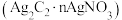 。已知乙炔银和酸性乙炔银在受热时均易发生分解。
。已知乙炔银和酸性乙炔银在受热时均易发生分解。①制取乙炔。利用如图装置制取纯净的乙炔。
 的溶液中通入乙炔可得到乙炔银沉淀。
的溶液中通入乙炔可得到乙炔银沉淀。(1)将过滤所得滤渣置于小烧杯中,利用丙酮反复多次冲洗沉淀。检验滤渣已经洗净的实验方案是
(2)准确称取
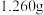 样品,用浓硝酸完全溶解后,定容得
样品,用浓硝酸完全溶解后,定容得 溶液,取
溶液,取 于锥形瓶中,以
于锥形瓶中,以 作指示剂,用
作指示剂,用 标准溶液进行滴定
标准溶液进行滴定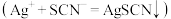 ,终点时消耗标准溶液的体积为
,终点时消耗标准溶液的体积为 。
。滴定终点的现象为
您最近半年使用:0次
8 . 二草酸合铜(Ⅱ)酸钾( )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
Ⅰ.取已知浓度的 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸( )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)长期存放的 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是_______ 。
 )可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:
)可用于无机合成、功能材料制备。实验室制备二草酸合铜(Ⅱ)酸钾可采用如下步骤:Ⅰ.取已知浓度的
 溶液,搅拌下滴加足量
溶液,搅拌下滴加足量 溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。Ⅱ.向草酸(
 )溶液中加入适量
)溶液中加入适量 固体,制得
固体,制得 和
和 混合溶液。
混合溶液。Ⅲ.将Ⅱ的混合溶液加热至80-85℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:
(1)长期存放的
 中,会出现少量白色固体,原因是
中,会出现少量白色固体,原因是
您最近半年使用:0次
2024高三下·全国·专题练习
9 . 三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是重要的化工原料。制备反应式为:2CoCl2·6H2O+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)步骤Ⅲ中的“操作A”是_______ 。
(2)用如图3装置测定产品中NH3的含量(部分装置已省略):
液封装置1的作用是_______ 。
液封装置2的作用是_______ 。
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2mol·L-1的NaOH标准溶液V2mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将_______ (填“偏高”或“偏低”或“不变”)。
 2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤:
2[Co(NH3)6]Cl3+14H2O,反应放出大量热。已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。②[Co(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[Co(NH3)6]Cl3的实验步骤: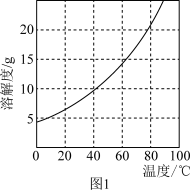

Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)步骤Ⅲ中的“操作A”是
(2)用如图3装置测定产品中NH3的含量(部分装置已省略):
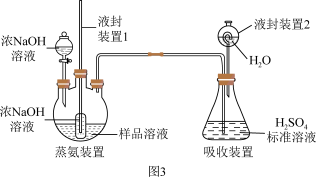
液封装置1的作用是
液封装置2的作用是
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2mol·L-1的NaOH标准溶液V2mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
10 . 某实验小组以 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
可选用试剂: 晶体、
晶体、 溶液、浓
溶液、浓 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水
步骤1. 的制备
的制备
按如图所示装置进行实验,得到 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。 的含量测定
的含量测定
①称取产品 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液逐滴加入热的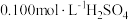 溶液,
溶液,
③沉淀完全后, 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为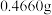 。
。
回答下列问题:
(1)在沉淀过程中,某同学在加入一定量热的 溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已完全的方法是_______ ;
 溶液为原料制备
溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:可选用试剂:
 晶体、
晶体、 溶液、浓
溶液、浓 、稀
、稀 、
、 溶液、蒸馏水
溶液、蒸馏水步骤1.
 的制备
的制备按如图所示装置进行实验,得到
 溶液,经一系列步骤获得
溶液,经一系列步骤获得 产品。
产品。
 的含量测定
的含量测定①称取产品
 ,用
,用 水溶解,酸化,加热至近沸;
水溶解,酸化,加热至近沸;②在不断搅拌下,向①所得溶液逐滴加入热的
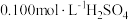 溶液,
溶液,③沉淀完全后,
 水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为
水浴40分钟,经过滤、洗涤、烘干等步骤,称量白色固体,质量为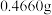 。
。回答下列问题:
(1)在沉淀过程中,某同学在加入一定量热的
 溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
溶液后,认为沉淀已经完全,判断沉淀已完全的方法是
您最近半年使用:0次



