名校
1 . 有机合成是有机化学的重要组成部分,如图是关于气体A制备和性质的合成路线图。已知C是一种塑料,D是一种植物生长调节剂,可以催熟果实。
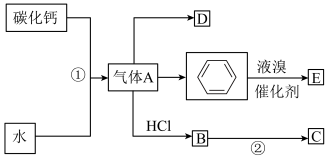
(1)①的化学方程式为______ 。
(2)②的化学方程式为______ ,该反应属于______ 反应(填反应类型)。
(3)D中的官能团为______ (填名称),写出实验室制D的化学方程式为______ ,该反应属于______ 反应(填反应类型)。
(4)与链烃相比,苯的化学性质的主要特征是 (单选)。
(5)证明苯制备E为取代反应的实验方案是______ 。已知硝基为间位定位基团,溴原子为邻、对位定位基团,写出以苯原料,制各间溴硝基苯的合成路线_____ 。
(合成路线的表示方式为:甲 乙
乙 目标产物)
目标产物)
(6)与上述物质有关的化学实验的说法中,正确的是 (单选)。

(1)①的化学方程式为
(2)②的化学方程式为
(3)D中的官能团为
(4)与链烃相比,苯的化学性质的主要特征是 (单选)。
| A.难氧化、难取代、难加成 | B.易氧化、易取代、易加成 |
| C.难氧化、能加成、易取代 | D.易氧化、易加成、难取代 |
(合成路线的表示方式为:甲
 乙
乙 目标产物)
目标产物)(6)与上述物质有关的化学实验的说法中,正确的是 (单选)。
| A.实验室制备乙烯时,产生的气体使溴水褪色,能证明有乙烯生成 |
| B.除去溴苯中的溴,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 |
| C.实验室制乙炔,反应物为固体和液体,且常温条件下反应,可以用启普发生器 |
| D.制取硝基苯时,试管中先加入浓H2SO4,再逐滴滴入浓HNO3和苯 |
您最近一年使用:0次
名校
2 . 亚硫酰氯( )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解
I.亚硫酰氯( )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
(1)用硫磺、液氯和 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为_______ 。
(2) 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。
① 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是_______ (写出两点)。
②实验室常用NaOH溶液吸收 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
II.硫酰氯( )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:

(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
(4)去除丙装置可能会发生的副反应是_______ (用化学方程式表示)。
(5)为了测定 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:
①根据上表中各种物质的 ,该实验应选择的指示剂为
,该实验应选择的指示剂为_______ (从下列选项中选择,填标号),滴定终点的现象是_______ 。
A. B.
B. C.
C. D.KBr
D.KBr
②该 产品的纯度为
产品的纯度为_______ %。
 )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解I.亚硫酰氯(
 )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。(1)用硫磺、液氯和
 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为(2)
 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。①
 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是②实验室常用NaOH溶液吸收
 ,该反应的离子方程式是
,该反应的离子方程式是II.硫酰氯(
 )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:
(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
| A.碱石灰、浓硫酸 | B.氯化钙、碱石灰 | C.碱石灰、五氧化二磷 | D.碱石灰、碱石灰 |
(5)为了测定
 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:| 物质 |  | AgCl |  |  | AgBr |
 | 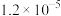 | 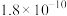 | 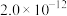 | 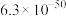 |  |
| 颜色 | 白色 | 白色 | 砖红色 | 黑色 | 浅黄色 |
 ,该实验应选择的指示剂为
,该实验应选择的指示剂为A.
 B.
B. C.
C. D.KBr
D.KBr②该
 产品的纯度为
产品的纯度为
您最近一年使用:0次
2022-11-08更新
|
493次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 甲基丙烯酸甲酯是合成有机玻璃的单体,有关物质的性质如下:
某小组拟制备甲基丙烯酸甲酯并探究其性质,装置如图所示(夹持及加热仪器略)。

向三颈瓶中依次加入20 mL甲醇、5 mL浓硫酸、30 mL甲基丙烯酸及沸石少许,充分搅拌,加热。
(1)向其中加入沸石的目的是___________ 。
(2)使用油水分离器的作用是___________ 。
(3)实验结束后,提纯产品的流程如下:
混合液 产品
产品
①水洗2的目的是___________ 。
②加入硫酸钠粉末的作用是___________ 。
③蒸馏操作中收集产品的温度约为___________ 。
(4)设计简单实验检验产品中含碳碳双键:___________ 。
(5)甲基丙烯酸甲酯另一种合成方法为 ,已知该反应的原子利用率为100%,则A的结构简式为
,已知该反应的原子利用率为100%,则A的结构简式为___________ 。
| 物质 | 沸点/℃ | 溶解性 |
| 甲醇 | 64.7 | 易溶于水和有机溶剂 |
甲基丙烯酸 | 161 | 溶于水,易溶于有机溶剂 |
| 甲基丙烯酸甲酯 | 100 | 易溶于有机溶剂,微溶于水 |

向三颈瓶中依次加入20 mL甲醇、5 mL浓硫酸、30 mL甲基丙烯酸及沸石少许,充分搅拌,加热。
(1)向其中加入沸石的目的是
(2)使用油水分离器的作用是
(3)实验结束后,提纯产品的流程如下:
混合液
 产品
产品①水洗2的目的是
②加入硫酸钠粉末的作用是
③蒸馏操作中收集产品的温度约为
(4)设计简单实验检验产品中含碳碳双键:
(5)甲基丙烯酸甲酯另一种合成方法为
 ,已知该反应的原子利用率为100%,则A的结构简式为
,已知该反应的原子利用率为100%,则A的结构简式为
您最近一年使用:0次
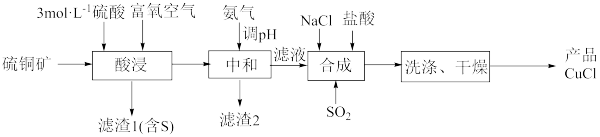
4 . 一种用硫铜矿(主要含CuS、 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成 ;
;
②CuCl在潮湿的空气中易被氧化,生成的碱式盐为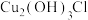 ;
;
③已知 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:
回答下列问题:
(1)“酸浸”时,富氧空气的作用_______ 。
(2)“酸浸”时,CuS反应的化学方程式为_______ 。
(3)用氨水调pH时,应将溶液的范围调整为_______ 。
(4)“合成”时, 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为_______ 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为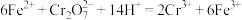
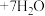 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为_______ (杂质不参与反应,列出计算式即可)。
(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。
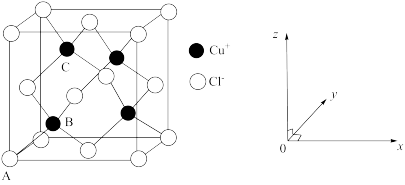
①图中原子的坐标参数:A为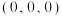 ,B为
,B为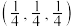 ,则C的坐标参数为
,则C的坐标参数为_______ 。
② 与
与 最短的距离是
最短的距离是_______ nm。
 及少量FeO、
及少量FeO、 等)为原料制备CuCl的工艺流程如下:
等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成
 ;
;②CuCl在潮湿的空气中易被氧化,生成的碱式盐为
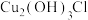 ;
;③已知
 、
、 、
、 开始生成沉淀和沉淀完全时的pH如下表:
开始生成沉淀和沉淀完全时的pH如下表:| 金属离子 |  |  |  |
| 开始沉淀pH | 4.7 | 8.1 | 1.2 |
| 完全沉淀pH | 6.7 | 9.6 | 3.2 |
(1)“酸浸”时,富氧空气的作用
(2)“酸浸”时,CuS反应的化学方程式为
(3)用氨水调pH时,应将溶液的范围调整为
(4)“合成”时,
 生成CuCl发生反应的离子方程式为
生成CuCl发生反应的离子方程式为(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L
溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L 的
的 溶液滴定到终点,发生反应为
溶液滴定到终点,发生反应为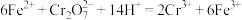
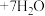 ,消耗
,消耗 溶液V mL,样品中CuCl的质量分数为
溶液V mL,样品中CuCl的质量分数为(6)如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。

①图中原子的坐标参数:A为
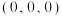 ,B为
,B为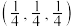 ,则C的坐标参数为
,则C的坐标参数为②
 与
与 最短的距离是
最短的距离是
您最近一年使用:0次
2023-04-11更新
|
515次组卷
|
4卷引用:河南省驻马店高级中学2022-2023学年高二下学期期中考试化学试题
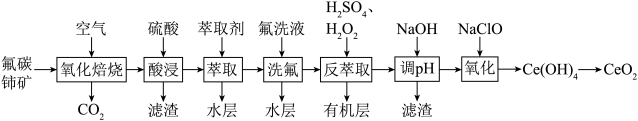
5 . 二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要含有CeFCO3)为原料制备二氧化铈的一种工艺流程如图所示。
已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;
;
②Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物CeO2和CeF4,写出该反应的化学方程式___________ 。
(2)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是___________ 。
(3)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为___________ 。
(4)“反萃取”后的水层溶液中c(Ce3+)=1.0mol•L-1,c(Al3+)=0.01mol•L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则加入NaOH调节溶液pH的范围是___________ ,过滤后,再向滤液中加入NaOH使Ce3+沉淀完全。
已知:①室温下,当溶液中的离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全。
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21
(5)“氧化”时发生反应的离子方程式为___________ 。
(6)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得4.3吨CeO2,则CeO2的产率为___________ (保留3位有效数字,写出计算过程)。

已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物CeO2和CeF4,写出该反应的化学方程式
(2)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP
 CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是(3)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为
(4)“反萃取”后的水层溶液中c(Ce3+)=1.0mol•L-1,c(Al3+)=0.01mol•L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则加入NaOH调节溶液pH的范围是
已知:①室温下,当溶液中的离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全。
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21
(5)“氧化”时发生反应的离子方程式为
(6)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得4.3吨CeO2,则CeO2的产率为
您最近一年使用:0次
6 . 苯胺又名氨基苯是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4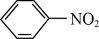 +9Fe+4H2O
+9Fe+4H2O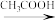 4
4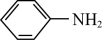 +3Fe3O4
+3Fe3O4

已知部分有机物的一些数据如下表:
I.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸后冷却至室温,再将8.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
II.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5-6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)仪器X的名称是___ ;加入硝基苯时,“逐滴加入”的目的是____ 。
(2)分离提纯过程中加入NaCl固体的作用是____ 。
(3)装置2中长导管B的作用是___ 。
(4)“水蒸气蒸馏”结束后,应先打开止水夹T,再停止对“水蒸气发生装置”加热,理由是___ 。
(5)利用装置3蒸馏时,温度的范围为___ ,实验结束得到产物6.0mL,则苯胺的产率为__ (保留三位有效数字)。
4
 +9Fe+4H2O
+9Fe+4H2O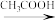 4
4 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
| 名称 | 相对分子质量 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 硝基苯 | 123 | 1.20 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 |
| 苯胺 | 93 | 1.02 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 |
| 乙醚 | 74 | 0.71 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
II.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5-6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)仪器X的名称是
(2)分离提纯过程中加入NaCl固体的作用是
(3)装置2中长导管B的作用是
(4)“水蒸气蒸馏”结束后,应先打开止水夹T,再停止对“水蒸气发生装置”加热,理由是
(5)利用装置3蒸馏时,温度的范围为
您最近一年使用:0次
2021-03-24更新
|
1355次组卷
|
6卷引用:辽宁省沈阳市五校协作体2022-2023学年高二下学期期中考试化学试题
辽宁省沈阳市五校协作体2022-2023学年高二下学期期中考试化学试题广东省广大附中、铁一、广外三校2020-2021学年高二下学期期中联考化学(选考)试题专题5 药物合成的重要原料——卤代烃、胺、酰胺 本专题达标检测(已下线)05 以分离提纯为主线的有机制备类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)河南省六市2021届高三3月第一次联考理综化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)
名校
解题方法
7 . 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:


回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式:______ 。继续滴加至液溴滴完。
(2)反应过程中,a外壁温度升高,为提高原料利用率,需利用温度计控制温度,适宜的温度范围为______ (填序号)。
A.>156℃ B.59℃~80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:①向a中加入10 mL水,然后过滤除去未反应的铁屑;②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。此操作所需要的玻璃仪器除烧杯外,还需______ ,用NaOH溶液洗涤的作用是______ ;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______ 。
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为______ ,要进一步提纯,下列操作中必需的是______ (填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取


| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液溴。向a中滴入几滴液溴,有白雾产生,写出产生白雾的化学方程式:
(2)反应过程中,a外壁温度升高,为提高原料利用率,需利用温度计控制温度,适宜的温度范围为
A.>156℃ B.59℃~80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:①向a中加入10 mL水,然后过滤除去未反应的铁屑;②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。此操作所需要的玻璃仪器除烧杯外,还需
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为
A.重结晶 B.过滤 C.蒸馏 D.萃取
您最近一年使用:0次
2020-12-27更新
|
722次组卷
|
5卷引用:河南省商丘名校联考2022-2023学年高二下学期4月期中考试化学试题
河南省商丘名校联考2022-2023学年高二下学期4月期中考试化学试题安徽省太和第一中学2020-2021学年高二上学期12月月考化学试题(已下线)2.2 芳香烃(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)2.3 芳香烃(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)2.3 芳香烃(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修3)



