1 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4
 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________ 。
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是_____________________ ;仪器c的名称是______________ ,其作用是___________________________________________ 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________ 。下列仪器中可用于分离苯乙酸粗品的是________________ (填标号)。
(3)提纯粗苯乙酸的方法是_____________ ,最终得到44 g纯品,则苯乙酸的产率是________ 。
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________ 。
 + H2O+H2SO4
+ H2O+H2SO4
 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器b的作用是
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
| A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是
(4)用CuCl2• 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2019-01-30更新
|
3820次组卷
|
18卷引用:湖北省武汉中学2022-2023学年高二下学期5月月考化学试题
湖北省武汉中学2022-2023学年高二下学期5月月考化学试题2015-2016学年山西省怀仁一中高二下第二次月考化学试卷2016届黑龙江省哈尔滨三中高三上第三次检测理综化学试卷2015-2016学年陕西西安铁一中学高二下开学考试化学试卷2014-2015学年湖南省双峰一中高二下期中理科化学试卷广西南宁市第三中学2019-2020学年高二上学期期中考试化学(理)试题第三章 烃的含氧衍生物——B 拓展区 综合拓展(人教版选修5)重庆市主城区七校2019-2020学年高二下学期期末联考化学试题黑龙江省哈尔滨市哈师大附中2020-2021学年高二下学期期中考试化学试题(已下线)第一章 有机化合物的结构特点与研究方法 章末测试(A)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)福建省莆田第一中学2021-2022学年高二上学期期中考试化学试题甘肃省永昌县第一高级中学2021-2022学年高二下学期期末考试化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(全国大纲卷)(已下线)2013-2014江西省临川一中高一下学期期末考试化学试卷(已下线)2013-2014学年江西省临川一中高一(下)期末考试化学试卷会做实验2020届高三化学实验复习——过滤、蒸馏、冷凝、洗气装置的创新应用【选择15+有机工艺10题突破】(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
2 . 叠氮化钠(NaN3)是一种重要的化工产品,可用于合成抗生素头孢菌素药物和用作汽车安全气囊的气源。实验室可通过以下流程制备叠氮化钠并测定其纯度。
Ⅰ.制备氨基钠(反应原理为:2Na+2NH3 2NaNH2+H2)实验装置如图。
2NaNH2+H2)实验装置如图。

已知:氨基钠极易与水剧烈反应生成氨气,且其易被空气氧化。
(1)仪器a的名称为___________ ,实验开始时,应先打开分液漏斗使浓氨水流下,目的是_________ 。
(2)B装置中的药品可选用___________。
(3)若无B装置,C中生成的氨基钠会发生的反应为___________ (用化学方程式表示)。
(4)某同学认为上述实验设计有缺陷,请指出问题,并对装置提出改正措施___________ 。
Ⅱ.制备NaN3
(5)将Ⅰ中制备的NaNH2与N2O在210-220℃的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质(SiO2),请用化学方程式说明不选用玻璃材质的原因___________ 。
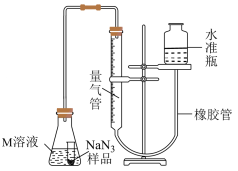
Ⅲ.测定NaN3的纯度水
精确称量0.1500g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发),已知:2NaN3~3N2(其他产物略),反应中放出大量的热。
(6)反应后对水量气管读数时,应注意
①___________
②调节量气管和水准瓶中的液面相平
③视线平视凹液面
(7)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为(质量分数)___________ 。
(8)假定其他操作均正确,分析下列因素对实验结果的影响。
①读取初始体积时,量气管中的液面低于水准瓶中的液面___________ (填“偏大”、“偏小”或“无影响”,下同);
②实验前未将装置内的空气排出___________ ;
③读取最终体积时仰视___________ 。
Ⅰ.制备氨基钠(反应原理为:2Na+2NH3
 2NaNH2+H2)实验装置如图。
2NaNH2+H2)实验装置如图。
已知:氨基钠极易与水剧烈反应生成氨气,且其易被空气氧化。
(1)仪器a的名称为
(2)B装置中的药品可选用___________。
| A.P2O5 | B.碱石灰 | C.无水硫酸铜 | D.无水氯化钙 |
(3)若无B装置,C中生成的氨基钠会发生的反应为
(4)某同学认为上述实验设计有缺陷,请指出问题,并对装置提出改正措施
Ⅱ.制备NaN3
(5)将Ⅰ中制备的NaNH2与N2O在210-220℃的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质(SiO2),请用化学方程式说明不选用玻璃材质的原因

Ⅲ.测定NaN3的纯度水
精确称量0.1500g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发),已知:2NaN3~3N2(其他产物略),反应中放出大量的热。
(6)反应后对水量气管读数时,应注意
①
②调节量气管和水准瓶中的液面相平
③视线平视凹液面
(7)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为(质量分数)
(8)假定其他操作均正确,分析下列因素对实验结果的影响。
①读取初始体积时,量气管中的液面低于水准瓶中的液面
②实验前未将装置内的空气排出
③读取最终体积时仰视
您最近一年使用:0次
解题方法
3 . 乳酸薄荷醇酯广泛应用于化妆品和食品等行业中。实验室以薄荷醇( )和乳酸(
)和乳酸( )为原料直接反应制备乳酸薄荷醇酯的化学方程式为
)为原料直接反应制备乳酸薄荷醇酯的化学方程式为 。
。
主要实验装置示意图和有关数据如表:

实验步骤如下:
I.合成:在带有温度计、分水器、搅拌器的250mL三颈烧瓶中加入薄荷醇15.6g、90%乳酸23.5g、浓硫酸0.1g、甲苯50g,加热到100℃,加热回流2.5h。
Ⅱ.分离与提纯:降温冷却后放出水层,有机层与反应液合并,将合并液分别用20mL10%碳酸钠溶液洗涤两次、去离子水洗涤两次,干燥,减压蒸馏,得到产品13.7g。回答下列问题:
(1)仪器a的名称是__________ ,在以上“合成”步骤中需控制反应温度为100℃的原因可能是__________ 。
(2)实验中加入过量乳酸的目的是__________ 。
(3)在“分离与提纯”步骤中,水层应从分液漏斗的__________ (填“上口”或“下口”)放出,用碳酸钠溶液洗涤的主要目的是__________ 。
(4)“减压蒸馏”的目的是__________ 。
 )和乳酸(
)和乳酸( )为原料直接反应制备乳酸薄荷醇酯的化学方程式为
)为原料直接反应制备乳酸薄荷醇酯的化学方程式为 。
。主要实验装置示意图和有关数据如表:

| 物质 | 乳酸 | 薄荷醇 | 乳酸薄荷醇酯 | 甲苯 |
| 相对分子质量 | 90 | 156 | 228 | 92 |
| 密度/(g·cm-3) | 1.25 | 0.89 | 0.976 | 0.89 |
| 熔点/℃ | 16.8 | 43 | -47 | -94.9 |
| 沸点/℃ | 122 | 103 | 142 | 110.6 |
| 溶解性 | 易溶水和有机溶剂 | 微溶于水,易溶于有机溶剂 | 微溶于水,易溶于有机溶剂 | 不溶于水 |
I.合成:在带有温度计、分水器、搅拌器的250mL三颈烧瓶中加入薄荷醇15.6g、90%乳酸23.5g、浓硫酸0.1g、甲苯50g,加热到100℃,加热回流2.5h。
Ⅱ.分离与提纯:降温冷却后放出水层,有机层与反应液合并,将合并液分别用20mL10%碳酸钠溶液洗涤两次、去离子水洗涤两次,干燥,减压蒸馏,得到产品13.7g。回答下列问题:
(1)仪器a的名称是
(2)实验中加入过量乳酸的目的是
(3)在“分离与提纯”步骤中,水层应从分液漏斗的
(4)“减压蒸馏”的目的是
您最近一年使用:0次
名校
解题方法
4 . 亚硝酰氯(NOCl)可用做有机合成试剂。某研究小组用NO和Cl2制备NOCl,并分离回收未反应的原料,装置如图(夹持及加热装置已略去)。
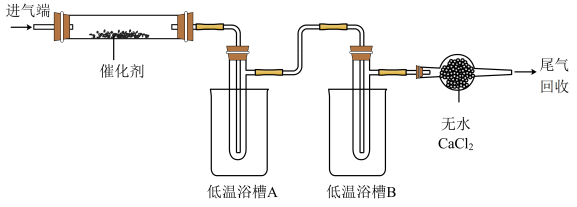
已知:① ;
;
②沸点: NOCl为-6℃,Cl2为-34℃,NO为-152℃ ;
③NOCl易水解,能与O2反应。下列说法错误的是

已知:①
 ;
;②沸点: NOCl为-6℃,Cl2为-34℃,NO为-152℃ ;
③NOCl易水解,能与O2反应。下列说法错误的是
| A.实验前先通入氩气,目的是排尽装置内的空气 |
| B.低温浴槽B的温度区间应控制在-34℃~-6℃ |
| C.将催化剂负载在玻璃棉上,以增大接触面积,提高反应速率 |
| D.尾气回收的物质为NO |
您最近一年使用:0次
2023-02-10更新
|
398次组卷
|
3卷引用:四川省成都外国语学校2022-2023学年高二下学期3月月考化学试题
名校
5 . 三氯化铬(CrCl3,熔点83℃,易升华、水解,高温下易被氧气氧化)是合成其他铬盐的重要原料,在无机和有机合成中有重要作用,某同学在实验室加热Cr2O3与CCl4制备CrCl3。
(1)基态Cr原子核外有_______ 种能量不同的电子。
(2)Cr2O3的制备:将一定量的重铬酸铵[(NH4)2Cr2O7]放入坩埚中加热分解生成Cr2O3、N2和H2O。上述反应中氧化产物和还原产物的物质的量之比为_______ 。
(3)CrCl3的制备装置如图所示:

①仪器X的名称为_______ 。
②实验时,点燃酒精灯前需要先通入一段时间的N2,其目的是_______ 。
③装置B试管中除了生成CrCl3外,还有光气(COCl2)生成,光气有毒,与水反应生成大量酸雾,装置D烧杯中反应的化学方程式为_______ 。
(4)产品中CrCl3质量分数的测定,步骤如下:
(ⅰ)称取0.3000g CrCl3产品溶于水并于250mL容量瓶中定容;
(ⅱ)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O ,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
(ⅲ)加入1mL指示剂,用0.0250mol/L的标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)。
①(ⅱ)中加入稍过量的Na2O2后需要加热煮沸,其主要原因是_______ 。
②滴定实验可选用的指示剂为_______ ;产品中CrCl3质量分数为_______ (计算结果保留四位有效数字)。
(1)基态Cr原子核外有
(2)Cr2O3的制备:将一定量的重铬酸铵[(NH4)2Cr2O7]放入坩埚中加热分解生成Cr2O3、N2和H2O。上述反应中氧化产物和还原产物的物质的量之比为
(3)CrCl3的制备装置如图所示:

①仪器X的名称为
②实验时,点燃酒精灯前需要先通入一段时间的N2,其目的是
③装置B试管中除了生成CrCl3外,还有光气(COCl2)生成,光气有毒,与水反应生成大量酸雾,装置D烧杯中反应的化学方程式为
(4)产品中CrCl3质量分数的测定,步骤如下:
(ⅰ)称取0.3000g CrCl3产品溶于水并于250mL容量瓶中定容;
(ⅱ)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O
 ,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
,稀释并加热煮沸,在加入稍过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;(ⅲ)加入1mL指示剂,用0.0250mol/L的标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)。
①(ⅱ)中加入稍过量的Na2O2后需要加热煮沸,其主要原因是
②滴定实验可选用的指示剂为
您最近一年使用:0次
2023-01-05更新
|
110次组卷
|
2卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题
6 . 苯甲酸乙酯可用于配制香水及食用香精。实验室用苯甲酸与乙醇为原料制备苯甲酸乙酯,制备装置如图所示(部分装置已省略)。已知:

Ⅰ.合成苯甲酸乙酯粗产品按上图装置,在仪器C中加入2.44 g苯甲酸、15.0 mL乙醇、3.0 mL浓硫酸适量环己烷(与乙醇、水可形成共沸物),控制一定温度加热2 h后停止加热。
(1)本实验中制取苯甲酸乙酯的化学方程式为___________ 。
(2)结合数据分析,实验时使用过量乙醇的目的是___________ 。
(3)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是___________ 。
Ⅱ.粗产品的精制将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至下图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.4mL。
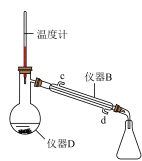
(4)仪器D的名称是___________ 。
(5)加入Na2CO3溶液的作用有___________ (填序号)。
a.除去硫酸和苯甲酸 b.降低苯甲酸乙酯的溶解度
(6)采用图乙装置进行蒸馏操作,收集___________ ℃的馏分。
(7)该实验中苯甲酸乙酯的产率是___________ (产率= ×100%)。
×100%)。

| 物质 | 乙醇 | 苯甲酸 | 乙醚 | 苯甲酸乙酯 |
| 密度/(g•cm﹣3) | 0.7893 | 1.2659 | 0.7318 | 1.0500 |
| 沸点/℃ | 78.5 | 249.0 | 34.5 | 212.0 |
| 相对分子质量 | 46 | 122 | 74 | 150 |
(1)本实验中制取苯甲酸乙酯的化学方程式为
(2)结合数据分析,实验时使用过量乙醇的目的是
(3)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回烧瓶,下层水层从分水器下口放出,反应结束的标志是
Ⅱ.粗产品的精制将仪器C中的反应液倒入盛有水的烧杯中,滴加饱和Na2CO3溶液至溶液呈中性,用分液漏斗分出有机层,再用乙醚萃取水层中的残留产品,将二者合并转移至下图的仪器D中,加入沸石和无水氯化钙,加热蒸馏,制得产品2.4mL。

(4)仪器D的名称是
(5)加入Na2CO3溶液的作用有
a.除去硫酸和苯甲酸 b.降低苯甲酸乙酯的溶解度
(6)采用图乙装置进行蒸馏操作,收集
(7)该实验中苯甲酸乙酯的产率是
 ×100%)。
×100%)。
您最近一年使用:0次
名校
解题方法
7 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn2+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和___________ ;写出“溶浸”中二氧化锰与硫化锰反应的离子方程式___________ 。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化,离子方程式为___________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___________ 之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___________ 。
(6)写出“沉锰”的离子方程式___________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4,当x=y= 时,z=
时,z=___________ 。

相关金属离子[c0(Mn2+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化,离子方程式为
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4,当x=y=
 时,z=
时,z=
您最近一年使用:0次
名校
8 . 如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。

(1)仪器 的名称是
的名称是_______ ,仪器 在安装前必须进行的操作是
在安装前必须进行的操作是_______ ,为防止气体生成的速率过快,由A滴入B的试剂为_______ 。
(2)实验室制备乙炔的化学方程式为_______ 。
(3)装置C可选用的试剂为_______ (写出一种即可),其作用为_______ 。
(4)反应开始后,D中发生的反应方程式为_______ ,
(5)实验结束后,B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是_______。
(6)写出以乙炔和 为原料,合成聚氯乙烯的方程式:
为原料,合成聚氯乙烯的方程式:_______ ,_______ 。

(1)仪器
 的名称是
的名称是 在安装前必须进行的操作是
在安装前必须进行的操作是(2)实验室制备乙炔的化学方程式为
(3)装置C可选用的试剂为
(4)反应开始后,D中发生的反应方程式为
(5)实验结束后,B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是_______。
A. | B. | C. | D. |
 为原料,合成聚氯乙烯的方程式:
为原料,合成聚氯乙烯的方程式:
您最近一年使用:0次
2022-07-14更新
|
248次组卷
|
3卷引用:吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题
名校
解题方法
9 . 三氯化六氨合钴([Co(NH3)6]Cl3(Mr=267.5g∙mol-1,橙黄色晶体)是合成其它含钴配合物的重要原料,它难溶于乙醇,微溶于盐酸,稍溶于水,常温下较稳定,强热时部分分解,实验室制备三氯化六氨合钴的反应原理为:2CoCl2∙6H2O+10NH3∙H2O+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+24H2O
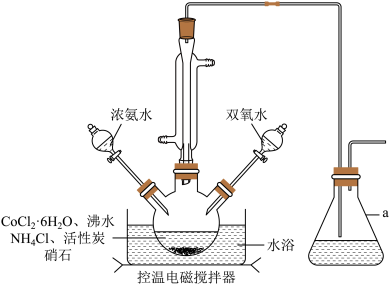
实验装置如图,具体流程如下:
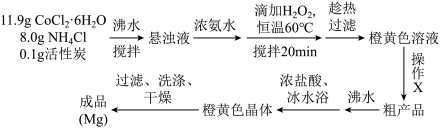
请回答下列问题:
(1)仪器a的名称为___________ 。加入双氧水的操作方法是___________ 。
(2)操作X为___________ 。
(3)活性炭在本实验中的作用主要是___________ 。
(4)提纯粗产品时,加入浓盐酸并用冰水浴冷却的目的是___________ 。
(5)洗涤橙黄色晶体,下列方法中最合适的是___________ 。
A. 先用盐酸洗,后用乙醇洗
B. 先用盐酸洗,后用冷水洗
C. 先用冷水洗,后用乙醇洗
D. 先用乙醇洗,后用冷水洗
(6)本实验在干燥成品时,一般采用沸水浴干燥的方式,可能的原因是___________ 。
(7)称取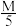 g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为
g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为___________ 。(2Co3++2I﹣=2Co2++I2,I2+2S2O =2I﹣+S4O
=2I﹣+S4O )
)

实验装置如图,具体流程如下:

请回答下列问题:
(1)仪器a的名称为
(2)操作X为
(3)活性炭在本实验中的作用主要是
(4)提纯粗产品时,加入浓盐酸并用冰水浴冷却的目的是
(5)洗涤橙黄色晶体,下列方法中最合适的是
A. 先用盐酸洗,后用乙醇洗
B. 先用盐酸洗,后用冷水洗
C. 先用冷水洗,后用乙醇洗
D. 先用乙醇洗,后用冷水洗
(6)本实验在干燥成品时,一般采用沸水浴干燥的方式,可能的原因是
(7)称取
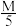 g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为
g成品溶于NaOH溶液中,煮沸蒸出全部NH3后将溶液用酸酸化,加入50.00mL 0.5000mol∙L-1的KI溶液(过量)和淀粉指示剂,然后用0.2000mol∙L-1的Na2S2O3标准溶液滴定,至终点时恰好消耗Na2S2O3标准溶液40.00mL,计算本实验的产率为 =2I﹣+S4O
=2I﹣+S4O )
)
您最近一年使用:0次
解题方法
10 . 磷酸铁 是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备
是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备 。
。
步骤i:洗涤——分别用X、水洗涤;
步骤ii:酸浸——用稀硫酸溶解;
步骤iii:氧化——用双氧水氧化;
步骤iv:沉铁——用 溶液沉淀
溶液沉淀 ;
;
步骤v:分离——过滤、洗涤、干燥,最后得到 。
。
(1)洗涤是为了除去废铁屑表面的油污,则X通常是热的___________ 溶液(填化学式)。
(2)酸浸时发生的反应除了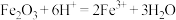 、
、 外,还可能有
外,还可能有___________ (写离子方程式)。
(3)检验 全部被氧化的实验方法是
全部被氧化的实验方法是___________ 。
(4)沉铁时有 沉淀和
沉淀和 生成,则该反应的离子方程式为
生成,则该反应的离子方程式为___________ 。
(5)研究发现,不同 对
对 沉淀的影响如表所示:
沉淀的影响如表所示:
当 时随
时随 的增加,
的增加, 的沉淀率开始下降,而
的沉淀率开始下降,而 沉淀率未下降,其原因可能为
沉淀率未下降,其原因可能为____ 。
 是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备
是合成锂电池正极材料磷酸铁锂的前驱体,工业上以废铁屑为原料经过如下步骤制备 。
。步骤i:洗涤——分别用X、水洗涤;
步骤ii:酸浸——用稀硫酸溶解;
步骤iii:氧化——用双氧水氧化;
步骤iv:沉铁——用
 溶液沉淀
溶液沉淀 ;
;步骤v:分离——过滤、洗涤、干燥,最后得到
 。
。(1)洗涤是为了除去废铁屑表面的油污,则X通常是热的
(2)酸浸时发生的反应除了
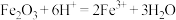 、
、 外,还可能有
外,还可能有(3)检验
 全部被氧化的实验方法是
全部被氧化的实验方法是(4)沉铁时有
 沉淀和
沉淀和 生成,则该反应的离子方程式为
生成,则该反应的离子方程式为(5)研究发现,不同
 对
对 沉淀的影响如表所示:
沉淀的影响如表所示: | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | |
| 沉降率/% |  | 90.0 | 94.6 | 97.9 | 99.2 | 95.3 |
 | 88.1 | 95.4 | 97.2 | 98.5 | 99.8 | |
当
 时随
时随 的增加,
的增加, 的沉淀率开始下降,而
的沉淀率开始下降,而 沉淀率未下降,其原因可能为
沉淀率未下降,其原因可能为
您最近一年使用:0次



