解题方法
1 . SnO2是锡的重要氧化物,现以锡锑渣(主要含塑料及SnO2、Sb4O6、PbO2)为原料,提纯SnO2的工艺流程图如下:
②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“沉铅”时同时生成S沉淀的化学方程式_______ 。
(3)“还原”时Na3SbO4发生的离子方程式为_______ 。
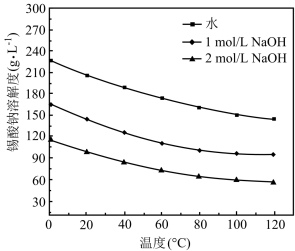
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。_______ 。
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为_______ 、用_______ 洗涤、干燥。
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为_______ 。

②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是
(2)“沉铅”时同时生成S沉淀的化学方程式
(3)“还原”时Na3SbO4发生的离子方程式为
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
| A.工业制粗硅 | B.电解熔融氯化钠制钠 |
| C.氧化汞分解制汞 | D.工业炼铁 |
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为
您最近一年使用:0次
解题方法
2 . A~G均代表常见化合物,且A、D、E、F、G均含同种金属阳离子,转化关系如图所示,C在常温下为液体,F俗称为小苏打,请回答下列问题:_______ ,F→D:_______ 。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为_______ 。
(3)请写出反应②的离子方程式:_____ ,该反应中的氧化剂与还原剂的质量之比为______ 。
(4)检验 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为_______ 。
(5)取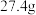 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重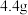 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为_______ ,原固体粉末中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
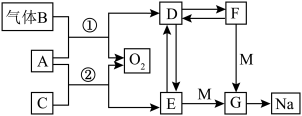
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为
(3)请写出反应②的离子方程式:
(4)检验
 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为(5)取
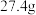 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为 的质量分数为
的质量分数为
您最近一年使用:0次
名校
3 . 海洋是生命的摇篮,浩瀚的海洋中蕴藏着丰富的资源。人们可以从海水中提取淡水和制得一些重要的化工产品。海水提溴的工艺流程如图所示。
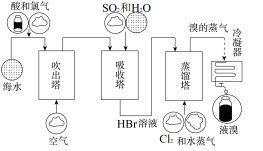
(1)工业上通过
 制备Mg,常用的冶炼方法是
制备Mg,常用的冶炼方法是 ,利用了溴的
,利用了溴的A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)写出吸收塔中发生反应的离子方程式:
(3)某同学提出,证明HBr溶液中含有Br的实验方案是:取出少量溶液,先加入过量新制氯水,再加入淀粉—KI溶液,观察溶液是否变蓝。该方案是否合理并简述理由:
(4)蒸馏塔在蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:
(5)从海水中获得淡水的主要方法有电渗析法、反渗透法和
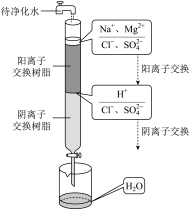
A.经过阳离子交换树脂后,水溶液中阳离子总数减少
B.通过阴离子交换树脂后,水溶液中只 被除去
被除去
C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应:
您最近一年使用:0次
2024-03-28更新
|
160次组卷
|
2卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期开学考试化学试题
名校
4 . 银催化剂在石油化工生产中应用广泛,但使用一段时间后催化活性降低或失效。从失效的废银催化剂中回收银具有极高的社会、经济价值。废银催化剂主要由银和α-氧化铝及少量二氧化硅组成,其回收工艺流程如下:

已知:α-氧化铝不溶于硝酸;AgCl能与 反应生成溶于水的
反应生成溶于水的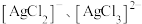 等离子。
等离子。
回答下列问题:
(1)酸浸时,反应的离子方程式为___________ ;酸浸时选用低温的原因是 ___________ ;为防止污染,可将气体产物用空气氧化为红棕色气体,再用氢氧化钠溶液吸收,从该吸收液中可回收的盐有___________ (填化学式)。
(2)沉银时,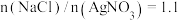 ,若NaCl过量太多,对银的沉淀率的影响是
,若NaCl过量太多,对银的沉淀率的影响是___________ (填“增大”“减小”或“无影响”)。
(3)Ag2O熔炼生成单质银,此金属冶炼方法的名称是___________ 。
(4)AgCl沉淀还可以在氨水中用水合肼(化学式N2H4·H2O) 还原为海绵状单质银,氧化产物为氮气,反应的化学方程式为___________ 。
(5)本实验所用废银催化剂含银6.46% (质量分数),100g试样可回收单质银6.37g,回收率为(保留3位有效数字)___________ 。

已知:α-氧化铝不溶于硝酸;AgCl能与
 反应生成溶于水的
反应生成溶于水的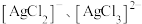 等离子。
等离子。回答下列问题:
(1)酸浸时,反应的离子方程式为
(2)沉银时,
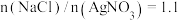 ,若NaCl过量太多,对银的沉淀率的影响是
,若NaCl过量太多,对银的沉淀率的影响是(3)Ag2O熔炼生成单质银,此金属冶炼方法的名称是
(4)AgCl沉淀还可以在氨水中用水合肼(化学式N2H4·H2O) 还原为海绵状单质银,氧化产物为氮气,反应的化学方程式为
(5)本实验所用废银催化剂含银6.46% (质量分数),100g试样可回收单质银6.37g,回收率为(保留3位有效数字)
您最近一年使用:0次
2024-02-13更新
|
67次组卷
|
2卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
5 . 锡在材料、医药、化工等方面有广泛的应用,锡精矿 中主要有
中主要有 、S、
、S、 、
、 、
、 等杂质元素。下图为锡的冶炼工艺流程。
等杂质元素。下图为锡的冶炼工艺流程。 性质稳定,难溶于酸。
性质稳定,难溶于酸。
回答下列问题:
(1)锡的原子序数为50,其价层电子排布式为_______ ,在元素周期表中位于______ 区。
(2)烟尘中的主要杂质元素是______ (填元素符号)。
(3)酸浸时, 生成
生成 ,该反应的离子方程式为
,该反应的离子方程式为_____ ,为了提高铅的浸出率,最宜添加____ (填标号)。
A. B.
B. C.
C. D.
D.
(4)还原时需加入过量的焦炭,写出该反应的化学方程式_______ 。
(5)电解精炼时,以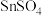 和少量
和少量 作为电解液,电源的负极与
作为电解液,电源的负极与_____ (填“粗锡”或“精锡”)相连; 的作用是
的作用是_______ 、______ 。
(6)酸浸滤液中的 可用
可用 沉淀,并通过与强碱反应获得
沉淀,并通过与强碱反应获得 ,写出
,写出 与熔融
与熔融 反应的化学方程式
反应的化学方程式______ 。
 中主要有
中主要有 、S、
、S、 、
、 、
、 等杂质元素。下图为锡的冶炼工艺流程。
等杂质元素。下图为锡的冶炼工艺流程。
 性质稳定,难溶于酸。
性质稳定,难溶于酸。回答下列问题:
(1)锡的原子序数为50,其价层电子排布式为
(2)烟尘中的主要杂质元素是
(3)酸浸时,
 生成
生成 ,该反应的离子方程式为
,该反应的离子方程式为A.
 B.
B. C.
C. D.
D.
(4)还原时需加入过量的焦炭,写出该反应的化学方程式
(5)电解精炼时,以
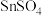 和少量
和少量 作为电解液,电源的负极与
作为电解液,电源的负极与 的作用是
的作用是(6)酸浸滤液中的
 可用
可用 沉淀,并通过与强碱反应获得
沉淀,并通过与强碱反应获得 ,写出
,写出 与熔融
与熔融 反应的化学方程式
反应的化学方程式
您最近一年使用:0次
2024-01-23更新
|
733次组卷
|
4卷引用:2024年1月江西普通高等学校招生考试适应性测试化学试题
2024年1月江西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)T15-工业流程题内蒙古通辽市科尔沁左翼中旗实验高级中学2023-2024学年高三下学期4月月考理综试题-高中化学
解题方法
6 . 海水资源的利用具有非常广阔的前景。下面是海水综合利用联合工业体系的简图:

请回答下列问题:
(1)流程图中Na和Mg的冶炼方法叫___________ ;没有涉及到的分离方法是___________ (填“字母编号”)。

(2)工业制备NaOH,工业常用电解饱和食盐水的方法,发生的化学方程式为___________ 。
(3)海水提溴时,向海水中通入Cl2就应经得到Br2,又用热空气吹出后加SO2还原,再通Cl2氧化为Br2的目的是___________ 。请写出SO2和Br2一起通入水中的离子方程式___________ 。
(4)海水提Mg过程中,工业上沉镁时选用石灰乳而不使用NaOH溶液的原因是___________ ;从MgCl2·6H2O脱水形成无水MgCl2的实验装置如下图所示,其中装置A的作用是___________ 。


请回答下列问题:
(1)流程图中Na和Mg的冶炼方法叫

(2)工业制备NaOH,工业常用电解饱和食盐水的方法,发生的化学方程式为
(3)海水提溴时,向海水中通入Cl2就应经得到Br2,又用热空气吹出后加SO2还原,再通Cl2氧化为Br2的目的是
(4)海水提Mg过程中,工业上沉镁时选用石灰乳而不使用NaOH溶液的原因是

您最近一年使用:0次
名校
7 . Ⅰ.地球上的金属矿物资源是有限的,应合理开发利用。
(1)金属冶炼的实质是金属离子被______ (填“氧化”或“还原”)生成金属单质。
(2)铜在自然界存在于多种矿石中,如:
请回答下列问题:
①上表所列铜化合物中,推断铜的质量百分含量最高的是______ 。
② 其中Cu为+2价、Fe为+2价,高温焙烧时发生的反应是
其中Cu为+2价、Fe为+2价,高温焙烧时发生的反应是 ,焙烧过程中被还原的元素有
,焙烧过程中被还原的元素有______ 。
③工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:,该反
应中氧化剂是______ 。
④ 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为__________________ 。
Ⅱ.某校化学兴趣小组通过查阅资料得知用海水获取氯化钠和金属镁的实验流程如图所示,请你根据题意回答下列问题。
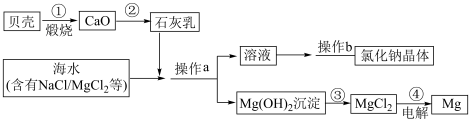
(3)①②③④四个反应中属于复分解反应的是____________ 。
(1)金属冶炼的实质是金属离子被
(2)铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 |  |  |  |
①上表所列铜化合物中,推断铜的质量百分含量最高的是
②
 其中Cu为+2价、Fe为+2价,高温焙烧时发生的反应是
其中Cu为+2价、Fe为+2价,高温焙烧时发生的反应是 ,焙烧过程中被还原的元素有
,焙烧过程中被还原的元素有③工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:,该反

应中氧化剂是
④
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为Ⅱ.某校化学兴趣小组通过查阅资料得知用海水获取氯化钠和金属镁的实验流程如图所示,请你根据题意回答下列问题。

(3)①②③④四个反应中属于复分解反应的是
您最近一年使用:0次
8 . 目前,世界上多采用电解熔融氯化钠的方法来生产金属钠: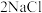 (熔融)
(熔融)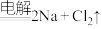 。已知A、B、C、D、E、F有如图转化关系。
。已知A、B、C、D、E、F有如图转化关系。 化学方程式:
化学方程式:___________ 。
(2)C电离方程式___________ 。
(3)E和F生成 离子方程式
离子方程式___________ 。
(4)工业生产中常利用B与 反应来制备漂白粉,写出反应的化学方程式
反应来制备漂白粉,写出反应的化学方程式___________ 。
(5)检验D溶液中含有 的方法是
的方法是___________ 。
(6)若向E溶液中继续通入 ,写出反应的化学方程式
,写出反应的化学方程式___________ 。
(7)若把A投入盛有D的溶液中,写出总反应的离子方程式___________ 。
 (熔融)
(熔融)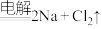 。已知A、B、C、D、E、F有如图转化关系。
。已知A、B、C、D、E、F有如图转化关系。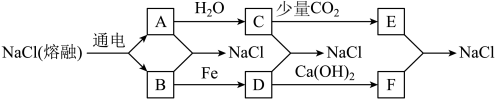
 化学方程式:
化学方程式:(2)C电离方程式
(3)E和F生成
 离子方程式
离子方程式(4)工业生产中常利用B与
 反应来制备漂白粉,写出反应的化学方程式
反应来制备漂白粉,写出反应的化学方程式(5)检验D溶液中含有
 的方法是
的方法是(6)若向E溶液中继续通入
 ,写出反应的化学方程式
,写出反应的化学方程式(7)若把A投入盛有D的溶液中,写出总反应的离子方程式
您最近一年使用:0次
2023-12-12更新
|
47次组卷
|
2卷引用:天津市第五十五中学2023-2024学年高一上学期期中检测化学试题
名校
解题方法
9 . 合理、高效利用金属矿物。将金属从其化合物中还原出来用于生产和制造各种金属材料,利用金属活动性的不同,可以采用不同的冶炼方法。
(1)以 为原料冶炼
为原料冶炼 ,冶炼方法是
,冶炼方法是_______ ,下列能用该方法制得的金属是_______ (填字母)。
A. B.
B. C.
C.
(2)明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(已知炉甘石的主要成分为碳酸锌)。下列说法不正确的是_______(填字母)。
(3)铝热法是冶炼金属的方法之一(如下图),写出铝热法炼铁的化学方程式_______ 。引发铝热反应的实验操作是_______ 。

(4)金属镁的冶炼有多种方法,其中一种以白云石(主要成分为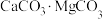 )为原料,经高温煅烧生成氧化物
)为原料,经高温煅烧生成氧化物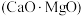 ,氧化物在还原炉中经
,氧化物在还原炉中经 真空条件下用硅铁(硅铁含硅量达
真空条件下用硅铁(硅铁含硅量达 )还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如图:
)还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如图:
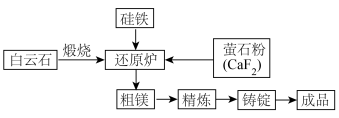
①萤石粉作为活性剂,可增强冶炼过程中的打渣能力,用电子式表示 的形成过程
的形成过程_______ 。
②写出还原炉中高温下发生置换反应的化学方程式_______ 。
(1)以
 为原料冶炼
为原料冶炼 ,冶炼方法是
,冶炼方法是A.
 B.
B. C.
C.
(2)明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(已知炉甘石的主要成分为碳酸锌)。下列说法不正确的是_______(填字母)。
| A.煤炭中起作用的主要元素是碳 |
| B.该冶炼锌的方法属于热还原法 |
| C.倭铅是指金属锌和铅的混合物 |
D.冶炼 的反应方程式为 的反应方程式为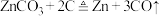 |
(3)铝热法是冶炼金属的方法之一(如下图),写出铝热法炼铁的化学方程式

(4)金属镁的冶炼有多种方法,其中一种以白云石(主要成分为
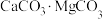 )为原料,经高温煅烧生成氧化物
)为原料,经高温煅烧生成氧化物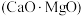 ,氧化物在还原炉中经
,氧化物在还原炉中经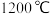 真空条件下用硅铁(硅铁含硅量达
真空条件下用硅铁(硅铁含硅量达 )还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如图:
)还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如图:
①萤石粉作为活性剂,可增强冶炼过程中的打渣能力,用电子式表示
 的形成过程
的形成过程②写出还原炉中高温下发生置换反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 锌在冶金、化学电源等方面具有重要作用,是一种应用广泛的金属。以闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料,制备金属锌的流程如图所示:

回答下列问题:
(1)“焙烧”过程排放烟气中含有大量的SO2,直接排放会污染空气,用___________ 吸收后可制得氮肥。该反应的离子方程式为___________ 。
(2)①用稀硫酸完全溶浸后,过滤所得滤渣1的主要成分为___________ 。
②“溶浸”“氧化除杂”“还原除杂”工序中都需要过滤,过滤需要的玻璃仪器有烧杯、___________ 和___________ 。
③常温下,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10-5mol/L时认为沉淀完全):
“氧化除杂”中调pH的范围是___________ 。
(3)溶液中的C可用锌粉除去,“还原除杂”中反应的离子方程式为___________ 。
(4)用惰性电极电解硫酸锌溶液制备单质锌时,阳极的电极反应式为___________ ;沉积锌后的电解液可返回___________ 工序继续使用。
(5)下列金属冶炼的方法与本工艺电解冶炼锌方法相似的是___________(填序号)。

回答下列问题:
(1)“焙烧”过程排放烟气中含有大量的SO2,直接排放会污染空气,用
(2)①用稀硫酸完全溶浸后,过滤所得滤渣1的主要成分为
②“溶浸”“氧化除杂”“还原除杂”工序中都需要过滤,过滤需要的玻璃仪器有烧杯、
③常温下,有关离子沉淀的pH如下表所示(当离子浓度为1.0×10-5mol/L时认为沉淀完全):
| Fe3+ | Zn2+ | Cd2+ | |
| 开始沉淀pH | 2.3 | 6.2 | 7.4 |
| 沉淀完全pH | 3.3 | 8.7 | 9.4 |
(3)溶液中的C可用锌粉除去,“还原除杂”中反应的离子方程式为
(4)用惰性电极电解硫酸锌溶液制备单质锌时,阳极的电极反应式为
(5)下列金属冶炼的方法与本工艺电解冶炼锌方法相似的是___________(填序号)。
| A.高炉炼铁 | B.电解熔融的氯化钠制钠 |
| C.铝热反应制锰 | D.电镀硫酸铜废水回收金属铜 |
您最近一年使用:0次



