1 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_______ (填序号)。
(2)海带中含有碘元素。实验室提取碘的步骤如图所示:

①海带灰中含有硫酸镁、碳酸钠等,在实验步骤_______ (填序号)中实现与碘分离。
②写出步骤④反应的离子方程式_______ 。提取碘的过程中,不能选择乙醇代替CCl4提取碘单质的原因_______ 。
(1)无需经过化学变化就能从海水中获得的物质是
| A.食盐 | B.溴 | C.烧碱 | D.纯碱 |

①海带灰中含有硫酸镁、碳酸钠等,在实验步骤
②写出步骤④反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 海水资源开发利用的部分过程如图所示。下列说法正确的是
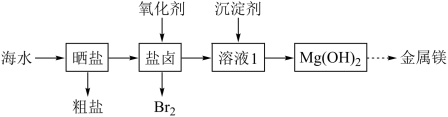
A.向盐卤中通入的氧化剂可以是 | B.工业生产中常选用NaOH作为沉淀剂 |
| C.粗盐可采用沉淀、过滤和结晶等过程提纯 | D.常用电解熔融氧化镁的方法制备金属Mg |
您最近一年使用:0次
名校
解题方法
3 . 海洋是一个巨大的资源宝库,从海水中可制得食盐等多种产品并加以利用。下图所示以食盐为原料进行生产并综合利用的某些过程。
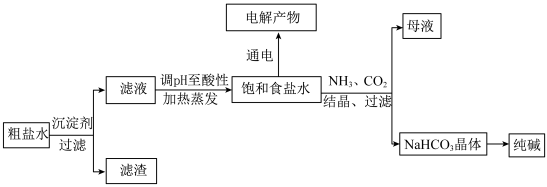
(1)除去粗盐中的 、
、 和
和 离子,加入下列沉淀剂,沉淀剂加入顺序正确的是__________。
离子,加入下列沉淀剂,沉淀剂加入顺序正确的是__________。
① ②
② ③
③
(2)将滤液的 调至酸性除去的离子是
调至酸性除去的离子是__________ 。
(3)若向分离出 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是__________ 。
(4)纯碱在生产、生活中有广泛的应用。
①生成 的总反应的化学方程式为
的总反应的化学方程式为______________________________ 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与 反应制取有效成分为
反应制取有效成分为 的消毒液,其反应的离子方程式是
的消毒液,其反应的离子方程式是__________ 。
(已知次氯酸的酸性介于碳酸和碳酸氢根之间)。
(5)①对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重
增重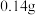 ,则固体
,则固体 的质量为
的质量为__________  。
。
②向母液中加入 粉末,存在
粉末,存在 过程。为使
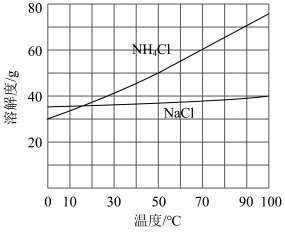
过程。为使 沉淀充分析出并分离,根据
沉淀充分析出并分离,根据 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为__________ 、__________ 、洗涤、干燥。
(6)无水 可作为基准物质标定盐酸浓度。称量前,若无水
可作为基准物质标定盐酸浓度。称量前,若无水 保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果
保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果__________ (填标号)。
A.偏高 B.偏低 C.不变

(1)除去粗盐中的
 、
、 和
和 离子,加入下列沉淀剂,沉淀剂加入顺序正确的是__________。
离子,加入下列沉淀剂,沉淀剂加入顺序正确的是__________。①
 ②
② ③
③
| A.③①② | B.③②① | C.②③① | D.②①③ |
(2)将滤液的
 调至酸性除去的离子是
调至酸性除去的离子是(3)若向分离出
 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是(4)纯碱在生产、生活中有广泛的应用。
①生成
 的总反应的化学方程式为
的总反应的化学方程式为②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与
 反应制取有效成分为
反应制取有效成分为 的消毒液,其反应的离子方程式是
的消毒液,其反应的离子方程式是(已知次氯酸的酸性介于碳酸和碳酸氢根之间)。
(5)①对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重
增重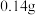 ,则固体
,则固体 的质量为
的质量为 。
。②向母液中加入
 粉末,存在
粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据
沉淀充分析出并分离,根据 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(6)无水
 可作为基准物质标定盐酸浓度。称量前,若无水
可作为基准物质标定盐酸浓度。称量前,若无水 保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果
保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果A.偏高 B.偏低 C.不变
您最近一年使用:0次
4 . Ⅰ.海洋约占地球表面积的71%,其中的水资源和其他化学资源具有十分巨大的开发潜力。可见海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
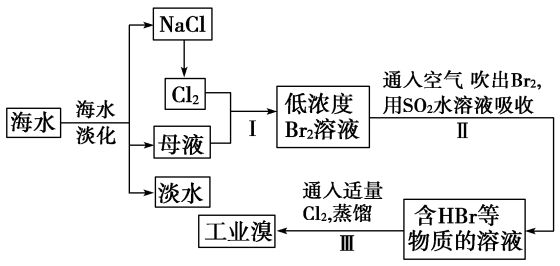
(1)步骤Ⅰ中已获得 ,步骤Ⅱ中又将
,步骤Ⅱ中又将 还原为
还原为 ,其目的为
,其目的为___________ 。
(2)步骤Ⅱ用 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为___________ 。
Ⅱ.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料: 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
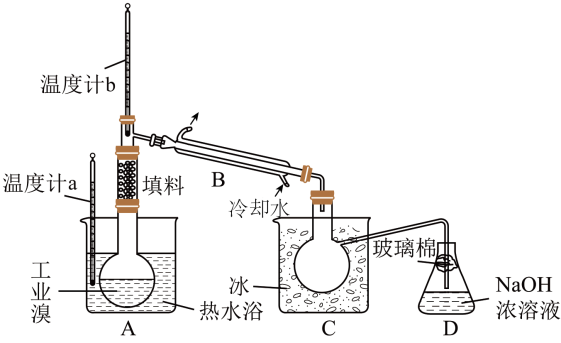
请你参与分析讨论:
(3)该套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是___________ 。
(4)C中液体产物颜色为___________ 。为除去该产物中仍残留的少量 ,可向其中加入NaBr溶液,充分反应后,再进行蒸馏分离,实验过程中A处加热B处通冷水时先
,可向其中加入NaBr溶液,充分反应后,再进行蒸馏分离,实验过程中A处加热B处通冷水时先___________ 后___________ (填加热、通冷水)。

(1)步骤Ⅰ中已获得
 ,步骤Ⅱ中又将
,步骤Ⅱ中又将 还原为
还原为 ,其目的为
,其目的为(2)步骤Ⅱ用
 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为Ⅱ.某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:
 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
(3)该套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
(4)C中液体产物颜色为
 ,可向其中加入NaBr溶液,充分反应后,再进行蒸馏分离,实验过程中A处加热B处通冷水时先
,可向其中加入NaBr溶液,充分反应后,再进行蒸馏分离,实验过程中A处加热B处通冷水时先
您最近一年使用:0次
解题方法
5 . 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。回答下列问题:
(1)请写出海水淡化的一种方法:___________ 。
(2)从海水中提取的粗盐中含有 、
、 、
、 等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是
等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是___________ (填字母)。
利用海水可以提取溴和镁,提取过程如下,___________ 。
(4)操作②为___________ 。
(5)提取溴的过程中,经过2次 转化的目的是
转化的目的是___________ 。
(6)吸收塔中发生反应的离子方程式为___________ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_________________________________ 。
(7)工业上常用上述流程“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36gBr2,若提取率为60%,则原海水中溴的浓度为___________ mg/L。
(1)请写出海水淡化的一种方法:
(2)从海水中提取的粗盐中含有
 、
、 、
、 等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是
等杂质离子,精制时常用的试剂有:a稀盐酸;b氯化钡溶液;c氢氧化钠溶液;d碳酸钠溶液。加入试剂的正确顺序是利用海水可以提取溴和镁,提取过程如下,
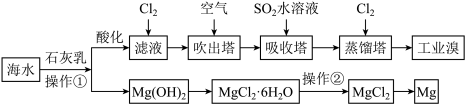
(4)操作②为
(5)提取溴的过程中,经过2次
 转化的目的是
转化的目的是(6)吸收塔中发生反应的离子方程式为
(7)工业上常用上述流程“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36gBr2,若提取率为60%,则原海水中溴的浓度为
您最近一年使用:0次
2023-02-20更新
|
291次组卷
|
2卷引用:天津市南开区2022~2023 学年高三上学期阶段性质量监测 (二) 化学试题
名校
解题方法
6 . 海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是

| A.工业上通过电解饱和MgCl2溶液制取金属镁 |
| B.工业生产上常选用Ca(OH)2作为母液中的沉淀剂 |
C.④中反应的离子方程式为:SO2+2H2O+Br2=2H+ +SO +2HBr +2HBr |
| D.过程①加入试剂的顺序为:Na2CO3 溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
您最近一年使用:0次
2021-07-17更新
|
287次组卷
|
4卷引用:天津市杨柳青一中、咸水沽一中 、四十七中,一百中学四校2022-2023学年高一下学期期末联考化学试题
天津市杨柳青一中、咸水沽一中 、四十七中,一百中学四校2022-2023学年高一下学期期末联考化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)(已下线)综合 期末压轴80题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)四川省遂宁市2020-2021学年高一下学期期末考试化学试题
解题方法
7 . 海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请根据该图回答下列问题:
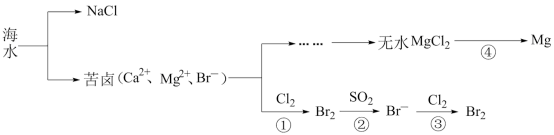
(1)淡化海水的方法有___ (写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、___ (填化学式),之后___ (填操作名称),再加入适量___ (填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)反应④由无水MgCl2制取金属镁的常用工业方法是___ 。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是___ 。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的离子方程式___ ,最后再用H2SO4处理所得溶液重新得到Br2。

(1)淡化海水的方法有
 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、(2)反应④由无水MgCl2制取金属镁的常用工业方法是
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的离子方程式
您最近一年使用:0次
2021-07-02更新
|
276次组卷
|
2卷引用:天津市滨海新区2020-2021学年高一下学期期末考试化学试题
解题方法
8 . 下图所示为海水综合利用的部分流程,下列有关说法正确的是
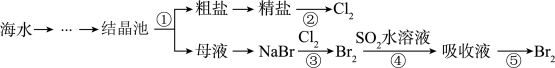

| A.实验室进行步骤①需要坩埚、玻璃棒等仪器 |
| B.步骤②是一个将化学能转化为电能的过程 |
| C.步骤③、⑤涉及的化学反应均为氧化还原反应 |
| D.步骤④中的离子方程式为 SO2+Br2+2H2O=4H++SO32-+2Br- |
您最近一年使用:0次
名校
解题方法
9 . 某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的碳酸钠溶液;②加入稍过量的氢氧化钠溶液;③加入稍过量的氯化钡溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
| A.③②⑤①④ | B.①②③⑤④ | C.②③①⑤④ | D.③⑤②①④ |
您最近一年使用:0次
2020-03-06更新
|
319次组卷
|
14卷引用:天津市西青区杨柳青第一中学2021-2022学年高一下学期线上教学质量检测化学试题
天津市西青区杨柳青第一中学2021-2022学年高一下学期线上教学质量检测化学试题江西省玉山县二中2018-2019学年高一上学期第一次月考化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题甘肃省兰州市兰州新区高级中学2019-2020学年高一上学期期中考试化学试题河北省衡水市深州市中学2019-2020学年高一下学期期末考试化学试题苏教版(2020)高一必修第一册专题3第三单元 海洋化学资源的综合利用江西省余干县黄金埠中学2020-2021学年高一上学期第一次月考化学试题福建省福州市八县(市)一中2020-2021学年高一上学期期中联考化学试题福建省南安市侨光中学2020-2021学年高一上学期第二次阶段考化学试题河南省温县第一高级中学2021-2022学年高一上学期1月月考化学试题甘肃省会宁县第一中学2021-2022学年高一下学期期中(等级考)化学试题四川省内江市第六中学2022-2023学年高一下学期(创新班)入学考试化学试题 安徽省合肥市第一中学2022-2023学年高一下学期第一次月考化学试题
名校
10 . 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。
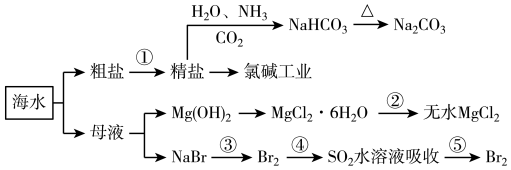
下列有关说法正确的是

下列有关说法正确的是
| A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3 |
| B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体 |
| C.可直接加热MgCl2·6H2O制备无水MgCl2 |
| D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大 |
您最近一年使用:0次
2019-10-29更新
|
417次组卷
|
6卷引用:天津市第三中学2021-2022学年高三上学期10月阶段性检测化学试题



