2022·浙江宁波·模拟预测
名校
1 . 下列说法不正确 的是
| A.工业制备硝酸的主要设备为热交换器、接触室和吸收塔 |
| B.工业炼铁时,铁矿石和焦炭从炼铁高炉的上口加入 |
| C.从海带中提取碘的工业生产步骤:浸泡→碱化→过滤→氧化→结晶→过滤→提纯 |
| D.玻璃是将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得的 |
您最近一年使用:0次
2022-05-23更新
|
1481次组卷
|
4卷引用:第16讲 金属材料与合金(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
(已下线)第16讲 金属材料与合金(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )浙江省宁波市鄞州中学2021~2022学年高三下学期高考考前测试化学试题山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)化学预测卷(八)-预测卷(浙江专版)
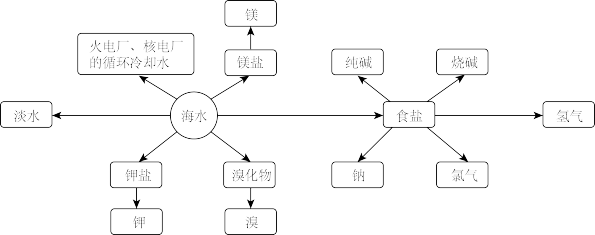
2 . 海洋是巨大的资源宝库,从海洋中获取的部分资源如图所示:
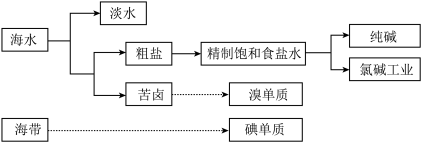
回答下列问题:
Ⅰ.微生物脱盐电池既可以实现海水的淡化,同时又能除去废水中的 和
和 ,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
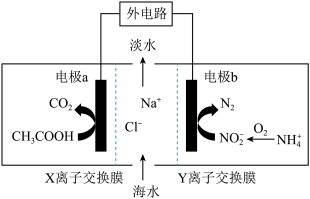
(1)电极b为电池的___________ 极(填正或负)。
(2)X离子交换膜为___________ 离子交换膜(填阴或阳)。
Ⅱ.溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:
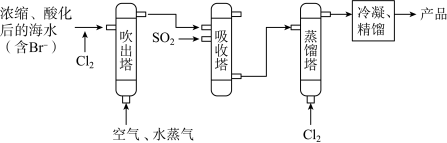
(3)吹出塔中采用气——液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是___________ 。
(4)写出蒸馏塔中反应的离子方程式___________ 。
Ⅲ.从海带中提取碘单质的流程如下:
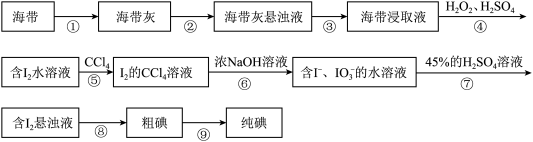
(5)上述流程中能循环使用的物质是___________ (填化学式)。
(6)步骤⑤的具体实验操作为:
A.将分液漏斗放在铁架台的铁圈中,静置、分层;
B.将含 水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;
水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转分液漏斗振荡,并不时旋开活塞放气,最后关闭活塞;
E.从分液漏斗上口倒出上层液体;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.旋开活塞,用烧杯接收下层液体;
上述实验操作的正确顺序为___________ (填序号),“操作A”静置、分层后的现象为___________ 。
(7)根据下表中有机物的性质分析,能代替步骤⑤中 的试剂是
的试剂是___________ (填试剂名称)。
(8)从海洋中获取资源涉及多种实验操作,为完成下列各组实验,所选仪器准确、完整的是___________ (填选项)。

回答下列问题:
Ⅰ.微生物脱盐电池既可以实现海水的淡化,同时又能除去废水中的
 和
和 ,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
,原理如图所示,中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
(1)电极b为电池的
(2)X离子交换膜为
Ⅱ.溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:

(3)吹出塔中采用气——液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是
(4)写出蒸馏塔中反应的离子方程式
Ⅲ.从海带中提取碘单质的流程如下:

(5)上述流程中能循环使用的物质是
(6)步骤⑤的具体实验操作为:
A.将分液漏斗放在铁架台的铁圈中,静置、分层;
B.将含
 水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;
水溶液和适量四氯化碳加入分液漏斗中,盖好玻璃塞;C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转分液漏斗振荡,并不时旋开活塞放气,最后关闭活塞;
E.从分液漏斗上口倒出上层液体;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.旋开活塞,用烧杯接收下层液体;
上述实验操作的正确顺序为
(7)根据下表中有机物的性质分析,能代替步骤⑤中
 的试剂是
的试剂是| 试剂 | 性质 |
| 丙酮 | 无色液体,可以与水任意比例互溶, 易溶于丙酮 易溶于丙酮 |
| 氯仿 | 无色液体,不溶于水,密度比水大, 易溶于氯仿 易溶于氯仿 |
| 己烯 | 无色液体,不溶于水,密度比水小, 能与己烯发生化学反应 能与己烯发生化学反应 |
| 选项 | 实验 | 仪器 |
| A | 模拟海水晒盐制取粗盐 | 铁架台(带铁圈)、酒精灯、蒸发皿 |
| B | 将海带灼烧成海带灰 | 三脚架、酒精灯、坩埚、坩埚钳、玻璃棒 |
| C | 从含 的悬浊液中获取粗碘 的悬浊液中获取粗碘 | 铁架台(带铁圈)、普通漏斗、烧杯、玻璃棒 |
| D | 提纯粗碘制取纯碘 | 铁架台(带铁圈)、酒精灯、石棉网、烧杯、圆底烧瓶(盛有冷水) |
您最近一年使用:0次
2023-04-26更新
|
801次组卷
|
3卷引用: 山东省枣庄市台儿庄区2022-2023学年高一下学期期中考试化学试题
名校
3 . 海洋资源的利用具有非常广阔的前景。
回答下列问题:
Ⅰ.海水制盐
(1)粗盐中可溶性杂质离子包含 、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________ (填字母)。
a.NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
b.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
c.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
(2)精盐水可用于氯碱工业,请写出氯碱工业总反应的离子方程式___________ 。
Ⅱ.海水提溴
(3)工业上常用“吹出法”提溴,请写出用SO2吸收Br2的化学反应方程式___________ 。
(4)含Br2的海水经“空气吹出、SO2吸收、通入氯气”后再蒸馏的目的是___________ 。
Ⅲ.从海带中提取碘的实验过程如下图所示:
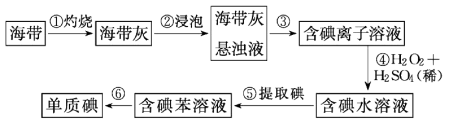
(5)步骤①中灼烧海带时,应将海带放入___________ (填仪器名称)中灼烧。
(6)请写出步骤④反应的离子方程式___________ 。
Ⅳ.海水淡化
(7)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是___________ 。

回答下列问题:
Ⅰ.海水制盐
(1)粗盐中可溶性杂质离子包含
 、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,加入试剂的顺序可为a.NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
b.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
c.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
(2)精盐水可用于氯碱工业,请写出氯碱工业总反应的离子方程式
Ⅱ.海水提溴
(3)工业上常用“吹出法”提溴,请写出用SO2吸收Br2的化学反应方程式
(4)含Br2的海水经“空气吹出、SO2吸收、通入氯气”后再蒸馏的目的是
Ⅲ.从海带中提取碘的实验过程如下图所示:

(5)步骤①中灼烧海带时,应将海带放入
(6)请写出步骤④反应的离子方程式
Ⅳ.海水淡化
(7)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是
您最近一年使用:0次
4 . 海洋资源的利用具有非常广阔的前景。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为_______ 。
(2)热空气吹出Br2,利用了溴的_______。
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为_______ 。
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
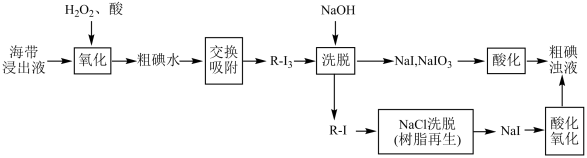
已知:①I2+I- I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤“交换吸附”发生的反应:R-Cl+I =R-I3+Cl-。
=R-I3+Cl-。
试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①_______ ;
②I2+I- I
I 。
。
依据整个生产流程分析是否可以加过量H2O2;_______ (填“是”或“否”)。并说明理由:_______ 。
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于_______ 。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为
(2)热空气吹出Br2,利用了溴的_______。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2+I-
 I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I
 )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤“交换吸附”发生的反应:R-Cl+I
 =R-I3+Cl-。
=R-I3+Cl-。试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
| A.交换吸附 | B.洗脱 | C.酸化 | D.NaCl洗脱 |
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①
②I2+I-
 I
I 。
。依据整个生产流程分析是否可以加过量H2O2;
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于
您最近一年使用:0次
2022-04-24更新
|
1132次组卷
|
4卷引用:福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题
福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题(已下线)8.1.1 金属矿物和海水资源的开发利用-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省广州市第六中学2021-2022学年高一下学期综合考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题
名校
5 . 海水化学资源开发利用中的提碘、提溴的部分过程如图所示。下列说法正确的是
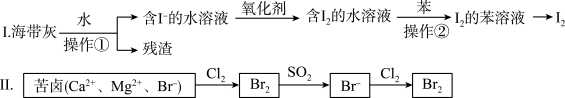
| A.I中操作①用到的玻璃仪器只有烧杯、玻璃棒、胶头滴管 |
| B.I中操作②的苯可用酒精代替 |
C.Ⅱ中SO2与Br2反应的化学方程式为: |
D.Ⅱ中还原性: |
您最近一年使用:0次
2023-04-08更新
|
618次组卷
|
3卷引用:山东省威海市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
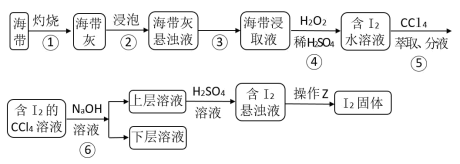
6 . 海带灰富含以I-形式存在的碘元素。在实验室中,从海带灰浸取液中提取碘单质的流程如图:
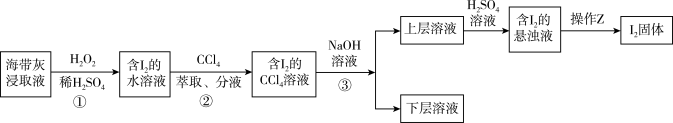
下列说法正确的是

下列说法正确的是
| A.为提高①中反应的速率,可增大硫酸浓度或在高温条件下进行 |
| B.操作②中CCl4,可用酒精、苯等代替 |
| C.操作③使用的是反萃取法,得到的上层溶液为紫红色 |
| D.操作Z所需的玻璃仪器有烧杯、玻璃棒、漏斗 |
您最近一年使用:0次
2022-07-07更新
|
544次组卷
|
4卷引用:山东省济南市2021-2022学年高一下学期期末考试化学试题
名校
解题方法
7 . 我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
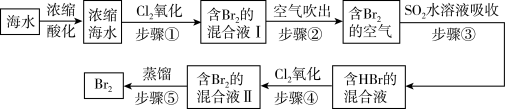
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有___ 个电子转移(用a和NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:____ 、____ 。
(5)“试剂a”通常应具有一定的____ 性。
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:____ 。
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是____ 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:
(5)“试剂a”通常应具有一定的
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水不互溶不与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是
A. | B. | C. | D. |
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是
您最近一年使用:0次
名校
解题方法
8 . 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。从海带中提取碘单质,工艺流程如图。
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需用到的主要仪器是_____ (填名称)。
(2)海带中碘元素的存在形式为_____ (用化学符号表示)。
(3)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。_____ 。
②静止、分层后,下层溶液的颜色为_____ 。
(4)步骤④中的H2O2可用以下_____ (填字母)试剂代替。
a.Cl2 b.Na2SO3 c.NaCl
(5)步骤⑤中,某学生选择用CCl4来萃取碘的理由_____ 。
(6)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为_____ 。每消耗1molI2转移电子数为_____ 。
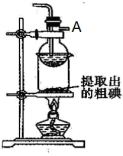
(7)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是_____ ;为得到较多较高纯度的单质碘,A容器中可盛放的试剂为_____ (填字母)。
a.冷水 b.热水 c.热氢氧化钠溶液
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需用到的主要仪器是
(2)海带中碘元素的存在形式为
(3)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。
②静止、分层后,下层溶液的颜色为
(4)步骤④中的H2O2可用以下
a.Cl2 b.Na2SO3 c.NaCl
(5)步骤⑤中,某学生选择用CCl4来萃取碘的理由
(6)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为
(7)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是
a.冷水 b.热水 c.热氢氧化钠溶液
您最近一年使用:0次
2023-03-17更新
|
481次组卷
|
2卷引用:山东省德州市第一中学2022-2023学年高一3月月考化学试题
名校
9 . 从海产品中提取碘是我国工业上获取碘的重要途径,实验室证明海带中存在碘元素的方法如下:
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的_______ (填标号)。
a. b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。
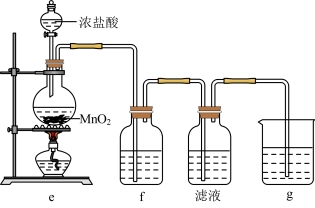
①装置e中发生反应的化学方程式是_______ 。
②装置f、g中所装的试剂分别是_______ 、_______ 。
③检验“滤液”中有碘单质生成的方法是_______ 。若通入 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是_______ 。
(3)“步骤Ⅲ”氧化剂氧化时,用 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是_______ 。
(4)若“步骤Ⅲ”所得溶液经过分离提纯获得 ,其物质的量是
,其物质的量是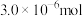 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是_______ mg/kg。
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的
a.
 b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。

①装置e中发生反应的化学方程式是
②装置f、g中所装的试剂分别是
③检验“滤液”中有碘单质生成的方法是
 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是(3)“步骤Ⅲ”氧化剂氧化时,用
 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是(4)若“步骤Ⅲ”所得溶液经过分离提纯获得
 ,其物质的量是
,其物质的量是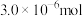 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是
您最近一年使用:0次
2022-07-20更新
|
508次组卷
|
3卷引用:辽宁省县级重点高中协作体2021-2022学年高一下学期期末考试化学试题
10 . 为了从海带浸取液中提取碘,某同学设计了如图实验方案,解答下列问题:
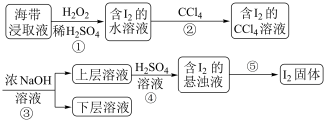
(1) 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因_______ ;_______
(2)实验操作②的名称为_______ ,操作②需要的仪器除烧杯、玻璃棒外,尚缺少的玻璃仪器有_______ ,碘的 溶液位于
溶液位于_______ 层(填“上”或“下”),呈_______ 色。检验水层是否仍含碘单质的方法是_______ 。
(3)③是将富集在 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为_______ 。
(4)本实验中可以循环利用的物质是_______ 。

(1)
 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因(2)实验操作②的名称为
 溶液位于
溶液位于(3)③是将富集在
 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为(4)本实验中可以循环利用的物质是
您最近一年使用:0次



