1 . 海带、紫菜等藻类植物含有丰富的碘元素。某化学实验小组同学从海带中提取碘并计算海带中的碘元素含量,进行以下实验:
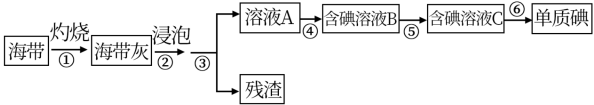
已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。乙同学认为甲的操作不合理,其理由是___________ 。
(2)海带提碘的一系列操作中需要过滤的步骤是___________ 。
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是___________ ;乙同学认为使用稀硫酸和 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由___________ 。
(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是___________ (填写字母)。
a.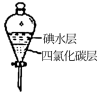 b.
b.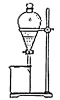
c. d.
d.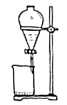
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:___________ 。
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为___________ 。

已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)海带提碘的一系列操作中需要过滤的步骤是
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是
 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是
a.
 b.
b.
c.
 d.
d.
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为
您最近一年使用:0次
2021-05-06更新
|
470次组卷
|
5卷引用:山东省枣庄市2020-2021学年高一下学期期中考试化学试题
山东省枣庄市2020-2021学年高一下学期期中考试化学试题(已下线)期末综合检测卷01【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)(已下线)第2章能力提升测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)山东省菏泽市单县第二中学2022-2023学年高一下学期3月段考化学试题陕西省西安市雁塔区第二中学、渭北中学2021-2022学年高二下学期期中联考化学试题
名校
2 . 碘主要用于制药物、染料和碘化合物等,海带、紫菜等藻类植物中富含碘元素。实验室中从海带中提取碘的流程如图。
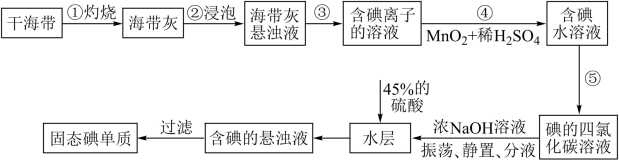
已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在___________________ (填仪器名称) 进行加热。
(2)步骤④发生反应的离子方程式为__________________ 。
(3)“过滤”操作用到的主要玻璃仪器有________________________ 。
(4)下列有关步骤⑤的叙述正确的是_________ (填序号)。
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为________________________ 。
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是______ (用离子方程式表示)。
②请用原子结构知识解释Cl2的氧化性强于I2的原因______________ 。

已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在
(2)步骤④发生反应的离子方程式为
(3)“过滤”操作用到的主要玻璃仪器有
(4)下列有关步骤⑤的叙述正确的是
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是
②请用原子结构知识解释Cl2的氧化性强于I2的原因
您最近一年使用:0次
解题方法
3 . 实验室从海带浸取液中提取碘单质。
(1)碘的结构与性质
①碘原子核外有5个电子层,最外层有7个电子,碘元素在周期表中的位置是_______ 。
②质子数为53、中子数为78的碘核素表示为_______ 。
③设计简单的实验验证氯的非金属性比碘强:_____ 。(须用试剂:新制氯水、KI溶液,淀粉溶液)
(2)提取碘单质
I.萃取氧化法:向浸取液中加入 ,调节pH为3~4,加入
,调节pH为3~4,加入 ,再加入
,再加入 溶液,反应一段时间后得到
溶液,反应一段时间后得到 的
的 溶液。
溶液。
①调pH时不用盐酸来替代 的主要原因是
的主要原因是_______ 。(填序号)
a.盐酸易挥发使溶液pH变化快, 不易挥发溶液pH缓慢
不易挥发溶液pH缓慢
b. 为弱电解质,反应过程中电离出
为弱电解质,反应过程中电离出 维持溶液的pH
维持溶液的pH
②加入 的作用是
的作用是_______ ,得到 的
的 溶液。
溶液。
II.双氧化法:把浸取液分成A、B两份,在 催化下用
催化下用 把A溶液中的
把A溶液中的 氧化为
氧化为 ,然后与B溶液混合,经盐酸酸化得到碘单质。
,然后与B溶液混合,经盐酸酸化得到碘单质。
③ 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
④A、B两份溶液的体积比为_______ 时,可使碘的提取率最高。
(3)废液的处理:提取碘后的酸性废液中含有少量的 、
、 ,向废液中加入适量
,向废液中加入适量 把
把 氧化成
氧化成 ,然后加入活性炭,过滤后排放。活性炭的作用是
,然后加入活性炭,过滤后排放。活性炭的作用是_______ 。
(1)碘的结构与性质
①碘原子核外有5个电子层,最外层有7个电子,碘元素在周期表中的位置是
②质子数为53、中子数为78的碘核素表示为
③设计简单的实验验证氯的非金属性比碘强:
(2)提取碘单质
I.萃取氧化法:向浸取液中加入
 ,调节pH为3~4,加入
,调节pH为3~4,加入 ,再加入
,再加入 溶液,反应一段时间后得到
溶液,反应一段时间后得到 的
的 溶液。
溶液。①调pH时不用盐酸来替代
 的主要原因是
的主要原因是a.盐酸易挥发使溶液pH变化快,
 不易挥发溶液pH缓慢
不易挥发溶液pH缓慢b.
 为弱电解质,反应过程中电离出
为弱电解质,反应过程中电离出 维持溶液的pH
维持溶液的pH②加入
 的作用是
的作用是 的
的 溶液。
溶液。II.双氧化法:把浸取液分成A、B两份,在
 催化下用
催化下用 把A溶液中的
把A溶液中的 氧化为
氧化为 ,然后与B溶液混合,经盐酸酸化得到碘单质。
,然后与B溶液混合,经盐酸酸化得到碘单质。③
 氧化
氧化 的离子方程式为
的离子方程式为④A、B两份溶液的体积比为
(3)废液的处理:提取碘后的酸性废液中含有少量的
 、
、 ,向废液中加入适量
,向废液中加入适量 把
把 氧化成
氧化成 ,然后加入活性炭,过滤后排放。活性炭的作用是
,然后加入活性炭,过滤后排放。活性炭的作用是
您最近一年使用:0次
名校
解题方法
4 . 海洋是一座巨大的化学资源宝库,如图是从海水中或海产品中提取若干种化学物质的流程图。
I.试剂级NaCl可用海盐(含泥沙、海藻、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。
等杂质)为原料制备。

(1)焙炒海盐的目的是______ 。
(2)根据除杂原理,填写合适的试剂③,并选择每步 预期沉淀的离子。
离子:a.Ca2+ b.Mg2+ c.Fe3+ d.SO
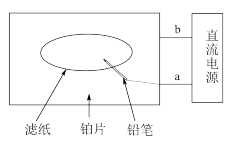
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是______ 。
II.国家海洋局科研学者考察了从浓海水中提溴的一种新型方法:聚四氟乙烯(PTFE)气态膜法提溴。本方法关键是采用了PTFE中空纤维膜,在该膜中,水不可以通过,而溴分子可以自主进入和脱离。
将氧化后的浓海水加入气态膜设备预处理,用NaOH溶液作为吸收液配合处理。处理过程的俯视截面示意图如图所示。经流出液氧化后的流出液检验,流出液中含BrO 离子。
离子。
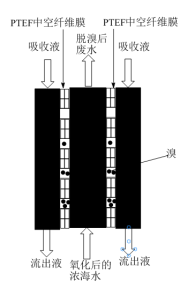
(4)浓海水中溴元素的存在形式是______ ,氧化浓海水时可选用的氧化剂是______ 。
(5)流出液中另外一种含溴物质是______ 。
(6)说明聚四氟乙烯(PTFE)气态膜是如何在上述过程中起到富集作用______ 。
III.小淳同学按如图实验过程,证明海带中存在碘元素。
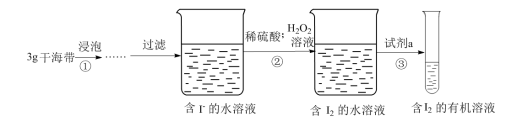
(7)H2O2的作用是______ 。
(8)试剂a不能选择的是(填序号)______ 。
(9)操作③的名称是______ 。
(10)操作③中需要振荡排放气体,放气时分液漏斗的状态是______ 。
小桢同学欲探究I-的性质,进行如图实验:
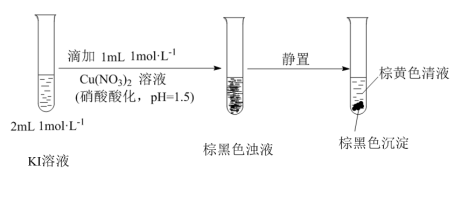
(11)该小组同学推测反应生成了I2。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,______ 。
进一步探究发现:棕黑色沉淀中含有CuI。
(12)由此推知:Cu(NO3)2与KI反应过程中,一定发生的反应的离子方程式为______ 。
I.试剂级NaCl可用海盐(含泥沙、海藻、Ca2+、Mg2+、Fe3+、SO
 等杂质)为原料制备。
等杂质)为原料制备。
(1)焙炒海盐的目的是
(2)根据除杂原理,填写合适的试剂③,并
离子:a.Ca2+ b.Mg2+ c.Fe3+ d.SO

| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 适量NaOH溶液 | ① |
| 步骤2 | 适量BaCl2溶液 | ② |
| 步骤3 | 适量③ | ④ |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是

| A.b极发生还原反应 | B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 | D.a处是负极 |
II.国家海洋局科研学者考察了从浓海水中提溴的一种新型方法:聚四氟乙烯(PTFE)气态膜法提溴。本方法关键是采用了PTFE中空纤维膜,在该膜中,水不可以通过,而溴分子可以自主进入和脱离。
将氧化后的浓海水加入气态膜设备预处理,用NaOH溶液作为吸收液配合处理。处理过程的俯视截面示意图如图所示。经流出液氧化后的流出液检验,流出液中含BrO
 离子。
离子。
(4)浓海水中溴元素的存在形式是
(5)流出液中另外一种含溴物质是
(6)说明聚四氟乙烯(PTFE)气态膜是如何在上述过程中起到富集作用
III.小淳同学按如图实验过程,证明海带中存在碘元素。

(7)H2O2的作用是
(8)试剂a不能选择的是(填序号)
| A.CCl4 | B.苯 | C.酒精 | D.直馏汽油 |
(9)操作③的名称是
(10)操作③中需要振荡排放气体,放气时分液漏斗的状态是
A.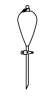 | B.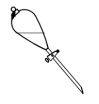 | C.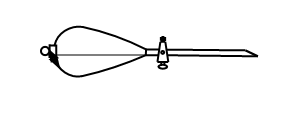 | D. |
小桢同学欲探究I-的性质,进行如图实验:

(11)该小组同学推测反应生成了I2。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,
进一步探究发现:棕黑色沉淀中含有CuI。
(12)由此推知:Cu(NO3)2与KI反应过程中,一定发生的反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 实验室里从海带中提取碘的流程如下:
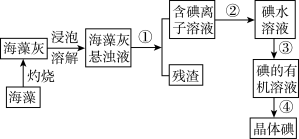
(1)提取碘的过程中有关实验的操作名称①_______ 、②_______ 、③_______ 、④_______ 。
(2)进行步骤①操作时,需要用到的玻璃仪器有:烧杯、漏斗和_______ 。进行步骤③操作时,需要用到的主要仪器是_______ 。
(3)写出上述过程中含I-的溶液通氯气后的离子方程式:_______ ,该反应中的氧化剂是_______ 。
(4)某同学想证明以上流程中的未知无色溶液中含有I-,现有以下试剂可供选择:
①新制氯水、②稀硝酸、③CCl4、④AgNO3溶液、⑤淀粉溶液。(完成以下填空)

(1)提取碘的过程中有关实验的操作名称①
(2)进行步骤①操作时,需要用到的玻璃仪器有:烧杯、漏斗和
(3)写出上述过程中含I-的溶液通氯气后的离子方程式:
(4)某同学想证明以上流程中的未知无色溶液中含有I-,现有以下试剂可供选择:
①新制氯水、②稀硝酸、③CCl4、④AgNO3溶液、⑤淀粉溶液。(完成以下填空)
| 方案 | 选用试剂(填标号) | 主要现象 |
| 1 | 未知溶液、 | |
| 2 | 未知溶液、 |
您最近一年使用:0次
名校
6 . 下列叙述不正确的是
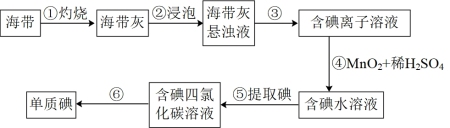

| A.步骤③的分离操作为过滤 |
| B.步骤④中理论上每产生1molI2,需要1molMnO2被氧化 |
| C.步骤⑥操作可以为先加入浓碱过滤,向水层再加入45%硫酸溶液分液,将碘提取出来 |
| D.步骤⑤中加入萃取剂后现象是溶液分层,下层为四氯化碳层呈紫色 |
您最近一年使用:0次
2022-05-15更新
|
196次组卷
|
3卷引用:北京市昌平区第一中学2021-2022学年高一下学期线上期中学情调研化学试题
北京市昌平区第一中学2021-2022学年高一下学期线上期中学情调研化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)北京市昌平区第一中学2022-2023学年高一上学期期中考试化学试题
名校
7 . 从海带浸泡液(碘元素主要以 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。 的作用为
的作用为_______ (填“氧化剂”或“还原剂”)。
(2)为提高①的化学反应速率,可采取的措施是_______ (写出一条即可)。
(3)补全②的离子方程式:_______ 。
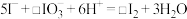
(4)②中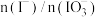 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。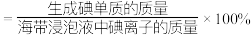
分析图中信息,选择最佳条件:_______ 。
 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。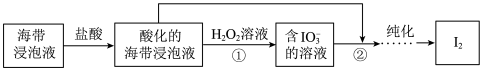
 的作用为
的作用为(2)为提高①的化学反应速率,可采取的措施是
(3)补全②的离子方程式:
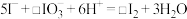
(4)②中
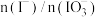 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。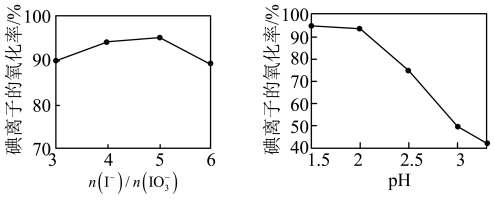
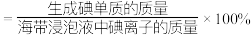
分析图中信息,选择最佳条件:
您最近一年使用:0次
2024-05-22更新
|
163次组卷
|
2卷引用:河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期6月月考化学试题
8 . 碘和碘化合物的用途广泛,实验室从海带中提取碘的步骤为:①海带灼烧,②溶解过滤,③在滤液中加入稀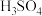 和
和 氧化,④用
氧化,④用 萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是
萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是
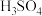 和
和 氧化,④用
氧化,④用 萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是
萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是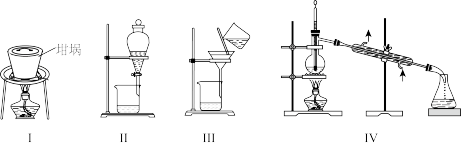
| A.用Ⅰ装置灼烧海带 | B.用Ⅱ装置萃取 | C.用Ⅲ装置过滤 | D.用Ⅳ装置蒸馏 |
您最近一年使用:0次
2022-04-09更新
|
387次组卷
|
4卷引用:黑龙江省黑河市五校2021-2022学年高一下学期期末联考化学试题
解题方法
9 . 海洋是巨大的资源宝库,孕育着丰富的矿产。海水资源的综合利用对人类的生产生活有重要意义。回答下列问题:
Ⅰ.从海带中提取碘的工艺流程如图所示:

(1)灼烧干海带需在仪器________ (填“蒸发皿”“坩埚”或“烧杯”)内进行。
(2)用蒸馏水浸取海带灰时,为提高浸取率,可采用的方法有_________ (填一种即可);
(3)将溶液中的I-氧化成I2,最佳选用试剂为_________(填标号)。
(4)欲证明水溶液中含有I2,实验方法为________________ 。
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:

(5)步骤①的离子方程式为___________ 。
(6)步骤②说明溴单质具有_________ 性,步骤③④的目的是______________ 。
(7)步骤③的还原剂若为 溶液,则其离子方程式为
溶液,则其离子方程式为____________ 。
Ⅰ.从海带中提取碘的工艺流程如图所示:

(1)灼烧干海带需在仪器
(2)用蒸馏水浸取海带灰时,为提高浸取率,可采用的方法有
(3)将溶液中的I-氧化成I2,最佳选用试剂为_________(填标号)。
| A.稀硝酸 | B.酸性 | C.浓硫酸 | D.稀硫酸、 |
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:

(5)步骤①的离子方程式为
(6)步骤②说明溴单质具有
(7)步骤③的还原剂若为
 溶液,则其离子方程式为
溶液,则其离子方程式为
您最近一年使用:0次
10 . 我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
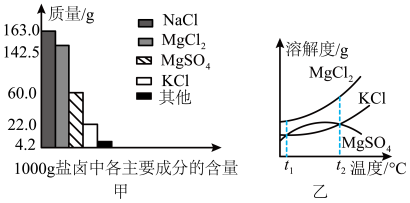
(1)根据图甲所示,写出盐卤中含量最多的盐为__________ 。(填化学式)
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到 以上,根据溶解度曲线,首先析出的晶体应是
以上,根据溶解度曲线,首先析出的晶体应是__________ 。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
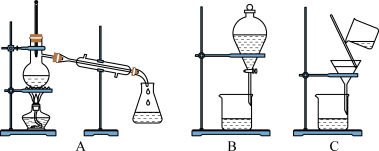
粗盐的提纯应选择图__________ (填字母,下同)装置,若实验中为了除去粗盐中的 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是__________ 。
A.NaOH、 、
、 、HCl B.NaOH、
、HCl B.NaOH、 、
、 、HCl
、HCl
C. 、
、 、NaOH、HCl D.
、NaOH、HCl D. 、NaOH、
、NaOH、 、HCl
、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的__________ (填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中 的存在,
的存在,______________________________ 。
(6)“提取碘”存在以下两种方案。
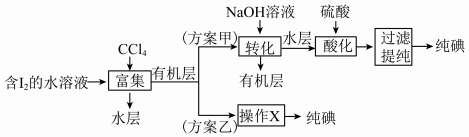
①方案乙中“操作X”的名称是__________ 。
②该流程可循环利用的物质是__________ 。
③采用方案乙得到纯碘的产率较低,原因是______________________________ 。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。

(1)根据图甲所示,写出盐卤中含量最多的盐为
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到
 以上,根据溶解度曲线,首先析出的晶体应是
以上,根据溶解度曲线,首先析出的晶体应是(3)如图是常用于混合物的分离和提纯的装置:

粗盐的提纯应选择图
 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是A.NaOH、
 、
、 、HCl B.NaOH、
、HCl B.NaOH、 、
、 、HCl
、HClC.
 、
、 、NaOH、HCl D.
、NaOH、HCl D. 、NaOH、
、NaOH、 、HCl
、HClⅡ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中
 的存在,
的存在,(6)“提取碘”存在以下两种方案。

①方案乙中“操作X”的名称是
②该流程可循环利用的物质是
③采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
2023-12-27更新
|
170次组卷
|
2卷引用:河北省保定市1+3联考2023-2024学年高一上学期12月月考化学试题



