工业上,常采用氧化还原方法处理尾气中的CO、NO。
【氧化处理法】沥青混凝土可作为反应:2CO(g)+O2(g)⇌2CO2(g)的催化剂。
图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
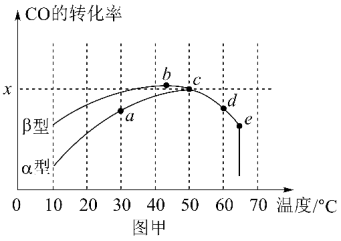
(1)在a、b、c、d四点中,未达到平衡状态的是___ 。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=___ (用含x的代数式表示)。
(3)下列关于图甲的说法正确的是__ 。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
【还原处理法】某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(含0.025molNO、0.5molO2和足量碳烟)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据,结果如图乙所示。
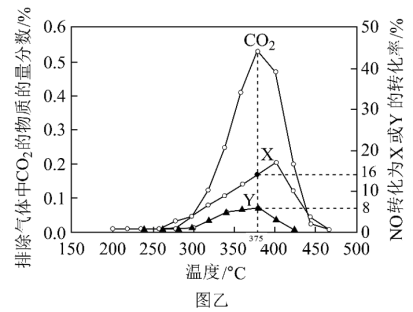
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为___ 。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___ 。
(6)工业上常用高浓度的K2CO3溶液吸收CO2,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括___ 和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:___ 。
【氧化处理法】沥青混凝土可作为反应:2CO(g)+O2(g)⇌2CO2(g)的催化剂。
图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(1)在a、b、c、d四点中,未达到平衡状态的是
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=
(3)下列关于图甲的说法正确的是
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
【还原处理法】某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(含0.025molNO、0.5molO2和足量碳烟)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据,结果如图乙所示。

(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是
(6)工业上常用高浓度的K2CO3溶液吸收CO2,再利用电解法使K2CO3溶液再生,其装置示意图如图:

①在阳极区发生的反应包括
②简述CO32-在阴极区再生的原理:
更新时间:2020-06-12 15:07:54
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氨在工业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:
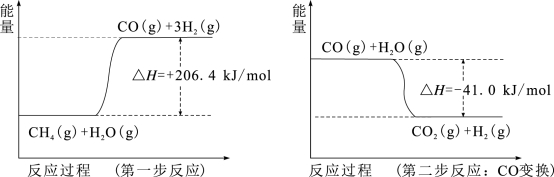
结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式_______ 。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
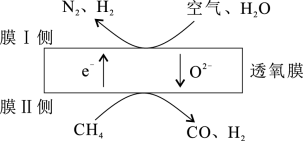
若膜Ⅰ侧所得气体 =1,写出上述过程反应方程式:
=1,写出上述过程反应方程式:_______ 。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是_______

a. Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ>KⅡ
b. Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
c. Ⅰ、Ⅱ两过程到达平衡的标志:混合气体平均相对分子质量不再变化
d. t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0mol N2和23.0mol H2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P )的关系图。
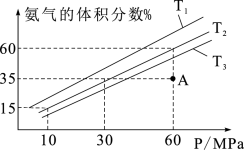
①T1、T2、T3由大到小的排序为_______ 。
②计算T2、60MPa 平衡体系的平衡常数Kp=_______ 。(保留两位有效数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(1)天然气蒸汽转化法是获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)

若膜Ⅰ侧所得气体
 =1,写出上述过程反应方程式:
=1,写出上述过程反应方程式:(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)
 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是
a. Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ>KⅡ
b. Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
c. Ⅰ、Ⅱ两过程到达平衡的标志:混合气体平均相对分子质量不再变化
d. t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0mol N2和23.0mol H2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P )的关系图。

①T1、T2、T3由大到小的排序为
②计算T2、60MPa 平衡体系的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】研究氮氧化物的性质具有重要的意义。
(1)NO可以催化 与
与 的反应:
的反应:
反应Ⅰ.
 kJ/mol
kJ/mol
反应Ⅱ.
 kJ/mol
kJ/mol
①下列说法正确的是:_____ 。
A.高温下有利于反应I的自发进行
B.反应Ⅱ的 对该反应的自发性影响不大
对该反应的自发性影响不大
C.恒温恒容下加入一定量 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行
D.NO催化下,一定量 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大
②据报道,瑞典某工厂利用上述反应制取硫酸。在合成 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是_____ 。
(2)密闭容器中加入一定量 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
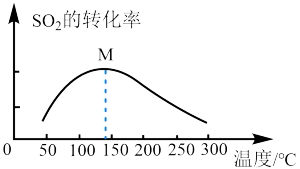
①由图可知,在M点之前,反应中 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:_____ 。
②250℃和常压下,等物质的量的 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数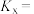
_____ 。( 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为_____ 。
(3)在一定温度下,一定量 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
(4)以固体催化剂催化CO还原NO生成 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),
请补充完整。
化学吸附: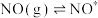 ;
;
表面反应: ;
;_____ :
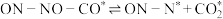 ;
;_____ 。
脱附: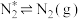 ;
;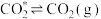
(1)NO可以催化
 与
与 的反应:
的反应:反应Ⅰ.

 kJ/mol
kJ/mol反应Ⅱ.

 kJ/mol
kJ/mol①下列说法正确的是:
A.高温下有利于反应I的自发进行
B.反应Ⅱ的
 对该反应的自发性影响不大
对该反应的自发性影响不大C.恒温恒容下加入一定量
 与
与 ,若容器内压强没有明显变化,说明不加催化剂时,
,若容器内压强没有明显变化,说明不加催化剂时, 与
与 的反应不能自发进行
的反应不能自发进行D.NO催化下,一定量
 与
与 反应一段时间后,升高温度,
反应一段时间后,升高温度, 的体积分数可能变大
的体积分数可能变大②据报道,瑞典某工厂利用上述反应制取硫酸。在合成
 时,向反应容器中适时通入冷激气(冷的原料气),其作用是
时,向反应容器中适时通入冷激气(冷的原料气),其作用是(2)密闭容器中加入一定量
 和
和 ,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得
,发生反应Ⅱ(忽略其它反应)。保持常压条件,经过相同时间,测得 的体积分数随温度的变化如图所示:
的体积分数随温度的变化如图所示:
①由图可知,在M点之前,反应中
 的体积分数随温度升高而减小,其原因为:
的体积分数随温度升高而减小,其原因为:②250℃和常压下,等物质的量的
 和
和 反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平
反应后,测得平衡时NO的物质的量分数为40%,则该反应的物质的量分数平 的转化率平衡常数
的转化率平衡常数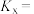
 是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中
是用平衡时物质的量分数代替平衡浓度计算)保持上述条件不变,提高原料中 的比例,使平衡时
的比例,使平衡时 的产率为90%。则
的产率为90%。则 和
和 的投料比(即起始时加入的物质的量之比)为
的投料比(即起始时加入的物质的量之比)为(3)在一定温度下,一定量
 分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。
分解成氮气和氧气,同时释放出热量。分解的部分实验数据如下表。反应一段时间后,只改变如下一个条件。下列说法正确的是:_____。| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
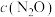 /mol·L /mol·L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
A.增大压强, 分解速率增大 分解速率增大 |
B.增大容器的体积,该分解反应平衡右移,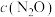 变小 变小 |
C.减小 的浓度,该分解反应速率减小 的浓度,该分解反应速率减小 |
| D.升高温度,容器内气体的压强一定变大 |
(4)以固体催化剂催化CO还原NO生成
 和
和 气体,反应历程如下(*表示吸附态),
气体,反应历程如下(*表示吸附态),请补充完整。
化学吸附:
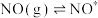 ;
;表面反应:
 ;
;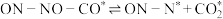 ;
;脱附:
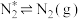 ;
;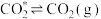
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l) 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
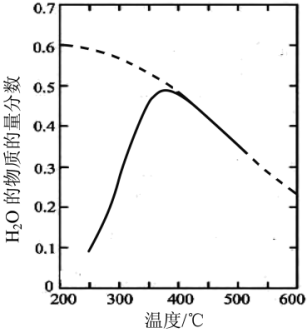
①已知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___ kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________ 。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________ 。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______ (填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g) C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g) C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________ 。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________ (填“甲”或“乙”):m值为____________ 。

③Bosch反应必须在高温下才能启动,原因是__________________ 。
sabatior反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)水电解反应:2H2O(l)
 2H2(g) + O2(g)
2H2(g) + O2(g)(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①已知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=
②温度过高或过低均不利于该反应的进行,原因是
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)
 C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)
 C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是

③Bosch反应必须在高温下才能启动,原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈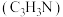 和副产物丙烯醛
和副产物丙烯醛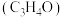 的热化学方程式如下:
的热化学方程式如下:
Ⅰ.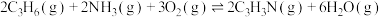

Ⅱ.

回答下列问题:
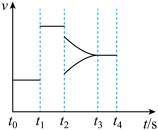
(1)如图表示在某一时间段密闭体系中反应Ⅰ的反应速率与反应进程的曲线关系。由图可知,正反应速率最快的时间段是_______ , 时刻表示体系改变的反应条件是
时刻表示体系改变的反应条件是_______ , 时刻表示体系改变的另一反应条件是
时刻表示体系改变的另一反应条件是_______ 。
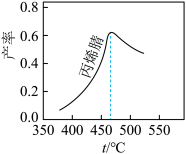
(2)在不同温度下反应进行相同时间,丙烯腈产率与反应温度的关系曲线如图,最高产率对应的温度为460℃。高于460℃时,丙烯腈产率下降的原因是_______ (答出两点即可)。
(3)一定条件下,在容积为V L的密闭容器中充入 、
、 、
、 各1mol发生反应,达到平衡时,容器内压强为
各1mol发生反应,达到平衡时,容器内压强为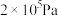 ,容器中
,容器中 和
和 的物质的量分别为0.3mol和1.5mol,此时
的物质的量分别为0.3mol和1.5mol,此时 的浓度为
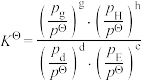
的浓度为_______  ,反应Ⅱ的标准平衡常数
,反应Ⅱ的标准平衡常数
_______ 。(已知:分压=总压×该组分物质的量分数,对于反应: ,
, ,其中
,其中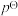 为标准压强
为标准压强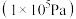 ,
,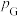 、
、 、
、 、
、 为各组分的平衡分压。)
为各组分的平衡分压。)
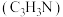 和副产物丙烯醛
和副产物丙烯醛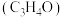 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
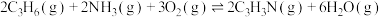

Ⅱ.


回答下列问题:
(1)如图表示在某一时间段密闭体系中反应Ⅰ的反应速率与反应进程的曲线关系。由图可知,正反应速率最快的时间段是
 时刻表示体系改变的反应条件是
时刻表示体系改变的反应条件是 时刻表示体系改变的另一反应条件是
时刻表示体系改变的另一反应条件是
(2)在不同温度下反应进行相同时间,丙烯腈产率与反应温度的关系曲线如图,最高产率对应的温度为460℃。高于460℃时,丙烯腈产率下降的原因是

(3)一定条件下,在容积为V L的密闭容器中充入
 、
、 、
、 各1mol发生反应,达到平衡时,容器内压强为
各1mol发生反应,达到平衡时,容器内压强为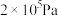 ,容器中
,容器中 和
和 的物质的量分别为0.3mol和1.5mol,此时
的物质的量分别为0.3mol和1.5mol,此时 的浓度为
的浓度为 ,反应Ⅱ的标准平衡常数
,反应Ⅱ的标准平衡常数
 ,
, ,其中
,其中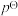 为标准压强
为标准压强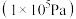 ,
,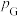 、
、 、
、 、
、 为各组分的平衡分压。)
为各组分的平衡分压。)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一、CO2耦合乙苯(C6H5-C2H5,简称EB)脱氢制备苯乙烯(C6H5-C2H3,简称ST)是综合利用CO2的热点研究领域。制备ST涉及的主要反应如下。回答下列问题:
a.EB(g)=ST(g)+H2(g)ΔH1
b.CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g)ΔH3=+158.8kJ·mol-1
(1)为提高EB平衡转化率,应选择的反应条件为___________(填标号)。
(2)在一定条件下,选择合适的催化剂只进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图1。已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是___________ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到40%时, =
=___________ 。
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图2所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[H2(g)]的曲线是___________ (填“甲”“乙”“丙”或“丁”);在温度T2、反应时间20min时,反应的正反应速率v正___________ (填“>”“=”或“<”)逆反应速率v逆。
(3)恒压0.1MPa下,改变原料气配比为下列三种情况:仅EB、n(EB)︰n(CO2)=1︰10、n(EB)︰n(N2)=1︰10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图3所示。
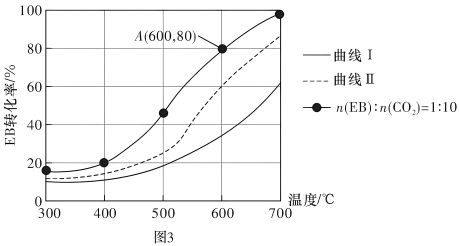
①图3中,表示原料气配比n(EB)︰n(N2)=1︰10的曲线是曲线___________ (填“I”或“Ⅱ”)。
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:___________ 。
③设 为相对压力平衡常数,其表达式写法:
为相对压力平衡常数,其表达式写法: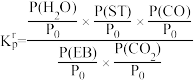 ,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的
,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的 为
为___________ 。
a.EB(g)=ST(g)+H2(g)ΔH1
b.CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g)ΔH3=+158.8kJ·mol-1
(1)为提高EB平衡转化率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
 CO(g)+H2O(g)。
CO(g)+H2O(g)。①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图1。已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图2所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[H2(g)]的曲线是

(3)恒压0.1MPa下,改变原料气配比为下列三种情况:仅EB、n(EB)︰n(CO2)=1︰10、n(EB)︰n(N2)=1︰10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图3所示。

①图3中,表示原料气配比n(EB)︰n(N2)=1︰10的曲线是曲线
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:
③设
 为相对压力平衡常数,其表达式写法:
为相对压力平衡常数,其表达式写法: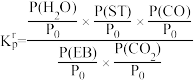 ,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的
,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的 为
为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】高效去除空气中的 和
和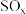 化合物一直是工业生产研究的主要课题。
化合物一直是工业生产研究的主要课题。
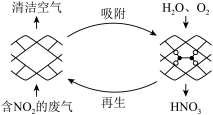
Ⅰ.某MOFs多孔材料能高效选择性吸附 ,将材料泡入水中并通入氧气能全部转化为
,将材料泡入水中并通入氧气能全部转化为 。原理示意图如下:
。原理示意图如下:
已知:①

②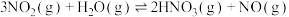

③

(1)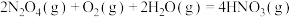

_______ 。
(2)若取一定质量的多孔材料吸收 至质量不改变,下列选项中能说明吸附反应已达到极限的是
至质量不改变,下列选项中能说明吸附反应已达到极限的是
Ⅱ.在不同温度下, 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压 如图所示。
如图所示。
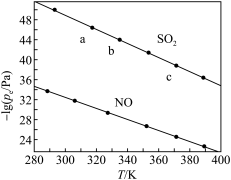
(3) 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为_______ , 的空间构型为
的空间构型为_______ 。
(4) 脱硫的离子方程式为
脱硫的离子方程式为 ,该反应的平衡常数表达式
,该反应的平衡常数表达式
_______ 。根据图像可知,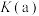 、
、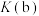 、
、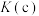 的大小关系为
的大小关系为_______ 。
Ⅲ.臭氧脱硝反应为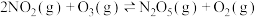 。T℃时,将
。T℃时,将 和
和 混合气体以物质的量之比2∶1充入一个容积为2L的恒容密闭容器中发生上述反应,测得
混合气体以物质的量之比2∶1充入一个容积为2L的恒容密闭容器中发生上述反应,测得 的物质的量随时间变化关系如下图所示:
的物质的量随时间变化关系如下图所示:
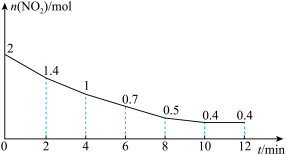
(5)①平衡时, 的体积分数=
的体积分数=_______ %(保留两位小数)。
②若起始压强为 ,T℃下反应的平衡常数
,T℃下反应的平衡常数
_______ ( 为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 和
和 化合物一直是工业生产研究的主要课题。
化合物一直是工业生产研究的主要课题。Ⅰ.某MOFs多孔材料能高效选择性吸附
 ,将材料泡入水中并通入氧气能全部转化为
,将材料泡入水中并通入氧气能全部转化为 。原理示意图如下:
。原理示意图如下:
已知:①


②
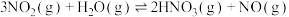

③


(1)
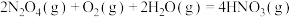

(2)若取一定质量的多孔材料吸收
 至质量不改变,下列选项中能说明吸附反应已达到极限的是
至质量不改变,下列选项中能说明吸附反应已达到极限的是| A.颜色不再发生变化 | B.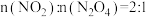 |
C. | D.混合气体的平均分子质量不再发生变化 |
Ⅱ.在不同温度下,
 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压 如图所示。
如图所示。
(3)
 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为 的空间构型为
的空间构型为(4)
 脱硫的离子方程式为
脱硫的离子方程式为 ,该反应的平衡常数表达式
,该反应的平衡常数表达式
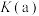 、
、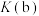 、
、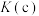 的大小关系为
的大小关系为Ⅲ.臭氧脱硝反应为
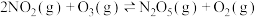 。T℃时,将
。T℃时,将 和
和 混合气体以物质的量之比2∶1充入一个容积为2L的恒容密闭容器中发生上述反应,测得
混合气体以物质的量之比2∶1充入一个容积为2L的恒容密闭容器中发生上述反应,测得 的物质的量随时间变化关系如下图所示:
的物质的量随时间变化关系如下图所示:
(5)①平衡时,
 的体积分数=
的体积分数=②若起始压强为
 ,T℃下反应的平衡常数
,T℃下反应的平衡常数
 为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
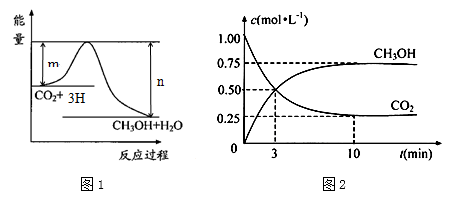
【推荐1】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
(1)写出该反应的热化学方程式__________________________ 。
(2)关于该反应的下列说法中,正确的是___________ 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:________________ 。
(4)温度降低,平衡常数K____________ (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=______________________ 。
(6)下列措施中能使n(CH3OH)/n(CO2)增大的有____________ 。
A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大
 CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
(1)写出该反应的热化学方程式
(2)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:
(4)温度降低,平衡常数K
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=
(6)下列措施中能使n(CH3OH)/n(CO2)增大的有
A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】有效去除大气中的NOx(主要是NO和NO2)是环境保护的重要课题。
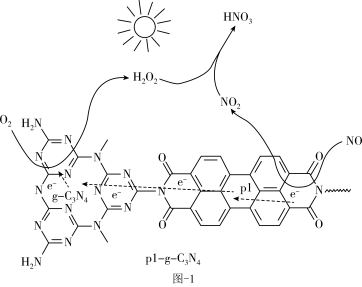
(1)用Pl-g-C3N4光催化氧化法脱除NO的过程如图-1所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2,Pl端的反应:___ 。
(2)次氯酸盐脱除NO的主要过程如下:
①NO+HClO=NO2+HCl
②NO+NO2+H2O 2HNO2
2HNO2
③HClO+HNO2=HNO3+HCl
下列分析正确的是___ 。
a.烟气中含有的少量O2能提高NO的脱除率
b.NO2单独存在时不能被脱除
c.脱除过程中,次氯酸盐溶液的pH下降
(3)NaClO溶液能有效脱除NO。25℃时,NO的脱除率随pH的变化如图-2所示;pH=4时,NO的脱除率随温度的变化如图-3所示。
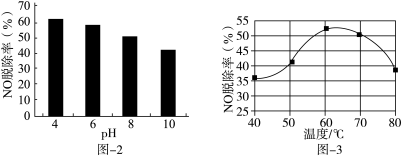
①25℃时,随着pH降低,NO的脱除率增大的原因:___ 。
②pH=4时,60~80℃NO的脱除率下降的原因:___ 。
(4)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变 ,NOx的去除率如图-4所示。
,NOx的去除率如图-4所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-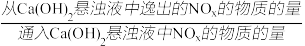 ×100%
×100%
① 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___ 。
②当 大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是
大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___ 。
③O3与NO反应的方程式为:NO+O3=NO2+O2,(该条件下不考虑O2与NO的反应)。保持NO的初始浓度不变,改变n(O3)/n(NO),将反应后的混合气体通入Ca(OH)2悬浊液中吸收。为节省O3的用量,又能保持NOx总去除效果好,则 合适的值范围为
合适的值范围为___ 。(保留两位小数)

(1)用Pl-g-C3N4光催化氧化法脱除NO的过程如图-1所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2,Pl端的反应:

(2)次氯酸盐脱除NO的主要过程如下:
①NO+HClO=NO2+HCl
②NO+NO2+H2O
 2HNO2
2HNO2③HClO+HNO2=HNO3+HCl
下列分析正确的是
a.烟气中含有的少量O2能提高NO的脱除率
b.NO2单独存在时不能被脱除
c.脱除过程中,次氯酸盐溶液的pH下降
(3)NaClO溶液能有效脱除NO。25℃时,NO的脱除率随pH的变化如图-2所示;pH=4时,NO的脱除率随温度的变化如图-3所示。

①25℃时,随着pH降低,NO的脱除率增大的原因:
②pH=4时,60~80℃NO的脱除率下降的原因:
(4)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变
 ,NOx的去除率如图-4所示。
,NOx的去除率如图-4所示。已知:NO与Ca(OH)2不反应;
NOx的去除率=1-
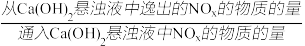 ×100%
×100%①
 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:②当
 大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是
大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是③O3与NO反应的方程式为:NO+O3=NO2+O2,(该条件下不考虑O2与NO的反应)。保持NO的初始浓度不变,改变n(O3)/n(NO),将反应后的混合气体通入Ca(OH)2悬浊液中吸收。为节省O3的用量,又能保持NOx总去除效果好,则
 合适的值范围为
合适的值范围为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】I.化工工业中常用乙苯脱氢的方法制备苯乙烯。
已知某温度下:
反应①:CO2 (g) +H2 (g)→CO(g) + H2O(g),ΔH = +41.2 kJ/mol;
反应②: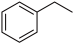 (g)→
(g)→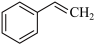 (g)+H2(g),ΔH= +117.6 kJ/mol;
(g)+H2(g),ΔH= +117.6 kJ/mol;
①②的化学反应平衡常数分别为K1、K2,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式____________________ ,该反应的化学平衡常数K=_________ (用K1、K2表示)
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是_____
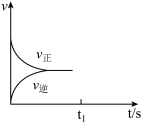
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注_______________ 。
II.一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
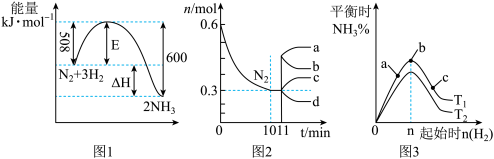
(4)升高温度,该反应的平衡常数________ (填“增大”或“减小”或“不变”)。
(5)由图2信息,计算10min内该反应的平均速率v(H2)=_______ ,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为_______ (填“a”或“b”或“c”或“d”)
(6)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________ 点,温度T1________ T2(填“>”或“=”或“<”)
已知某温度下:
反应①:CO2 (g) +H2 (g)→CO(g) + H2O(g),ΔH = +41.2 kJ/mol;
反应②:
 (g)→
(g)→ (g)+H2(g),ΔH= +117.6 kJ/mol;
(g)+H2(g),ΔH= +117.6 kJ/mol;①②的化学反应平衡常数分别为K1、K2,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若再加入1molCO2、1mol H2,平衡不移动; |
| C.若再加入CO2则平衡向正反应方向移动,CO的体积分数减小; |
| D.若充入He,平衡不移动,反应物和产物的浓度都不变; |

II.一定的条件下,合成氨反应为:N2(g)+3H2(g)
 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
(4)升高温度,该反应的平衡常数
(5)由图2信息,计算10min内该反应的平均速率v(H2)=
(6)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】2022年2月18日,“美丽中国·绿色冬奥”专场新闻发布会在北京新闻中心举行。发展碳捕集与利用的技术,将CO2转化为高附加值的化学品,实现CO2资源化利用,是一项重要的碳减排技术。
(一)CO2加氢(RWGS)制合成气(CO)
RWGS反应:
 反应ⅰ
反应ⅰ
副反应: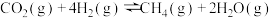
 反应ⅱ
反应ⅱ
(1)已知:
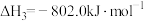
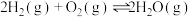
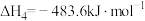
则
_______ 。
(2)当H2、CO2按体积比3:1投料时,RWGS反应的平衡组成如图1所示。
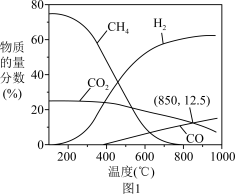
①
_______ 0(选填“>”、“<”或“=”);RWGS反应最佳温度为_______ (填序号)
A.300~350℃ B.400~450℃ C.700~750℃
②反应ⅰ的平衡常数表达式K=_______ 。
(二)CO2电催化转化合成气
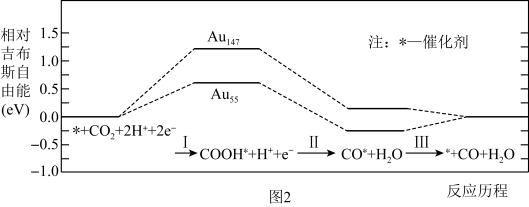
(3)CO2电还原反应机理如图2所示,由图可知,催化剂选择纳米Au55(纳米Au55指的是含55个原子的Au纳米颗粒),理由是_______ 。表示物种从催化剂表面解吸(物种与催化剂分离)的是过程_______ (选填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(三)电催化CO2还原制甲酸(HCOOH)
(4)图3为电催化CO2还原生产HCOOH的示意图。该电解池阳极的电极反应式为_______ ;总反应方程式为_______ 。

(一)CO2加氢(RWGS)制合成气(CO)
RWGS反应:

 反应ⅰ
反应ⅰ副反应:
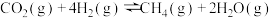
 反应ⅱ
反应ⅱ(1)已知:

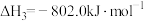
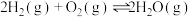
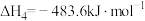
则

(2)当H2、CO2按体积比3:1投料时,RWGS反应的平衡组成如图1所示。

①

A.300~350℃ B.400~450℃ C.700~750℃
②反应ⅰ的平衡常数表达式K=
(二)CO2电催化转化合成气
(3)CO2电还原反应机理如图2所示,由图可知,催化剂选择纳米Au55(纳米Au55指的是含55个原子的Au纳米颗粒),理由是

(三)电催化CO2还原制甲酸(HCOOH)
(4)图3为电催化CO2还原生产HCOOH的示意图。该电解池阳极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=akJ/molK1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=bkJ/molK2
2CO(g)+O2(g)=2CO2(g) ΔH3=ckJ/mol K3
则催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的ΔH4=_______ ,平衡常数K4=_______ (用含K1、K2、K3的代数式表示)。
(2)催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如下图所示:

①该反应ΔH_______ 0(填“>”“<”“=”)
②由图可知,P1、P2、P3、P4由大到小的顺序为_______ 。
③在压强为P4、投料比n(CH4)/n(CO2)=1、950℃的条件下,X点平衡常数Kp=_______ 。
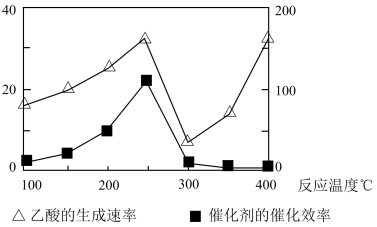
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率却在降低的原因是_______ 。
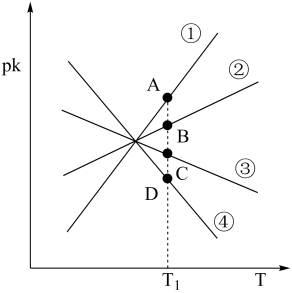
(4)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.17kJ/mol的正、逆反应速率可分别表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示的四条斜线中,能表示pk正(pk=-lgk)随T变化关系的是_______ (填序号)。
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。
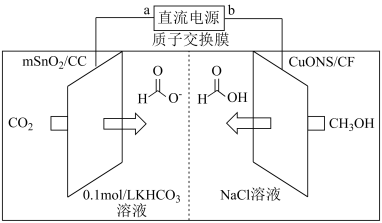
①电解过程中阳极电极反应式为_______ 。
②当有4molH+通过质子交换膜时,装置中生成HCOO-和HCOOH共计_______ mol。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=akJ/molK1
CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=bkJ/molK2
2CO(g)+O2(g)=2CO2(g) ΔH3=ckJ/mol K3
则催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的ΔH4=
(2)催化重整反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)中,测得CH4的平衡转化率与温度及压强的关系如下图所示:

①该反应ΔH
②由图可知,P1、P2、P3、P4由大到小的顺序为
③在压强为P4、投料比n(CH4)/n(CO2)=1、950℃的条件下,X点平衡常数Kp=
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率却在降低的原因是

(4)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.17kJ/mol的正、逆反应速率可分别表示为v正=k正c(CO2)•c(H2)、v逆=k逆c(CO)•c(H2O),则如图所示的四条斜线中,能表示pk正(pk=-lgk)随T变化关系的是

(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示。

①电解过程中阳极电极反应式为
②当有4molH+通过质子交换膜时,装置中生成HCOO-和HCOOH共计
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】根据下图回答下列问题
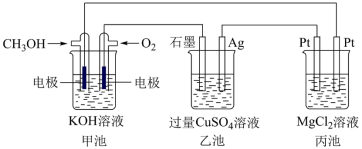
(1)图中甲池属于燃料电池,写出通入 一端的电极反应式为
一端的电极反应式为___________ 。从能量转换的角度分析比起直接燃烧燃料产生电能,使用燃料电池主要优点是___________ 。
(2)乙池发生反应的化学方程式为___________ ,反应一段时间后,向乙池中加入一定量___________ 固体,能使 溶液恢复到原浓度。
溶液恢复到原浓度。
(3)丙池左端Pt电极上产生的现象为___________ ,甲池中消耗448mL(标准状况下) ,此时丙池中理论上产生
,此时丙池中理论上产生___________ g固体。
(4)欲降低废水中重金属元素铬的毒性,可将 转化为
转化为 沉淀除去。在常温下,已知:
沉淀除去。在常温下,已知: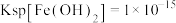 、
、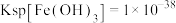 、
、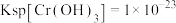 ,当离子浓度在
,当离子浓度在 以下时认为该离子已经完全沉淀,请回答:
以下时认为该离子已经完全沉淀,请回答:
①相同温度下 的溶解度
的溶解度___________  的溶解度(填“>”、“<”或“=”)
的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的 与10.0mol/L
与10.0mol/L 同时生成沉淀的pH范围是
同时生成沉淀的pH范围是___________ 。

(1)图中甲池属于燃料电池,写出通入
 一端的电极反应式为
一端的电极反应式为(2)乙池发生反应的化学方程式为
 溶液恢复到原浓度。
溶液恢复到原浓度。(3)丙池左端Pt电极上产生的现象为
 ,此时丙池中理论上产生
,此时丙池中理论上产生(4)欲降低废水中重金属元素铬的毒性,可将
 转化为
转化为 沉淀除去。在常温下,已知:
沉淀除去。在常温下,已知: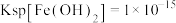 、
、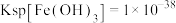 、
、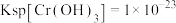 ,当离子浓度在
,当离子浓度在 以下时认为该离子已经完全沉淀,请回答:
以下时认为该离子已经完全沉淀,请回答:①相同温度下
 的溶解度
的溶解度 的溶解度(填“>”、“<”或“=”)
的溶解度(填“>”、“<”或“=”)②浓度为0.1mol/L的
 与10.0mol/L
与10.0mol/L 同时生成沉淀的pH范围是
同时生成沉淀的pH范围是
您最近一年使用:0次



