“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对工业生产、缓解环境污染、解决能源危机等具有重要意义。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_____________ 。
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______ ;
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为________ 溶液(填化学式)。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为_____ (填“a”或“b”),其判断依据是__________ 。
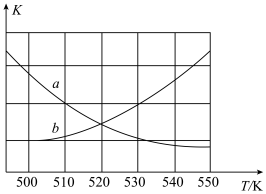
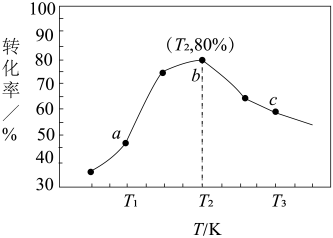
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为_____________ 。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为____ mol(结果保留三位有效数字)。
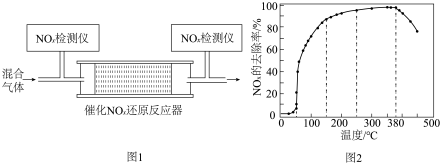
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______ ;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是____ 。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| H2CO3 | H2S | |
| Ka1 | 4.410-7 | 1.310-7 |
| Ka2 | 4.710-11 | 7.110-15 |
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为

(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是

更新时间:2020-06-20 10:32:44
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)  nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为
nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________ ;2 min末时Y的浓度为______________ ;化学方程式中n的值是________ 。
(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的氧氧键分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放________ kJ的能量。
(3)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
①碳元素在周期表中的位置是______________ ,甲烷与水相比较稳定的是__________ ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ,写出该反应的热化学方程式:____ 。
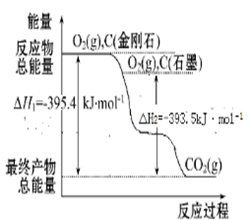
②碳有多种同素异形体,C60所属的晶体类型为__________ ,熔化时克服的作用力为 ____ ;金刚石属于____ 晶体,熔化时破坏的作用力是_________ ; 金刚石、石墨的能量关系如图所示,则金刚石和石墨相比,________ 更稳定。
 nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为
nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的氧氧键分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放
(3)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
①碳元素在周期表中的位置是
已知1g甲烷完全燃烧生成液态水时放热55.6kJ,写出该反应的热化学方程式:
②碳有多种同素异形体,C60所属的晶体类型为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,写出CO2与NaOH溶液反应的主要化学方程式__________ 。
(2)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2Ⅱ
CO(g)+H2O(g) ΔH2Ⅱ
某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
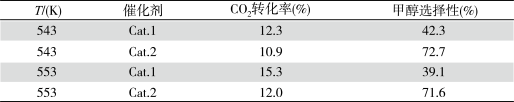
【备注】Cat.1∶Cu/ZnO纳米棒;Cat.2∶Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知: CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
H2O(l)= H2O(g) ΔH3 =+44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
①反应Ⅱ的ΔH2 =________ kJ·mol-1。
②研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是________ 。
③表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是_____________ 。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______ 。电池的正极反应式:6O2+6e-=6O2-;6CO2+6O2-=3C2 +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是________ 。该电池的总反应式:__________ 。

(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,写出CO2与NaOH溶液反应的主要化学方程式
(2)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1ⅠCO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2Ⅱ
CO(g)+H2O(g) ΔH2Ⅱ某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1∶Cu/ZnO纳米棒;Cat.2∶Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知: CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
H2O(l)= H2O(g) ΔH3 =+44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
①反应Ⅱ的ΔH2 =
②研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是
③表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:
 +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=_______ kJ/mol。
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。
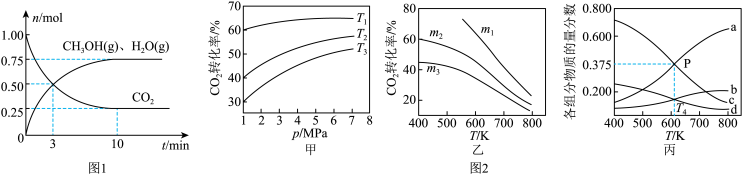
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②下列措施不能使CO2的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m= 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。
①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中m1、m2、m3从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
Ⅱ.甲醇的应用
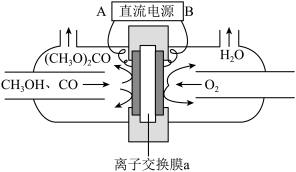
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为_______ (填“阳膜”或“阴膜”),阳极的电极反应式为_______ 。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=
 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。①图甲中投料比相同,温度从高到低的顺序为
②图乙中m1、m2、m3从大到小的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
Ⅱ.甲醇的应用
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Na2SO3是一种重要的还原剂。
(1)已知:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq) ∆H=mkJ/mol,O2(g)⇌O2(aq) ∆H=nkJ/mol,则Na2SO3溶液与O2(g)反应的热化学方程式为________ 。
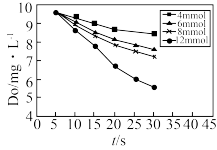
(2)291.5K时1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg/L,每5s记录溶解氧浓度,实验结果如图所示。当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg/L,则0~20s内Na2SO3的平均反应速率为________ mol∙L-1∙s-1。
(3)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k∙ca(SO32-),富氧区反应速率方程v=k∙c(SO32-)∙c(O2),k为常数。
①当溶解氧浓度为4.0mg/L,此时Na2SO3的氧化位于贫氧区时,c(SO32-)与速率数值关系如下表所示,则a=________ 。
②由富氧区速率方程v=k∙c(SO32-)∙c(O2),当其他条件不变时,SO32-、O2的浓度分别增大为原来的2倍,反应速率为原来的________ 倍。
(4)两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知ln(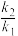 )=
)= ,R为常数,则Ea(富氧区)
,R为常数,则Ea(富氧区)________ (填“>”或“<”)Ea(贫氧区)。
(5)常温下,向H2SO3溶液中逐滴滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。(不考虑H2SO3、SO32-的氧化)
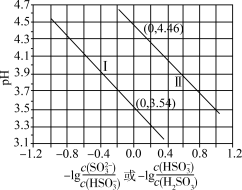
①向H2SO3溶液中滴加NaOH至过量,滴加过程中水的电离程度变化趋势是______ 。
②由图分析,表示pH与-lg 的变化关系是曲线
的变化关系是曲线__________ (填“Ⅰ”或“Ⅱ”),亚硫酸的二级电离平衡常数Ka2为_________ mol/L(用指数表示)。
(1)已知:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq) ∆H=mkJ/mol,O2(g)⇌O2(aq) ∆H=nkJ/mol,则Na2SO3溶液与O2(g)反应的热化学方程式为
(2)291.5K时1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg/L,每5s记录溶解氧浓度,实验结果如图所示。当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg/L,则0~20s内Na2SO3的平均反应速率为

(3)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k∙ca(SO32-),富氧区反应速率方程v=k∙c(SO32-)∙c(O2),k为常数。
①当溶解氧浓度为4.0mg/L,此时Na2SO3的氧化位于贫氧区时,c(SO32-)与速率数值关系如下表所示,则a=
| c(SO32-)×10-3 | 3.65 | 5.65 | 7.3 | 11.65 |
| V×106 | 10.2 | 24.5 | 40.8 | 104.4 |
②由富氧区速率方程v=k∙c(SO32-)∙c(O2),当其他条件不变时,SO32-、O2的浓度分别增大为原来的2倍,反应速率为原来的
(4)两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知ln(
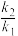 )=
)= ,R为常数,则Ea(富氧区)
,R为常数,则Ea(富氧区)| 反应阶段 | 速率方程 | k(297.9K)/k(291.5K) |
| 富氧区 | v=k∙c(SO32-)∙c(O2) | 1.47 |
| 贫氧区 | v=k∙ca(SO32-)∙cb(O2) | 2.59 |
(5)常温下,向H2SO3溶液中逐滴滴加NaOH溶液,混合溶液的pH与离子浓度变化的关系如图所示。(不考虑H2SO3、SO32-的氧化)

①向H2SO3溶液中滴加NaOH至过量,滴加过程中水的电离程度变化趋势是
②由图分析,表示pH与-lg
 的变化关系是曲线
的变化关系是曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】减少污染、保护环境是当前全世界最热门的课题,习近平主席在中共中央政治局第六次集体学习时强调,要清醒认识保护生态环境、治理环境污染的紧迫性和艰巨性。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1;C(s)+1/2O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1则焦炭与水蒸气反应生成CO的热化学方程式为__________ 。
②可以用含下列那些物质的洗涤剂来洗涤含SO2的烟气_________ (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
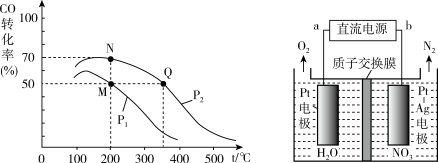
① M、N两点平衡状态下,容器中所有物质的总的物质的量之比为:n(M)总:n(N)总=____ 。
②若M、N、Q三点的平衡常数为KM、KN、KQ,则三者大小关系为_________ 。(用>,=,<表示)
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为________________ 。
②电化学降解NO3-的原理如前图所示,若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为___________________ 。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1;C(s)+1/2O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1则焦炭与水蒸气反应生成CO的热化学方程式为
②可以用含下列那些物质的洗涤剂来洗涤含SO2的烟气
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
① M、N两点平衡状态下,容器中所有物质的总的物质的量之比为:n(M)总:n(N)总=
②若M、N、Q三点的平衡常数为KM、KN、KQ,则三者大小关系为
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为
②电化学降解NO3-的原理如前图所示,若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g)△H>0.
Fe(s)+CO2(g)△H>0.
已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值________ (填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向__________ 进行(填“左”或“右”).
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
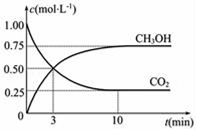
①反应开始至平衡,氢气的平均反应速率v(H2)=__________ ,CO2的转化率为_______ .
该温度下上述反应的平衡常数K=____________ (分数表示).
②反应达到平衡后,下列能使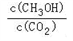 的值增大的措施是
的值增大的措施是_________ (填符号)。
a.升高温度 b.再充入H2 c.再充入CO2
d.将H2O(g)从体系中分离 e.充入He(g)
③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:_________________ 。
④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由__________________________ 。
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)
 Fe(s)+CO2(g)△H>0.
Fe(s)+CO2(g)△H>0.已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①反应开始至平衡,氢气的平均反应速率v(H2)=
该温度下上述反应的平衡常数K=
②反应达到平衡后,下列能使
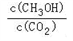 的值增大的措施是
的值增大的措施是a.升高温度 b.再充入H2 c.再充入CO2
d.将H2O(g)从体系中分离 e.充入He(g)
③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:
④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】烯烃是重要的化工原料,如乙烯、苯乙烯、丁二烯等。
(1)目前生产苯乙烯的方法主要是乙苯脱氢法,反应原理如下:
①则
___________ 。
②实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。掺入水蒸气的目的是___________ 。
③乙苯的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。 ,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
___________ kPa(列出计算式即可, 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
(2) 经催化加氢合成乙烯:
经催化加氢合成乙烯: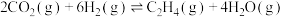
 。恒容条件下,按
。恒容条件下,按 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:___________ 、___________ 的浓度。
②升高温度,平衡常数K___________ (填“减小”、“增大”或“不变”)。A点,
___________ (用 表示)。写出能提高乙烯平衡产率的措施
表示)。写出能提高乙烯平衡产率的措施___________ (任举两种)。
(3)丁二烯与卤素反应为有机合成的重要步骤,1,3-丁二烯和 反应的能量随反应过程的变化关系如图所示:
反应的能量随反应过程的变化关系如图所示: 反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为
反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为___________ 。
②T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)( )和
)和 各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
在0~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4-加成产物)=___________ 。
(1)目前生产苯乙烯的方法主要是乙苯脱氢法,反应原理如下:
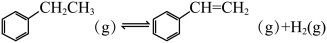
 。
。
| 共价键 |  |  |  |  |
键能 | 347.7 | 413.4 | 615 | 436 |

②实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。掺入水蒸气的目的是
③乙苯的平衡转化率与温度、投料比
 的关系如图所示。
的关系如图所示。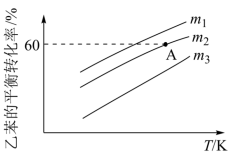
 ,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
,保持体系总压为常压(101kPa),则A点温度下,该反应的平衡常数
 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。(2)
 经催化加氢合成乙烯:
经催化加氢合成乙烯: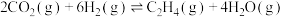
 。恒容条件下,按
。恒容条件下,按 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
②升高温度,平衡常数K

 表示)。写出能提高乙烯平衡产率的措施
表示)。写出能提高乙烯平衡产率的措施(3)丁二烯与卤素反应为有机合成的重要步骤,1,3-丁二烯和
 反应的能量随反应过程的变化关系如图所示:
反应的能量随反应过程的变化关系如图所示: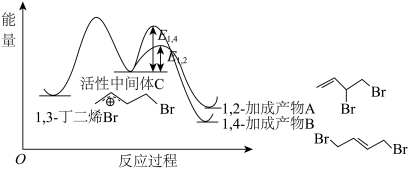
 反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为
反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为②T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(
 )和
)和 各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| 1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
| 1,2-加成产物 | 0% | 26% | 10% | 4% | 4% |
| 1,4-加成产物 | 0% | 2% | 90% | 96% | 96% |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应: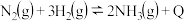
(1)写出该反应的逆反应的化学平衡常数表达式______ ,升高温度,该反应化学反应速率______ ,氢气的转化率______  以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变” 。实际生产中温度一般控制在
。实际生产中温度一般控制在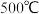 ,原因是
,原因是______ 。
(2)能表示该反应在恒温恒容密闭容器中 时刻后已经达到平衡状态的图示是
时刻后已经达到平衡状态的图示是______ 。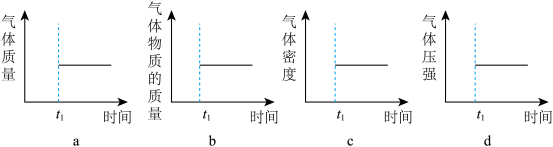
(3)浓度 的氨水,pH为
的氨水,pH为 当用蒸馏水稀释100倍时,则
当用蒸馏水稀释100倍时,则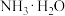 的电离平衡将向
的电离平衡将向______ 方向移动 填“正”或“逆”
填“正”或“逆” ,溶液的pH将为
,溶液的pH将为______  “大于”“小于”“等于”
“大于”“小于”“等于” 。
。
设计一个简单实验,证明一水合氨是弱碱:______ 。
某化学兴趣小组进行了下列关于氯化铵的课外实验:
【实验操作】
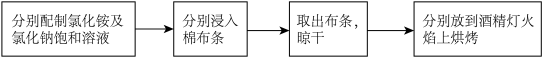
浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(4)氯化铵饱和溶液中离子浓度由大到小的顺序是______ 。白烟的成分是______ 。
(5)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因 写出一条即可
写出一条即可
______
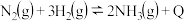
(1)写出该反应的逆反应的化学平衡常数表达式
 以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变” 。实际生产中温度一般控制在
。实际生产中温度一般控制在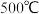 ,原因是
,原因是(2)能表示该反应在恒温恒容密闭容器中
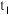 时刻后已经达到平衡状态的图示是
时刻后已经达到平衡状态的图示是
(3)浓度
 的氨水,pH为
的氨水,pH为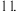 当用蒸馏水稀释100倍时,则
当用蒸馏水稀释100倍时,则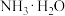 的电离平衡将向
的电离平衡将向 填“正”或“逆”
填“正”或“逆” ,溶液的pH将为
,溶液的pH将为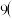 “大于”“小于”“等于”
“大于”“小于”“等于” 。
。设计一个简单实验,证明一水合氨是弱碱:
某化学兴趣小组进行了下列关于氯化铵的课外实验:
【实验操作】

浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(4)氯化铵饱和溶液中离子浓度由大到小的顺序是
(5)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因
 写出一条即可
写出一条即可
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】下表所列实验数据是在不同温度和压强下达到平衡状态时,混合物中 的含量(体积分数)的变化情况[投料比
的含量(体积分数)的变化情况[投料比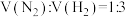
(1)比较200℃和300℃时的数据,可判断出升高温度,平衡向_____ (填“正反应”或“逆反应”)方向移动,合成氨的正反应为_________ (填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨的适宜条件是_________ (填序号)
A 高温、高压 B 高温、低压 C 低温、高压 D 低温、低压
(3)500℃、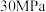 时,
时, 的转化率为
的转化率为__________ 。
(4)工业中实际生产氨时,考虑到浓度对化学平衡及反应速率的影响,常采取的措施有:__________ 。
 的含量(体积分数)的变化情况[投料比
的含量(体积分数)的变化情况[投料比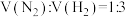
 | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
(2)根据平衡移动原理,合成氨的适宜条件是
A 高温、高压 B 高温、低压 C 低温、高压 D 低温、低压
(3)500℃、
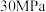 时,
时, 的转化率为
的转化率为(4)工业中实际生产氨时,考虑到浓度对化学平衡及反应速率的影响,常采取的措施有:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH3=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0kJ·mol-1
(1)煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=___________ 。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
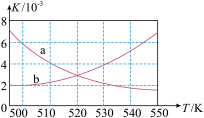
(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母),其判断理由是___________ 。
(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
①0~20min的平均反应速率v(CO)= ________ mol·L−1·min−1。
②达到平衡时,H2的转化率为________ 。
③在上述温度下,该反应的平衡常数K=________ 。(列出计算式即可)
④能表明该反应达到平衡状态的是________ (填序号)。
A.CO的转化率等于H2O的产率 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
(4)已知氢氟酸、醋酸、次氯酸(HClO)、碳酸的电离常数分别为:
写出少量的CO2通入NaClO溶液中的反应的离子方程式:___________ ;
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
H2(g)+
 O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH3=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0kJ·mol-1(1)煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。(2)如图所示能正确反映平衡常数K随温度变化关系的曲线为

(3)在一定温度下,向2.0L固定容积的密闭容器中充入2mol H2和1mol CO,经过一段时间后,反应4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
②达到平衡时,H2的转化率为
③在上述温度下,该反应的平衡常数K=
④能表明该反应达到平衡状态的是
A.CO的转化率等于H2O的产率 B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变 D.混合气体的密度不变
(4)已知氢氟酸、醋酸、次氯酸(HClO)、碳酸的电离常数分别为:
| HF | Ka=6.8×10-4mol•L-1 |
| CH3COOH | Ka=1.7×10-5mol•L-1 |
| HClO | Ka=2.9×10-8mol•L-1 |
| H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11mol•L-1 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某学习小组为探究 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。
【实验一】配制并测定醋酸中 的浓度。
的浓度。
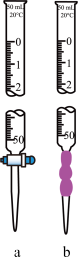
(1)配制250mL稀醋酸,用_______ (填标号)量取25mL于锥形瓶中,加入几滴_______ 溶液作指示剂。
(2)用 的NaOH溶液滴定,达到滴定终点时的现象为
的NaOH溶液滴定,达到滴定终点时的现象为_______ 。
(3)4次滴定消耗NaOH溶液的体积记录如下:
第4次滴定消耗NaOH溶液的体积为_______ mL,则所配稀醋酸的物质的量浓度约为_______ (保留4位有效数字): 。
。
【实验二】探究浓度对: 电离程度的影响。用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
电离程度的影响。用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
(4)由表中数据计算 的电离常数
的电离常数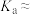
_______ 。
(5)从表中数据可以计算得出:随着 浓度的增大,
浓度的增大, 的电离程度将
的电离程度将_______ (填“增大”、“减小”或“不变”)。
 的电离情况,进行了如下实验。
的电离情况,进行了如下实验。【实验一】配制并测定醋酸中
 的浓度。
的浓度。
(1)配制250mL稀醋酸,用
(2)用
 的NaOH溶液滴定,达到滴定终点时的现象为
的NaOH溶液滴定,达到滴定终点时的现象为(3)4次滴定消耗NaOH溶液的体积记录如下:
| 实验次数 | 1 | 2 | 3 | 4 | |
| 滴定前 | 滴定终点 | ||||
| 消耗NaOH溶液的体积/mL | 25.07 | 25.02 | 26.88 | 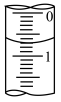 | 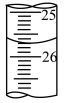 |
 。
。【实验二】探究浓度对:
 电离程度的影响。用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
电离程度的影响。用pH计测定25℃时不同浓度的醋酸的pH,结果如下:浓度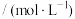 | 0.0010 | 0.0100 | 0.1000 |
| pH | 3.88 | 3.38 | 2.88 |
(4)由表中数据计算
 的电离常数
的电离常数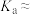
(5)从表中数据可以计算得出:随着
 浓度的增大,
浓度的增大, 的电离程度将
的电离程度将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
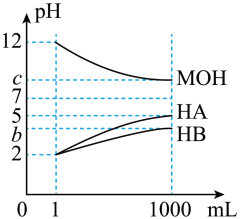
(1)HA为___________ 酸,HB为___________ 酸(填“强”或“弱”),若c=9,则MOH为___________ (填“强”或“弱”)碱;
(2)若c=9,则将pH=2的HB与pH=12的MOH等体积混合后,溶液呈___________ (填“酸”“碱”或“中”)性;
(3)若c=9,稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为___________ (用酸、碱化学式表示);
(4)常温下,取pH=2的HA、HB各100mL,向其中分别加入适量的Zn粒,反应后两溶液的pH均变为4,设HA中加入的Zn质量为m1,HB中加入的Zn质量为m2,则m1___________ m2(选填“<”、“=”或“>”)。

(1)HA为
(2)若c=9,则将pH=2的HB与pH=12的MOH等体积混合后,溶液呈
(3)若c=9,稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为
(4)常温下,取pH=2的HA、HB各100mL,向其中分别加入适量的Zn粒,反应后两溶液的pH均变为4,设HA中加入的Zn质量为m1,HB中加入的Zn质量为m2,则m1
您最近一年使用:0次



