研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3kJ·mol-1
则反应:2N2O5(g)=4NO2(g)+O2(g)的△H=______ kJ·mol-1。
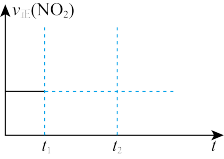
(2)对于反应2N2O5(g)⇌4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡。t1时充入N2O5(g),t2时又达到平衡,在下图中画出v正(NO2)随时间变化的趋势图____________ 。
有人提出如下反应历程:
第一步.N2O5(g)⇌NO2(g)+NO3(g) 快速平衡:
第二步NO2+NO3→NO+NO2+O2 慢反应;
第三步NO+NO3→2NO2 快反应。
其中可近似认为第二步反应不影响第一步的平衡,下列表述正确的是__________ 。
A.v(第一步的逆反应)<v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高
(3)NO2存在如下平衡:2NO2(g)⇌N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压x物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
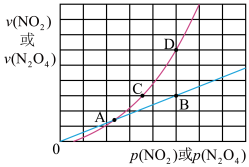
一定温度下, k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是K1=____ ;在图上标示的各点中,表示反应已达到平衡状态的点是________ ,理由是________ 。
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3kJ·mol-1
则反应:2N2O5(g)=4NO2(g)+O2(g)的△H=
(2)对于反应2N2O5(g)⇌4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡。t1时充入N2O5(g),t2时又达到平衡,在下图中画出v正(NO2)随时间变化的趋势图

有人提出如下反应历程:
第一步.N2O5(g)⇌NO2(g)+NO3(g) 快速平衡:
第二步NO2+NO3→NO+NO2+O2 慢反应;
第三步NO+NO3→2NO2 快反应。
其中可近似认为第二步反应不影响第一步的平衡,下列表述正确的是
A.v(第一步的逆反应)<v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高
(3)NO2存在如下平衡:2NO2(g)⇌N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压x物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下, k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是K1=
更新时间:2020-07-15 14:38:27
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲烷、甲醇、一氧化碳、二氧化碳等物质是“碳—化学”的重要成员,是工业合成的重要物质。回答下列问题:
(1)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。已知热化学方程式:
ⅰ.


ⅱ.

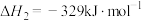
①反应ⅲ. 的
的
___________  ,该反应
,该反应___________ (填“能”或“不能”)自发进行。
②反应ⅲ的平衡常数
___________ (用 、
、 表示)。
表示)。
(2)向某密闭容器中充入一定量的 和
和 ,压强恒为100
,压强恒为100 ,发生反应:
,发生反应:
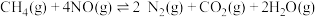
 。
。
①下列能表示该反应已经达到平衡状态的是___________ (填字母)。
A.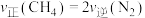
B.混合气体的平均相对分子质量保持不变
C.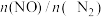 不再改变
不再改变
D.若为绝热容器,体系温度不再改变
上述条件下,向平衡体系中再充入一定量 ,再次平衡时
,再次平衡时 的转化率
的转化率___________ (填“增大”“减小”或“不变”)。
②初始投料时 ,
, 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示:

 K时,10min时反应达到平衡状态,
K时,10min时反应达到平衡状态, 的平衡分压为
的平衡分压为___________ ,0~10min内,用 表示的平均反应速率为
表示的平均反应速率为___________  。
。 K时该反应的平衡常数
K时该反应的平衡常数
___________ (列出式子即可, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(1)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。已知热化学方程式:
ⅰ.



ⅱ.


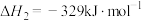
①反应ⅲ.
 的
的
 ,该反应
,该反应②反应ⅲ的平衡常数

 、
、 表示)。
表示)。(2)向某密闭容器中充入一定量的
 和
和 ,压强恒为100
,压强恒为100 ,发生反应:
,发生反应: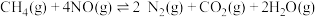
 。
。①下列能表示该反应已经达到平衡状态的是
A.

B.混合气体的平均相对分子质量保持不变
C.
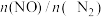 不再改变
不再改变D.若为绝热容器,体系温度不再改变
上述条件下,向平衡体系中再充入一定量
 ,再次平衡时
,再次平衡时 的转化率
的转化率②初始投料时
 ,
, 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示:
 K时,10min时反应达到平衡状态,
K时,10min时反应达到平衡状态, 的平衡分压为
的平衡分压为 表示的平均反应速率为
表示的平均反应速率为 。
。 K时该反应的平衡常数
K时该反应的平衡常数
 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】用甲烷制高纯氢气是目前研究热点之一。回答下列问题:
(1)一定条件下,CH4(g)⇌C(s)+2H2(g)的反应历程如图1所示,其中化学反应速率最慢的反应过程为_______ 。

(2)工业上常利用甲烷与水蒸气重整制氢,涉及热化学反应方程式如下:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H1=+206kJ/mol
Ⅱ.CO(g)+H2O(g)⇌CO2 (g)+H2(g) △H1=-41kJ/mol
①总反应:CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) △H=_______ kJ/mol。
②为提高CH4的平衡转化率,可采取的措施有_______ (写一条)。
③已知830℃时,反应Ⅱ的平衡常数K=1。在容积不变的密闭容器中,将2molCO(g)与8molH2O(g)加热到830℃,反应达平衡时CO的转化率为_______ 。
④在常压、600℃条件下,甲烷与水蒸气制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后H2的产率可提高到95%。应用化学平衡移动原理解释原因_______ 。
(3)利用甲烷与CO2重整制氢的热化学反应方程式如下:
Ⅲ.CH4(g)+CO2(g)⇌2CO(g)+2H2(g) △H3>0(主反应)
Ⅳ.H2(g)+CO2(g)⇌H2O(g)+CO(g) △H4>0(副反应)
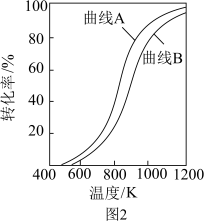
①在恒压条件下。等物质的量的CH4(g)和CO2(g)发生重整反应时,各物质的平衡转化率随温度变化如图2所示,则表示CO2平衡转化率的是曲线_______ (填“A”或“B”)。
②在一刚性密闭容器中,CH4(g)和CO2(g)的分压分别为20kPa、25kPa,忽略副反应,达到平衡后测得体系压强是起始时的1.8倍,则该反应的Kp=_______ kPa2(列出计算式即可)。
(4)科学家研究将CH4(g)、H2O(g)与CH4(g)、CO2(g)联合重整制备氢气,发生反应Ⅰ和Ⅲ.常压下,将CH4(g)、H2O(g)和CO2(g)按一定比例混合置于密闭容器中,相同时间不同温度下测得体系中 变化如图3所示。
变化如图3所示。
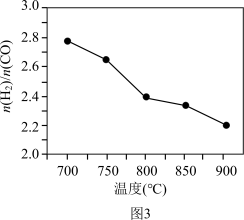
①已知700℃、NiO催化条件下,向反应体系中加入少量O2可增加H2产率,此条件下还原性CO_______ H2(填“>”、“<”或“=”)。
②随着温度升高 变小的原因可能是
变小的原因可能是_______ 。
(1)一定条件下,CH4(g)⇌C(s)+2H2(g)的反应历程如图1所示,其中化学反应速率最慢的反应过程为

(2)工业上常利用甲烷与水蒸气重整制氢,涉及热化学反应方程式如下:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H1=+206kJ/mol
Ⅱ.CO(g)+H2O(g)⇌CO2 (g)+H2(g) △H1=-41kJ/mol
①总反应:CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) △H=
②为提高CH4的平衡转化率,可采取的措施有
③已知830℃时,反应Ⅱ的平衡常数K=1。在容积不变的密闭容器中,将2molCO(g)与8molH2O(g)加热到830℃,反应达平衡时CO的转化率为
④在常压、600℃条件下,甲烷与水蒸气制备氢气的总反应中H2平衡产率为82%。若加入适量生石灰后H2的产率可提高到95%。应用化学平衡移动原理解释原因
(3)利用甲烷与CO2重整制氢的热化学反应方程式如下:
Ⅲ.CH4(g)+CO2(g)⇌2CO(g)+2H2(g) △H3>0(主反应)
Ⅳ.H2(g)+CO2(g)⇌H2O(g)+CO(g) △H4>0(副反应)
①在恒压条件下。等物质的量的CH4(g)和CO2(g)发生重整反应时,各物质的平衡转化率随温度变化如图2所示,则表示CO2平衡转化率的是曲线

②在一刚性密闭容器中,CH4(g)和CO2(g)的分压分别为20kPa、25kPa,忽略副反应,达到平衡后测得体系压强是起始时的1.8倍,则该反应的Kp=
(4)科学家研究将CH4(g)、H2O(g)与CH4(g)、CO2(g)联合重整制备氢气,发生反应Ⅰ和Ⅲ.常压下,将CH4(g)、H2O(g)和CO2(g)按一定比例混合置于密闭容器中,相同时间不同温度下测得体系中
 变化如图3所示。
变化如图3所示。
①已知700℃、NiO催化条件下,向反应体系中加入少量O2可增加H2产率,此条件下还原性CO
②随着温度升高
 变小的原因可能是
变小的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】碳中和是目前全球关注的热点。将 捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用
捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用 的方式。
的方式。
Ⅰ.实验室模拟由 与
与 合成甲醇。
合成甲醇。
(1)已知:
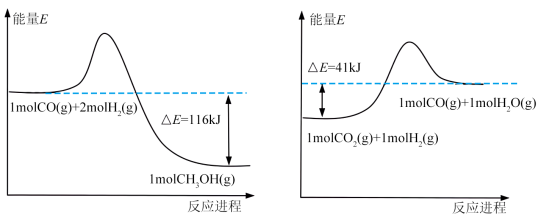
由上图反应,可知 的
的
_______  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
反应1: (主反应);
(主反应);
反应2:
①下列说法正确的是_______ 。(填字母代号)。
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内, 的平均反应速率为
的平均反应速率为_______  ;
;
③该温度下, 平衡常数K为
平衡常数K为_______ 。
Ⅱ.中国科学家通过电还原法将 转化为乙醇,其原理图如下所示。
转化为乙醇,其原理图如下所示。
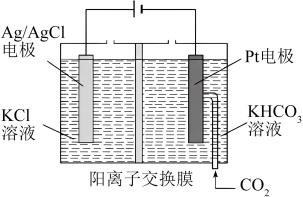
(3)则铂电极上的反应式为_______ 。
Ⅲ. 与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
(4)该反应化学方程式为_______ ,反应中常加入吸水剂,其目的是_______ 。
(5)图表示的是甲醇(Me表示 )与
)与 催化制备碳酸二甲酯的机理,按(i)(ii)(iii)步骤循环反应。图中
催化制备碳酸二甲酯的机理,按(i)(ii)(iii)步骤循环反应。图中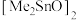 分子中只有一种类型的Me,该分子结构式为
分子中只有一种类型的Me,该分子结构式为_______ ( 用Me表示)
用Me表示)
 捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用
捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用 的方式。
的方式。Ⅰ.实验室模拟由
 与
与 合成甲醇。
合成甲醇。(1)已知:

由上图反应,可知
 的
的
 。
。(2)实验室在1L密闭容器中进行模拟合成实验。将
 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:反应1:
 (主反应);
(主反应);反应2:

| 物质\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
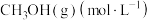 | 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 |
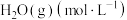 | 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内,
 的平均反应速率为
的平均反应速率为 ;
;③该温度下,
 平衡常数K为
平衡常数K为Ⅱ.中国科学家通过电还原法将
 转化为乙醇,其原理图如下所示。
转化为乙醇,其原理图如下所示。
(3)则铂电极上的反应式为
Ⅲ.
 与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。(4)该反应化学方程式为
(5)图表示的是甲醇(Me表示
 )与
)与 催化制备碳酸二甲酯的机理,按(i)(ii)(iii)步骤循环反应。图中
催化制备碳酸二甲酯的机理,按(i)(ii)(iii)步骤循环反应。图中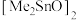 分子中只有一种类型的Me,该分子结构式为
分子中只有一种类型的Me,该分子结构式为 用Me表示)
用Me表示)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下面各题。
Ⅰ.2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
已知:CO2(g)+H2(g) ⇌H2O(g)+CO(g) △H1=+41.1kJ•mol-1;
CO(g)+2H2(g) ⇌CH3OH(g) △H2=-90.0kJ•mol-1
则CO2催化氢化合成甲醇的热化学方程式:______ 。
Ⅱ.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g)
如表所列数据是反应在不同温度下的化学平衡常数(K):
(1)该反应的化学平衡常数表达式为K=___ 。
(2)由表中数据判断该反应的△H__ 0(填“>”、“=”或“<”);
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为_______ ℃。
(4)判断反应达到平衡状态的依据是______ (填字母序号).
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)要提高CO的转化率,可以采取的措施是_______ (填字母序号).
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
Ⅰ.2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
已知:CO2(g)+H2(g) ⇌H2O(g)+CO(g) △H1=+41.1kJ•mol-1;
CO(g)+2H2(g) ⇌CH3OH(g) △H2=-90.0kJ•mol-1
则CO2催化氢化合成甲醇的热化学方程式:
Ⅱ.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g)
如表所列数据是反应在不同温度下的化学平衡常数(K):
| 温度℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(1)该反应的化学平衡常数表达式为K=
(2)由表中数据判断该反应的△H
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为
(4)判断反应达到平衡状态的依据是
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)要提高CO的转化率,可以采取的措施是
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
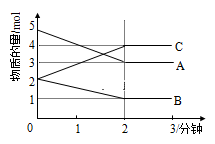
(1)该反应的的化学方程式为___________ 。
(2)反应开始至2分钟时,B的平均反应速率为___________ mol/(L·min)
(3)能说明该反应已达到平衡状态的是___________
a.v(A)= 2v(B)
b.容器内各物质的物质的量相等
c.v逆(A)=v正(C)
d.容器内气体的颜色保持不变
(4)由图求得平衡时A的体积分数___________

(1)该反应的的化学方程式为
(2)反应开始至2分钟时,B的平均反应速率为
(3)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B)
b.容器内各物质的物质的量相等
c.v逆(A)=v正(C)
d.容器内气体的颜色保持不变
(4)由图求得平衡时A的体积分数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
i.C3H8(g)=C3H6(g)+H2(g) △H1=+124kJ∙mol-1 △S1=127J∙ K-1∙mol-1 Kp1
ii.C3H8(g)=C2H4(g)+CH4(g) △H2=+82kJ∙mol-1 △S2=135J∙ K-1∙mol-1 Kp2
iii.C3H8(g)+2H2(g)=3CH4(g) △H3=-120kJ∙mol-1 △S3=27.5J∙ K-1∙mol-1 Kp3
已知:Kp为用气体分压表示的平衡常数,分压=物质的量分数×总压。在0.1Mpa、t℃下,丙烷单独进料时,平衡体系中各组分的体积分数φ见下表。
(1)在该温度下,Kp2远大于Kp1,但φ(C3H6)和φ(C2H4)相差不大,说明反应iii的正向进行有利于反应i的__________ 反应和反应ⅱ的___________ 反应(填“正向”或“逆向”)。
(2)从初始投料到达到平衡,反应i、ii、iii的丙烷消耗的平均速率从大到小的顺序为:__________ 。
(3)平衡体系中检测不到H2,可认为存在反应:3C3H8(g)=2C2H6(g)+3CH4(g) Kp,下列相关说法正确的是_____________ (填标号)。
a.Kp=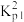 ∙Kp3
∙Kp3
b.Kp=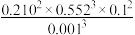 (MPa)2
(MPa)2
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
(4)由表中数据推算:丙烯选择性=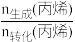 ×100%=
×100%=_______ (列出计算式)。
i.C3H8(g)=C3H6(g)+H2(g) △H1=+124kJ∙mol-1 △S1=127J∙ K-1∙mol-1 Kp1
ii.C3H8(g)=C2H4(g)+CH4(g) △H2=+82kJ∙mol-1 △S2=135J∙ K-1∙mol-1 Kp2
iii.C3H8(g)+2H2(g)=3CH4(g) △H3=-120kJ∙mol-1 △S3=27.5J∙ K-1∙mol-1 Kp3
已知:Kp为用气体分压表示的平衡常数,分压=物质的量分数×总压。在0.1Mpa、t℃下,丙烷单独进料时,平衡体系中各组分的体积分数φ见下表。
| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(2)从初始投料到达到平衡,反应i、ii、iii的丙烷消耗的平均速率从大到小的顺序为:
(3)平衡体系中检测不到H2,可认为存在反应:3C3H8(g)=2C2H6(g)+3CH4(g) Kp,下列相关说法正确的是
a.Kp=
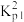 ∙Kp3
∙Kp3 b.Kp=
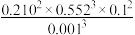 (MPa)2
(MPa)2c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
(4)由表中数据推算:丙烯选择性=
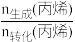 ×100%=
×100%=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】天然气中含有的 会腐蚀管道设备,开采天然气后须及时除去
会腐蚀管道设备,开采天然气后须及时除去 。在此过程中会产生大量含硫废水(其中硫元素的主要化合价是
。在此过程中会产生大量含硫废水(其中硫元素的主要化合价是 价),对设备、环境等造成严重危害。
价),对设备、环境等造成严重危害。
已知:
ⅰ. 有剧毒;常温下溶解度为
有剧毒;常温下溶解度为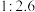 (体积)。
(体积)。
ⅱ.碳酸的电离平衡常数: ,
,
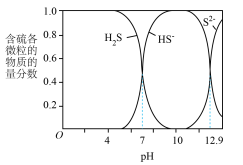
ⅲ. 、
、 、
、 在水溶液中的物质的量分数随pH的分布曲线如下图。
在水溶液中的物质的量分数随pH的分布曲线如下图。
(1)用过量的 溶液吸收天然气中的
溶液吸收天然气中的 的离子方程式是
的离子方程式是__________ ,该反应对应的化学平衡常数
__________ 。
(2)①当 时,含硫废水中
时,含硫废水中 、
、 的浓度比是
的浓度比是__________ 。
②结合数据说明 溶液呈碱性的原因是
溶液呈碱性的原因是__________ 。
(3)氧化还原法处理含硫废水。向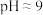 的含硫废水中加入一定浓度的
的含硫废水中加入一定浓度的 溶液,加酸将溶液调为
溶液,加酸将溶液调为 ,产生淡黄色沉淀。
,产生淡黄色沉淀。
①写出反应的离子方程式__________ 。
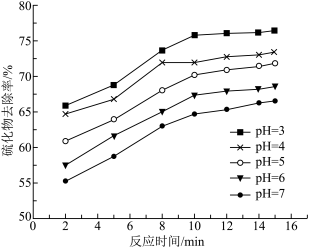
②不同pH时,硫化物去除率随时间的变化曲线如图所示。本工艺选择控制体系的 ,不选择
,不选择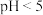 ,从环境保护的角度分析其主要原因
,从环境保护的角度分析其主要原因__________ 。
(4)工业上采用高温热分解 的方法制取
的方法制取 ,在膜反应器中分离出
,在膜反应器中分离出 。
。 下,
下, 分解:
分解: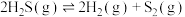 。保持压强不变,反应达到平衡时,气体的体积分数
。保持压强不变,反应达到平衡时,气体的体积分数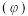 随温度的变化曲线如图。计算图中Q点
随温度的变化曲线如图。计算图中Q点 的平衡转化率为
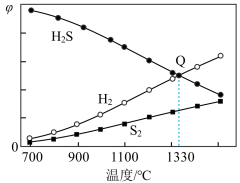
的平衡转化率为__________ ;1330℃时,反应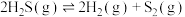 的
的
__________ kPa(kPa为以分压表示的平衡常数,分压=总压×物质的量分数)。
 会腐蚀管道设备,开采天然气后须及时除去
会腐蚀管道设备,开采天然气后须及时除去 。在此过程中会产生大量含硫废水(其中硫元素的主要化合价是
。在此过程中会产生大量含硫废水(其中硫元素的主要化合价是 价),对设备、环境等造成严重危害。
价),对设备、环境等造成严重危害。已知:
ⅰ.
 有剧毒;常温下溶解度为
有剧毒;常温下溶解度为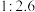 (体积)。
(体积)。ⅱ.碳酸的电离平衡常数:
 ,
,
ⅲ.
 、
、 、
、 在水溶液中的物质的量分数随pH的分布曲线如下图。
在水溶液中的物质的量分数随pH的分布曲线如下图。
(1)用过量的
 溶液吸收天然气中的
溶液吸收天然气中的 的离子方程式是
的离子方程式是
(2)①当
 时,含硫废水中
时,含硫废水中 、
、 的浓度比是
的浓度比是②结合数据说明
 溶液呈碱性的原因是
溶液呈碱性的原因是(3)氧化还原法处理含硫废水。向
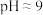 的含硫废水中加入一定浓度的
的含硫废水中加入一定浓度的 溶液,加酸将溶液调为
溶液,加酸将溶液调为 ,产生淡黄色沉淀。
,产生淡黄色沉淀。①写出反应的离子方程式
②不同pH时,硫化物去除率随时间的变化曲线如图所示。本工艺选择控制体系的
 ,不选择
,不选择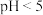 ,从环境保护的角度分析其主要原因
,从环境保护的角度分析其主要原因
(4)工业上采用高温热分解
 的方法制取
的方法制取 ,在膜反应器中分离出
,在膜反应器中分离出 。
。 下,
下, 分解:
分解: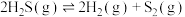 。保持压强不变,反应达到平衡时,气体的体积分数
。保持压强不变,反应达到平衡时,气体的体积分数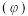 随温度的变化曲线如图。计算图中Q点
随温度的变化曲线如图。计算图中Q点 的平衡转化率为
的平衡转化率为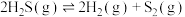 的
的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如下:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol,工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应;
ii.甲醇脱水反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),ΔH=-24.0kJ·mol-1
(1)请补全甲醇合成反应的热化学方程式:___________
(2)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________ 。
(3)在甲、乙两个相同的恒容容器中进行甲醇脱水反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),甲恒温,乙绝热,则CH3OH的转化率甲___________ 乙(填“>”“<”或“=”)
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH=+48.8kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得二甲醚的选择性分别如图1、图2所示。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
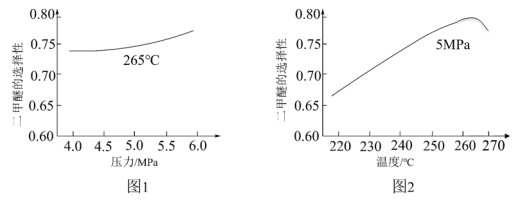
①图1中,温度一定,压强增大,二甲醚选择性增大的原因是___________ 。
②图2中,温度高于265℃后,二甲醚选择性降低的原因是___________ 。
i.甲醇合成反应;
ii.甲醇脱水反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),ΔH=-24.0kJ·mol-1
(1)请补全甲醇合成反应的热化学方程式:
(2)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为
(3)在甲、乙两个相同的恒容容器中进行甲醇脱水反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),甲恒温,乙绝热,则CH3OH的转化率甲
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH=+48.8kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得二甲醚的选择性分别如图1、图2所示。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。

①图1中,温度一定,压强增大,二甲醚选择性增大的原因是
②图2中,温度高于265℃后,二甲醚选择性降低的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】肌红蛋白  和血红蛋白(
和血红蛋白( 分别存在于哺乳动物肌细胞和血液中,通过储存和分配O2维持人体生理活动,其原理如下:
分别存在于哺乳动物肌细胞和血液中,通过储存和分配O2维持人体生理活动,其原理如下:
反应Ⅰ Mb(aq)+O2(g)⇌MbO2 (aq) △H₁
反应Ⅱ. Hb(aq)+O2(g)⇌HbO2(aq) △H₂
(1)设反应I平衡时 Mb与O2的结合率(即Mb的转化率)为α(Mb),氧气的分压为P(O2),在T=37 ℃下的( α(Mb) ~P(O2)、在P(O2)=1 kPa 下的α(Mb)~T如图所示
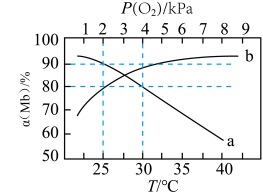
①下列说法正确的是_______ 。
A.△H₁>0
B.曲线b为等温线
C.其他条件不变,高烧患者体内的c(MbO2)会比其健康时高
D.其他条件不变,从低海拔地区进入高海拔地区人体内α(Mb)会降低,易有眩晕感
②设反应mA(aq) +nB(g)⇌xC(g)+yD(aq)的标准平衡常数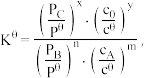 其中
其中  则37℃时反应Ⅰ的标准平衡常数为
则37℃时反应Ⅰ的标准平衡常数为_________________________ 。
(2)将1 L一定浓度的血红蛋白Hb 溶液(比热容约为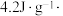 ℃-1、密度近似为
℃-1、密度近似为 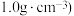 放入绝热量热计中并充入氧气,当有320 g Hb 被氧化时,测得体系温度升高
放入绝热量热计中并充入氧气,当有320 g Hb 被氧化时,测得体系温度升高 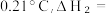
_______________ 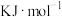
(3)已知血红蛋白中含有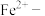 卟啉环配合物,其结合 O2后的基本结构如图所示,O2和血红蛋白之间的作用力为
卟啉环配合物,其结合 O2后的基本结构如图所示,O2和血红蛋白之间的作用力为_______________________________ 。

(4)若人体误食亚硝酸盐,会导致血红蛋白中的Fe2+转化为Fe3+失去载氧能力而中毒,可服用抗坏血酸( )解毒,抗坏血酸的作用是
)解毒,抗坏血酸的作用是____________________ 。
(5)CO会与血红蛋白结合形成HbCO 导致人体中毒:Hb(aq)+CO(g)⇌HbCO(aq)
①HbCO 和 HbO2具有相似的结构,但稳定性更强,可能的原因为_____________________________________________ 。
②从化学平衡角度简述CO的中毒原理:______________________________________________________________ 。
③已知反应 HbO2(aq)+CO(g)⇌HbCO(aq)+O2(g) K=220。 实验表明,人体内HbCO与 HbO2的浓度之比为1:50已足以使人智力受损,则抽烟时吸入肺部的空气中CO 与O2的体积比大于______________________ 即达到智力受损的程度。
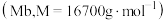 和血红蛋白(
和血红蛋白( 分别存在于哺乳动物肌细胞和血液中,通过储存和分配O2维持人体生理活动,其原理如下:
分别存在于哺乳动物肌细胞和血液中,通过储存和分配O2维持人体生理活动,其原理如下:反应Ⅰ Mb(aq)+O2(g)⇌MbO2 (aq) △H₁
反应Ⅱ. Hb(aq)+O2(g)⇌HbO2(aq) △H₂
(1)设反应I平衡时 Mb与O2的结合率(即Mb的转化率)为α(Mb),氧气的分压为P(O2),在T=37 ℃下的( α(Mb) ~P(O2)、在P(O2)=1 kPa 下的α(Mb)~T如图所示

①下列说法正确的是
A.△H₁>0
B.曲线b为等温线
C.其他条件不变,高烧患者体内的c(MbO2)会比其健康时高
D.其他条件不变,从低海拔地区进入高海拔地区人体内α(Mb)会降低,易有眩晕感
②设反应mA(aq) +nB(g)⇌xC(g)+yD(aq)的标准平衡常数
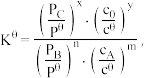 其中
其中  则37℃时反应Ⅰ的标准平衡常数为
则37℃时反应Ⅰ的标准平衡常数为(2)将1 L一定浓度的血红蛋白Hb 溶液(比热容约为
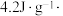 ℃-1、密度近似为
℃-1、密度近似为 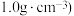 放入绝热量热计中并充入氧气,当有320 g Hb 被氧化时,测得体系温度升高
放入绝热量热计中并充入氧气,当有320 g Hb 被氧化时,测得体系温度升高 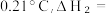
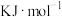
(3)已知血红蛋白中含有
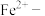 卟啉环配合物,其结合 O2后的基本结构如图所示,O2和血红蛋白之间的作用力为
卟啉环配合物,其结合 O2后的基本结构如图所示,O2和血红蛋白之间的作用力为
(4)若人体误食亚硝酸盐,会导致血红蛋白中的Fe2+转化为Fe3+失去载氧能力而中毒,可服用抗坏血酸(
 )解毒,抗坏血酸的作用是
)解毒,抗坏血酸的作用是(5)CO会与血红蛋白结合形成HbCO 导致人体中毒:Hb(aq)+CO(g)⇌HbCO(aq)
①HbCO 和 HbO2具有相似的结构,但稳定性更强,可能的原因为
②从化学平衡角度简述CO的中毒原理:
③已知反应 HbO2(aq)+CO(g)⇌HbCO(aq)+O2(g) K=220。 实验表明,人体内HbCO与 HbO2的浓度之比为1:50已足以使人智力受损,则抽烟时吸入肺部的空气中CO 与O2的体积比大于
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】I.氢气是一种清洁能源,水煤气变换反应的制氢原理为: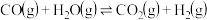
 ,回答下列问题:
,回答下列问题:
(1)水煤气变换部分基元反应如下:
第②步基元反应逆反应的活化能为___________ eV。
(2)某研究所探究CuO/ 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:___________ 。
②C/Z-120曲线先上升后下降的原因___________ 。
II.长征运载火箭推进剂为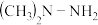 和
和 。
。
(3)在t℃、pMPa下,将 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①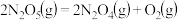 ,②
,②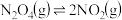 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
___________ MPa。
(4)T℃时,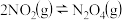 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: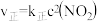 ,
,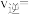
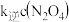 (
( 、
、 这是速率常数)。
这是速率常数)。
①图中表示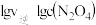 的线是
的线是___________ (填“m”或“n”) 气体,平衡后测得
气体,平衡后测得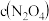 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=________ (用含a的表达式表示)。
③T℃时,向2L的容器中充入5mol 气体和1mol
气体和1mol 气体,此时
气体,此时
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
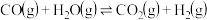
 ,回答下列问题:
,回答下列问题:(1)水煤气变换部分基元反应如下:
| 基元反应 | 活化能Ea(eV) | 反应热△H(eV) |
①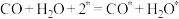 | 0 | -1.73 |
② | 0.81 | -0.41 |
(2)某研究所探究CuO/
 的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图: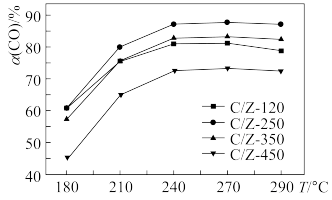
②C/Z-120曲线先上升后下降的原因
II.长征运载火箭推进剂为
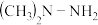 和
和 。
。(3)在t℃、pMPa下,将
 (g)和物质的量分数为m%的
(g)和物质的量分数为m%的 (g)通入反应器:①
(g)通入反应器:①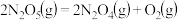 ,②
,②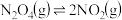 ,一段时间后
,一段时间后 完全反应,反应②达平衡,
完全反应,反应②达平衡, 与
与 的体积比为1:2,则反应②的平衡常数
的体积比为1:2,则反应②的平衡常数
(4)T℃时,
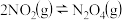 ,该反应正、逆反应速率与浓度的关系为:
,该反应正、逆反应速率与浓度的关系为: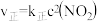 ,
,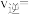
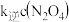 (
( 、
、 这是速率常数)。
这是速率常数)。①图中表示
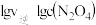 的线是
的线是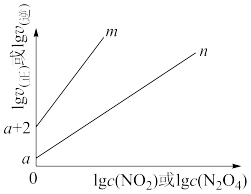
 气体,平衡后测得
气体,平衡后测得 为1.0
为1.0 ,则平衡时,
,则平衡时, =
=③T℃时,向2L的容器中充入5mol
 气体和1mol
气体和1mol 气体,此时
气体,此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的,是其合成原理为:N2+3H2 2NH3△H<0△S<0。
2NH3△H<0△S<0。
(1)下列关于工业合成氨的说法不正确的是___ 。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
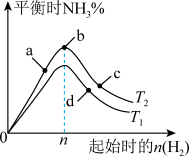
①图象中T2和T1的关系是:T2___ T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___ (填字母)。
(3)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
①此条件下该反应的化学平衡常数K=___ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___ 反应方向移动(填“正”或“逆”)。
③N2(g)+3NH3(g) 2NH3(g)△H=-92kJ/mol,在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol,在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为___ mol。
 2NH3△H<0△S<0。
2NH3△H<0△S<0。(1)下列关于工业合成氨的说法不正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(3)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
③N2(g)+3NH3(g)
 2NH3(g)△H=-92kJ/mol,在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol,在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】将氧化铁还原为铁的技术在人类文明进步中占据十分重要的地位。高炉炼铁中发生的部分反应为:
①
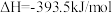
②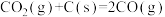
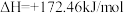
(1)已知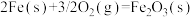
 。则高炉内
。则高炉内 被CO还原为Fe的热化学方程式为
被CO还原为Fe的热化学方程式为______ 。
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) ①
Cl2(aq) ①
Cl2(aq)+H2O HClO+H++Cl- ②
HClO+H++Cl- ②
HClO H++ClO- ③
H++ClO- ③

其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①写出上述体系中属于电离平衡的平衡常数表达式:Ki=__ ,由图可知该常数值为___ 。
②用氯处理饮用水时,夏季的杀菌效果比冬季__ (填“好”或“差”),请用勒夏特列原理解释:__ 。
(3)乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
填空:
①写出H2C2O4的电离方程式:_____ ;___________
②KHC2O4溶液显酸性的原因是______ ;
①

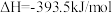
②
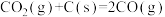
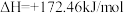
(1)已知
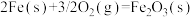
 。则高炉内
。则高炉内 被CO还原为Fe的热化学方程式为
被CO还原为Fe的热化学方程式为(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)
 Cl2(aq) ①
Cl2(aq) ①Cl2(aq)+H2O
 HClO+H++Cl- ②
HClO+H++Cl- ②HClO
 H++ClO- ③
H++ClO- ③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①写出上述体系中属于电离平衡的平衡常数表达式:Ki=
②用氯处理饮用水时,夏季的杀菌效果比冬季
(3)乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。常温下0.01 mol·L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
| 物质 | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.1 | 3.1 | 8.1 |
填空:
①写出H2C2O4的电离方程式:
②KHC2O4溶液显酸性的原因是
您最近一年使用:0次



