现有常温下的4种溶液:①0.01 mol·L-1CH3COOH溶液;②0.01 mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。
回答下列问题:
(1)4种溶液中水的电离程度最大的是________ (填序号)。
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是_______ 。
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是______ (填序号)。
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②_____ ③ (填“>”“<”或“=”)。
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比: =
=_____ 。
回答下列问题:
(1)4种溶液中水的电离程度最大的是
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比:
 =
=
19-20高二上·山东日照·期中 查看更多[4]
山东省日照市莒县2019-2020学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题山东省潍坊昌邑市第一中学2023-2024学年高二上学期10月月考化学试题
更新时间:2020-08-06 19:28:04
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】弱酸HA的电离常数Ka=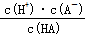 。25 ℃时,几种弱酸的电离常数如下:
。25 ℃时,几种弱酸的电离常数如下:
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是_______________ 。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)_____ v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸________ m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为__________________ 。
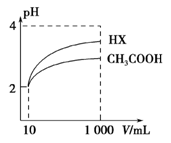
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)比醋酸溶液中水电离的c(H+)_________ ;电离常数Ka(HX)_____ Ka(CH3COOH)(填“>”、“=”或“<”),理由是______________ 。
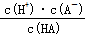 。25 ℃时,几种弱酸的电离常数如下:
。25 ℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
①物质的量浓度相同的四种酸,其pH由大到小的顺序是
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为

(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)比醋酸溶液中水电离的c(H+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)25℃时,0.1 mol/L的下列溶液:①HCl ②H2SO4 ③NH3·H2O ④NaOH。
①pH由大到小的顺序是_______ 。
②由水电离的H+浓度由大到小的顺序是_______ (填序号)
(2)25℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=_______ 。
(3)已知某温度下的纯水中,c(H+)=2×10-7 mol/L,此时c(OH-)=_______ 。该温度下,某Na2SO4溶液中( )=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=
)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=_______ 。
①pH由大到小的顺序是
②由水电离的H+浓度由大到小的顺序是
(2)25℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
(3)已知某温度下的纯水中,c(H+)=2×10-7 mol/L,此时c(OH-)=
 )=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=
)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】现有浓度均为0.1 mol/L的下列溶液:①硫酸②醋酸③氢氧化钠④氯化铵,请回答下列问题:
(1)①②③④四种溶液中促进水的电离的物质是____________ (填序号)。
(2)①②③④四种溶液中pH由大到小的顺序是____________ (填序号)。
(3)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是____________ 。
(4)25℃时,将pH=13的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=12,则a:b=____________ 。
(5)将a mol/L的氨水溶液与①等体积混合后,溶液呈中性,则氨水的电离平衡常数Kb=____________ 。
(1)①②③④四种溶液中促进水的电离的物质是
(2)①②③④四种溶液中pH由大到小的顺序是
(3)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是
(4)25℃时,将pH=13的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=12,则a:b=
(5)将a mol/L的氨水溶液与①等体积混合后,溶液呈中性,则氨水的电离平衡常数Kb=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)在一定条件下,可逆反应:aA(g)+bB(g) cC(g)+dD(g)达到平衡。
cC(g)+dD(g)达到平衡。
若其它条件不变,升高温度,则正反应速率________ (填“加快”或“减慢”,下同),逆反应速率________ ,重新达到平衡后c的质量增加,则正反应为_________ (填“放热”或“吸热”)反应。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ (填化学式)。
(3)pH = 3的醋酸和pH = 11的氢氧化钠溶液等体积混合后溶液呈________ (填“酸”、“中”、“碱”)性,溶液中c(Na+) ______ c(CH3COO-) (填“>”、“=”、“<”)。
 cC(g)+dD(g)达到平衡。
cC(g)+dD(g)达到平衡。若其它条件不变,升高温度,则正反应速率
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)pH = 3的醋酸和pH = 11的氢氧化钠溶液等体积混合后溶液呈
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】完成下列问题。
(1)氯化铝水解离子方程式___________ 。
(2) 在熔融状态下电离方程式
在熔融状态下电离方程式___________ 。
(3)已知2.0g燃料肼( )气体完全燃烧生成
)气体完全燃烧生成 和水蒸气时,放出33.4
和水蒸气时,放出33.4 的热量,则表示肼燃烧的热化学方程式为
的热量,则表示肼燃烧的热化学方程式为___________ 。
(4)室温下,将0.15 稀硫酸
稀硫酸
 与0.1
与0.1
 溶液
溶液
 混合,若忽略两溶液混合时的体积变化,所得溶液的
混合,若忽略两溶液混合时的体积变化,所得溶液的 为1,则
为1,则
___________ 。
(1)氯化铝水解离子方程式
(2)
 在熔融状态下电离方程式
在熔融状态下电离方程式(3)已知2.0g燃料肼(
 )气体完全燃烧生成
)气体完全燃烧生成 和水蒸气时,放出33.4
和水蒸气时,放出33.4 的热量,则表示肼燃烧的热化学方程式为
的热量,则表示肼燃烧的热化学方程式为(4)室温下,将0.15
 稀硫酸
稀硫酸
 与0.1
与0.1
 溶液
溶液
 混合,若忽略两溶液混合时的体积变化,所得溶液的
混合,若忽略两溶液混合时的体积变化,所得溶液的 为1,则
为1,则
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】运用相关原理,回答下列各小题:
(1)某H2SO4溶液的浓度是0.005 mol·L-1。
①此溶液的pH为_______ ;
②用水稀释到原来体积的100倍,pH为________ ;
③再继续稀释106倍,pH为________ 。
(2)室温下,某水溶液中存在的离子有Na+、A-、H+、 OH-。根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH____ 7( 填大小关系)。
②若溶液pH>7,则c(Na+)________ c(A-), 理由是________ 。
③若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法中正确的是____ (填选项代号)。
A.若反应后溶液呈中性,则c(H+)+c(OH- )=2×10-7 mol·L-1
B.若V1=V2反应后溶液的pH 一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(1)某H2SO4溶液的浓度是0.005 mol·L-1。
①此溶液的pH为
②用水稀释到原来体积的100倍,pH为
③再继续稀释106倍,pH为
(2)室温下,某水溶液中存在的离子有Na+、A-、H+、 OH-。根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH
②若溶液pH>7,则c(Na+)
③若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法中正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH- )=2×10-7 mol·L-1
B.若V1=V2反应后溶液的pH 一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】醋酸、氨水在科研和生产中均有着重要的应用。回答下列问题:
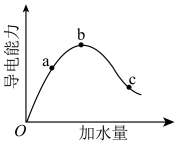
(1)在一定温度下,冰醋酸稀释过程中溶液的导电能力如图。
①醋酸在水中的电离方程式为___________ 。
②a、b、c三个点对应的溶液,其中 最大的是
最大的是___________ 点,醋酸电离程度最大的是___________ 点。
③若用湿润的pH试纸测量c处溶液的pH,测量结果___________ (填“偏大”“偏小”或“不变”);若用湿润的pH试纸测量a处溶液的pH,测量结果___________ (填“偏大”“偏小”或“不变”)。
(2)①氨水溶液显碱性的原因是___________ (用化学用语表示),向 的氨水中加水稀释,下列离子浓度或浓度关系增大的是
的氨水中加水稀释,下列离子浓度或浓度关系增大的是___________ 。
a. b.
b. c.
c. d.
d.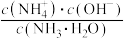
②常温下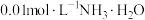 的电离度约为
的电离度约为___________ %,
___________ 。(保留1位小数)。(已知:电离度 ,
, ,
, )
)
(1)在一定温度下,冰醋酸稀释过程中溶液的导电能力如图。

①醋酸在水中的电离方程式为
②a、b、c三个点对应的溶液,其中
 最大的是
最大的是③若用湿润的pH试纸测量c处溶液的pH,测量结果
(2)①氨水溶液显碱性的原因是
 的氨水中加水稀释,下列离子浓度或浓度关系增大的是
的氨水中加水稀释,下列离子浓度或浓度关系增大的是a.
 b.
b. c.
c. d.
d.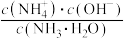
②常温下
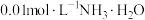 的电离度约为
的电离度约为
 ,
, ,
, )
)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按要求回答问题:
(1)写出醋酸的电离平衡常数表达式:______ 。
(2)取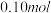
 (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示。比较a、b点的相关性质(填“>”“<”或“=”):
(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示。比较a、b点的相关性质(填“>”“<”或“=”):
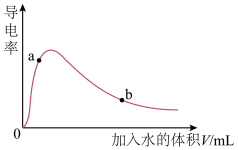
①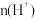 :a
:a______ b;
② :a
:a______ b;
(3) 浓度相同等体积的两份溶液A(盐酸)和B(
浓度相同等体积的两份溶液A(盐酸)和B( )分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______ (填写序号)
①反应所需要的时间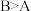 ②开始反应时的速率
②开始反应时的速率
③参加反应的锌的物质的量 ④A中有锌剩余
④A中有锌剩余
(4)某温度( )时,
)时, 的氢氧化钠溶液中,由水电离出的
的氢氧化钠溶液中,由水电离出的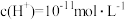 ,请回答下列问题:
,请回答下列问题:
①此温度下水的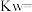
______ ;
②在相同温度下, 氢氧化钠溶液的
氢氧化钠溶液的 应为
应为______ 。
(1)写出醋酸的电离平衡常数表达式:
(2)取
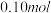
 (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示。比较a、b点的相关性质(填“>”“<”或“=”):
(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示。比较a、b点的相关性质(填“>”“<”或“=”):
①
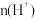 :a
:a②
 :a
:a(3)
 浓度相同等体积的两份溶液A(盐酸)和B(
浓度相同等体积的两份溶液A(盐酸)和B( )分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是①反应所需要的时间
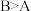 ②开始反应时的速率
②开始反应时的速率
③参加反应的锌的物质的量
 ④A中有锌剩余
④A中有锌剩余(4)某温度(
 )时,
)时, 的氢氧化钠溶液中,由水电离出的
的氢氧化钠溶液中,由水电离出的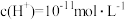 ,请回答下列问题:
,请回答下列问题:①此温度下水的
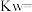
②在相同温度下,
 氢氧化钠溶液的
氢氧化钠溶液的 应为
应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有①CH3COOH溶液 ②HCl溶液。请用下列选项的序号填空:
A.①>② B.①<② C.①=②
(1)当它们的pH相同时,其物质的量浓度关系是_________ 。
(2)当它们的物质的量浓度相同时,其pH的关系是__________ 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需等物质的量浓度的两种酸溶液的体积关系为_______ 。
(4)体积和物质的量浓度相同的①、②两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为__________ 。
(5)当它们pH、体积均相同时,分别加入足量的锌,相同状况下产生气体体积关系为_________ 。
(6)将pH相同的两种酸均稀释10倍后,pH的关系为_________ 。
A.①>② B.①<② C.①=②
(1)当它们的pH相同时,其物质的量浓度关系是
(2)当它们的物质的量浓度相同时,其pH的关系是
(3)中和等体积、等物质的量浓度的烧碱溶液,需等物质的量浓度的两种酸溶液的体积关系为
(4)体积和物质的量浓度相同的①、②两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为
(5)当它们pH、体积均相同时,分别加入足量的锌,相同状况下产生气体体积关系为
(6)将pH相同的两种酸均稀释10倍后,pH的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知在常温下几种弱电解质的电离常数如下表:(已知pKi=-lgKi)
回答下列问题:
(1)在H3BO3(硼酸)、C6H5COOH(苯甲酸)、HN3(叠氮酸)三种物质中,酸性最弱的是___________ (填名称)。
(2)已知H3BO3在水中的电离方程式为H3BO3+H2O [B(OH)4]-+H+,则H3BO3是___________(填字母)。
[B(OH)4]-+H+,则H3BO3是___________(填字母)。
(3)(CH3)2NH·H2O在水中的电离类似一水合氨,写出(CH3)2NH·H2O的电离方程式:___________ 。
(4)NaN3溶液中离子浓度由大到小的顺序为___________ 。
(5)等物质的量浓度、等体积的C6H5COOH溶液和(CH3)2NH·H2O溶液反应,所得的混合溶液显___________ 性。
(6)常温下,C6H5COOK溶液的水解常数的数量级为___________ 。
| 化学式 | H3BO3 | C6H5COOH | HN3(叠氮酸) | (CH3)2NH·H2O |
| pKi | 9.14 | 4.19 | 4.7 | 3.7 |
回答下列问题:
(1)在H3BO3(硼酸)、C6H5COOH(苯甲酸)、HN3(叠氮酸)三种物质中,酸性最弱的是
(2)已知H3BO3在水中的电离方程式为H3BO3+H2O
 [B(OH)4]-+H+,则H3BO3是___________(填字母)。
[B(OH)4]-+H+,则H3BO3是___________(填字母)。| A.一元酸 | B.弱酸 | C.三元酸 | D.含氧酸 |
(4)NaN3溶液中离子浓度由大到小的顺序为
(5)等物质的量浓度、等体积的C6H5COOH溶液和(CH3)2NH·H2O溶液反应,所得的混合溶液显
(6)常温下,C6H5COOK溶液的水解常数的数量级为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.根据要求回答下列问题:
(1)氨水显碱性的原因(用电离方程式表示):____ 。
(2)盐碱地(含较多Na2CO3)产生碱性的原因(用第一步水解离子方程式表示):____ 。
II.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:pH由小到大排列的顺序是____ (用字母填写,例如“a<b<c<d”)。
a.NaHCO3 b.Na2CO3 c.NaClO d.CH3COONa
(4)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____ (填选项字母)。
(5)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_____ 。
(6)常温下,含等物质的量浓度的HClO与NaClO的混合溶液显____ (填“酸”“碱”或“中”)性;c(ClO-)_____ (填“>”“<”或“=”)c(HClO);该溶液中所含的4种离子浓度由大到小的顺序为____ 。
(1)氨水显碱性的原因(用电离方程式表示):
(2)盐碱地(含较多Na2CO3)产生碱性的原因(用第一步水解离子方程式表示):
II.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.NaHCO3 b.Na2CO3 c.NaClO d.CH3COONa
(4)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
| A.c(H+) | B. | C.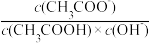 | D.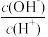 |
(6)常温下,含等物质的量浓度的HClO与NaClO的混合溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2−离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)E元素的离子结构示意图为________ 。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为______ 、_______ 。
(3)A、B、C、D、中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L−1的X溶液与0.1mol·L−1的Y溶液等体积混合后,溶液呈碱性。请判断:
① X的化学式为________ ,Y的化学式为________ ;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为_______________________ 。
(1)E元素的离子结构示意图为
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为
(3)A、B、C、D、中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L−1的X溶液与0.1mol·L−1的Y溶液等体积混合后,溶液呈碱性。请判断:
① X的化学式为
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
您最近一年使用:0次



