山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题
山东
高二
期中
2020-12-01
224次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、常见无机物及其应用、有机化学基础、认识化学科学
山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题
山东
高二
期中
2020-12-01
224次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、常见无机物及其应用、有机化学基础、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 下列说法正确的是
| A.泡沫灭火器和干粉灭火器的原理相同 |
| B.蒸干氯化铵溶液,得到氯化铵固体 |
| C.用惰性电极电解饱和的NaOH溶液,一段时间后溶液的导电能力几乎不变 |
| D.H2、I2(蒸汽)、HI的平衡混合气体加压后颜色加深可以用平衡移动原理解释 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
2. 下列有关中和热的说法正确的是
| A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B.在测定中和热时,使用稀醋酸代替稀盐酸,所测中和热数值偏大 |
| C.在测定中和热时,用铜质搅拌棒代替环形玻璃搅拌棒,对测定结果无影响 |
| D.在测定中和热时,分多次将NaOH溶液加入盐酸中,所测中和热数值偏小 |
【知识点】 中和热概念解读 中和热的测定与误差分析解读
您最近一年使用:0次
2020-08-06更新
|
248次组卷
|
5卷引用:山东省日照市莒县2019-2020学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
3. 下列事实不能证明醋酸是弱电解质的是
| A.0.1mol·L-1的醋酸溶液可使石蕊溶液变红 |
| B.常温下0.1mol·L-1的醋酸钠溶液的pH约为9 |
| C.在相同条件下,等浓度的醋酸的导电性比盐酸弱 |
| D.在醋酸钠的水溶液中存在醋酸分子 |
您最近一年使用:0次
2020-11-20更新
|
125次组卷
|
3卷引用:山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题
单选题
|
容易(0.94)
名校
解题方法
4. 改变下列条件,可以改变反应活化能的是
| A.压强 | B.温度 | C.反应物浓度 | D.催化剂 |
您最近一年使用:0次
2016-12-09更新
|
498次组卷
|
10卷引用:2014-2015海南省海南中学高二上学期期末化学理试卷
2014-2015海南省海南中学高二上学期期末化学理试卷2015-2016学年天津市五区县高二上学期期末考试化学试卷福建师大附中2017-2018学年高二上学期期末考试化学试题(实验班)福建师大附中2017-2018学年高二上学期期末考试化学(理)试题【全国百强校】海南省海南中学2017-2018学年高二(理)上学期期末考试化学试题(已下线)2.1.2 活化能(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题四川省甘孜州2021-2022学年高二下学期学业质量统一监测期末统考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题江苏省无锡市匡园双语学校2023-2024学年高二下学期第一次月考化学试卷
单选题
|
较易(0.85)
解题方法
5. 恒温恒容下,密闭容器中充入一定量的C,发生反应A(s)+2B(g) 2C(g),下列不能说明达到平衡状态的是
2C(g),下列不能说明达到平衡状态的是
 2C(g),下列不能说明达到平衡状态的是
2C(g),下列不能说明达到平衡状态的是| A.A与C的物质的量之比不变 |
| B.容器内密度不变 |
| C.容器内压强不变 |
| D.容器内气体分子的平均相对分子质量不变 |
【知识点】 化学平衡状态本质及特征解读 化学平衡状态的判断方法解读
您最近一年使用:0次
单选题
|
较易(0.85)
6. 下列实验操作或对实验事实的叙述正确的是
| A.用明矾对自来水进行净化和杀菌消毒 |
| B.用干燥的pH试纸测定NaClO溶液的pH |
| C.用Cu作阴极,Fe作阳极,可实现在Fe上镀Cu |
| D.用饱和氯化铵溶液作焊接金属时的除锈剂 |
您最近一年使用:0次
2020-11-20更新
|
106次组卷
|
2卷引用:山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
7. 用氯化镁溶液制取无水氯化镁,下列装置用不到的是
| A | B | C | D |
 |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
8. 准确移取20.00mL某待测NaOH溶液于锥形瓶中,用0.1000mol·L-1HCl溶液滴定。下述操作可导致被测定NaOH溶液浓度偏低的是
| A.未用标准液润洗滴定管 |
| B.达到滴定终点,读数时俯视液面 |
| C.盛装待测液的锥形瓶用蒸馏水洗过,未润洗 |
| D.滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失 |
您最近一年使用:0次
2020-11-20更新
|
257次组卷
|
5卷引用:山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
9. 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质 硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法正确的是
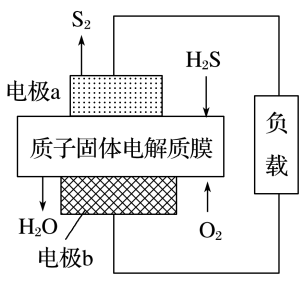

| A.电极a为电池的正极 |
| B.电极b上发生的电极反应为:O2+4H++4e-=2H2O |
| C.电路中每通过2 mol电子,在正极消耗22.4L H2S |
| D.每17g H2S参与反应,有2 mol H+经质子膜进入正极区 |
【知识点】 原电池电极反应式书写解读 燃料电池 原电池有关计算解读
您最近一年使用:0次
2020-08-06更新
|
146次组卷
|
2卷引用:山东省日照市莒县2019-2020学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
10. 某密闭容器中充入等物质的量的A和B,一定温度下发生反应mA(g)+nB(g) pC(g),达到平衡后,在不同的时间段,下列说法中正确的是
pC(g),达到平衡后,在不同的时间段,下列说法中正确的是

 pC(g),达到平衡后,在不同的时间段,下列说法中正确的是
pC(g),达到平衡后,在不同的时间段,下列说法中正确的是
| A.该化学方程式中的系数可能为1:2:3 |
| B.30~40 min间该反应使用了催化剂,40min时刻可能改变的压强条件 |
| C.该反应在此温度下的平衡常数为2 |
| D.前20minA的平均反应速率为3mol·L-1·h-1 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
11. 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
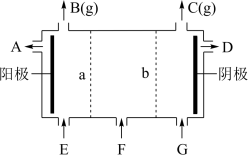

| A.b是阳离子交换膜,允许Na+通过 |
| B.从A口出来的是NaOH溶液 |
| C.阴极反应式为4OH--4e-= 2H2O+O2↑ |
| D.Na2SO4溶液从G口加入 |
您最近一年使用:0次
2019-12-12更新
|
661次组卷
|
21卷引用:2015届湖北省武汉华中师大一附中高三5月适应性考试化学试卷
2015届湖北省武汉华中师大一附中高三5月适应性考试化学试卷2016届河南省信阳高级中学高三上学期第八次大考化学试卷2016-2017学年福建省三明一中高二上第一次月考化学卷2017届山东省潍坊市临朐县高三12月阶段测化学试卷【全国百强校】华中师范大学第一附属中学2018届高三5月押题考试理综化学试题广东省深圳市科学高中2018-2019学年第一学期高二入学考试化学试题【校级联考】河南省商丘市九校2018-2019学年高二上学期期末联考化学试题湖南省张家界市民族中学2019-2020学年高二上学期第三次月考化学试题吉林省长春市实验中学2019-2020学年高二上学期期末考试化学试题(已下线)【新东方】 2020-11(已下线)考点05 化学反应中的能量变化-2020年【衔接教材·暑假作业】新高三一轮复习化学四川省成都石室中学2021届高三上学期开学考试化学试题山东省德州市夏津第一中学2021届高三上学期9月月考化学试题山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题山东省泰安市新泰第一中学(东校)2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw117黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题四川省内江市第六中学2021-2022年高三上学期第二次月考化学试题山东省枣庄一中分校2021-2022学年高二上学期期末考试化学试题(已下线)第六章 化学反应与能量 第39讲 多池、多室的电化学装置
单选题
|
适中(0.65)
12. 下列操作能达到实验目的的是
| 目的 | 操作 | |
| A | 证明FeCl3和KSCN溶液反应可逆 | 将同浓度的KSCN和FeCl3溶液等体积混合后再滴加少量KSCN液观察溶液颜色变化 |
| B | 证明酸性:碳酸>苯酚 | 将硝酸溶液与NaHCO3混合产生的气体直接通入苯酚钠溶液 |
| C | 证明Ksp(AgCl)>Ksp(AgBr) | 向含有相同Cl-和Br-浓度的溶液中滴加少量AgNO3溶液 |
| D | 证明H2O2具有强氧化性 | 向 H2O2溶液中滴加 H2O2溶液中滴加 KMnO4溶液,溶液褪色 KMnO4溶液,溶液褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
二、多选题 添加题型下试题
13. 相同温度下,容积相同的甲,乙两个恒容密闭容器均发生如下反应:N2+3H2 2NH3 ΔH=-92.4kJ/mol,实验测得有关数据如下;下列判断中正确的是
2NH3 ΔH=-92.4kJ/mol,实验测得有关数据如下;下列判断中正确的是
 2NH3 ΔH=-92.4kJ/mol,实验测得有关数据如下;下列判断中正确的是
2NH3 ΔH=-92.4kJ/mol,实验测得有关数据如下;下列判断中正确的是| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
| N2 | 3H2 | NH3 | ||
| 甲 | 1 | 3 | 0 | 放出热量:Q1 |
| 乙 | 0.9 | 2.7 | 0.2 | 放出热量:Q2 |
| A.Q2<Q1=92.4 | B.容器甲先达平衡 |
| C.两容器中反应的平衡常数相等 | D.达到平衡时NH3的体积分数:甲=乙 |
您最近一年使用:0次
多选题
|
适中(0.65)
解题方法
14. 某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和KCl中的几种,进行如下实验:
①X与水作用有气泡冒出,得到沉淀Y和碱性溶液Z;
②沉淀Y与足量NaOH溶液作用,沉淀部分溶解。
下列说法正确的是
①X与水作用有气泡冒出,得到沉淀Y和碱性溶液Z;
②沉淀Y与足量NaOH溶液作用,沉淀部分溶解。
下列说法正确的是
| A.混合物X中必定含有Al2(SO4)3、FeCl3、Na2CO3 |
| B.溶液Z中溶质一定只含有钠盐 |
| C.灼烧沉淀Y,可以得到氧化铝和氧化铁的混合物 |
| D.往溶液Z中先加入盐酸再加氯化钡溶液可以确定混合物X中是否含有KCl |
您最近一年使用:0次
15. 常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O 的水解)。下列叙述正确的是
的水解)。下列叙述正确的是

 的水解)。下列叙述正确的是
的水解)。下列叙述正确的是
| A.Ksp(Ag2C2O4)等于10-6 |
| B.n点表示Ag2C2O4的不饱和溶液 |
C.向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 |
D.Ag2C2O4+2Cl- 2AgCl+C2O 2AgCl+C2O 的平衡常数为108 的平衡常数为108 |
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
16. 现有常温下的4种溶液:①0.01 mol·L-1CH3COOH溶液;②0.01 mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。
回答下列问题:
(1)4种溶液中水的电离程度最大的是________ (填序号)。
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是_______ 。
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是______ (填序号)。
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②_____ ③ (填“>”“<”或“=”)。
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比: =
=_____ 。
回答下列问题:
(1)4种溶液中水的电离程度最大的是
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比:
 =
=
您最近一年使用:0次
2020-08-06更新
|
823次组卷
|
4卷引用:山东省日照市莒县2019-2020学年高二上学期期中考试化学试题
山东省日照市莒县2019-2020学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)山东省日照市五莲县2020-2021学年高二上学期期中考试化学试题山东省潍坊昌邑市第一中学2023-2024学年高二上学期10月月考化学试题
四、计算题 添加题型下试题
计算题
|
适中(0.65)
解题方法
17. 如图所示的三个容器中分别盛有不同的溶液,其中,c、d、g、h为石墨电极,e、f为铜电极。闭合K,发现g电极附近的溶液先变红。电解20min时,停止电解,此时d电极上产生56mL气体(标准状况)。据此回答:

(1)电源a极是___ 极。
(2)整个电解过程中,电路中通过的电子的物质的量是_____ 。
(3)乙装置中发生电解的总反应方程式为______ 。
(4)要使甲中溶液恢复到原来的状态,需要加入的物质及其物质的量是______ 。
(5)电解后恢复到室温,丙中溶液的pH为______ (不考虑溶液体积变化)。

(1)电源a极是
(2)整个电解过程中,电路中通过的电子的物质的量是
(3)乙装置中发生电解的总反应方程式为
(4)要使甲中溶液恢复到原来的状态,需要加入的物质及其物质的量是
(5)电解后恢复到室温,丙中溶液的pH为
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
18. 硫代硫酸钠晶体(Na2S2O3·5H2O)又名大苏打、海波,易溶于水,难溶于乙醇,在中性或碱性溶液中较稳定,广泛应用于日常生产生活中。向如图所示装置中通入SO2,在加热条件下反应可制得Na2S2O3·5H2O。回答下列问题:

(1)烧瓶中发生反应的离子方程式为_______ 。
(2)25℃时,当溶液pH接近7时,需立即停止通SO2,原因是_______ (用离子方程式表示) 。
(3)反应终止后,经加热浓缩,冷却结晶,过滤、洗涤、干燥等一系列操作可得Na2S2O3·5H2O晶体。其中洗涤剂可选用__ (填标号) 。
A.水 B.乙醇 C.稀盐酸 D.氢氧化钠溶液
(4)准确称取1.4 g产品,加入刚煮沸并冷却过的水20 mL使其完全溶解,以淀粉作指示剂,用0.1000 mol/L标准碘水溶液滴定。已知:2S2O +I2(aq)=S4O
+I2(aq)=S4O (无色)+2I-(aq)。
(无色)+2I-(aq)。
①标准碘水应盛放在_____ (填“酸式”或“碱式”)滴定管中,滴定前要排尽滴定管尖嘴处气泡应选用 ____ (填标号)。

②第一次滴定开始和结束时,滴定管中的液面如图所示,则第一次消耗碘水标准溶液的体积为______ mL。
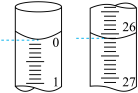
③重复上述操作三次,记录另两次数据如下表,则产品中Na2S2O3·5H2O的质量分数为______ % (保留1位小数) 。

(1)烧瓶中发生反应的离子方程式为
(2)25℃时,当溶液pH接近7时,需立即停止通SO2,原因是
(3)反应终止后,经加热浓缩,冷却结晶,过滤、洗涤、干燥等一系列操作可得Na2S2O3·5H2O晶体。其中洗涤剂可选用
A.水 B.乙醇 C.稀盐酸 D.氢氧化钠溶液
(4)准确称取1.4 g产品,加入刚煮沸并冷却过的水20 mL使其完全溶解,以淀粉作指示剂,用0.1000 mol/L标准碘水溶液滴定。已知:2S2O
 +I2(aq)=S4O
+I2(aq)=S4O (无色)+2I-(aq)。
(无色)+2I-(aq)。①标准碘水应盛放在

②第一次滴定开始和结束时,滴定管中的液面如图所示,则第一次消耗碘水标准溶液的体积为

③重复上述操作三次,记录另两次数据如下表,则产品中Na2S2O3·5H2O的质量分数为
| 滴定次数 | 滴定前刻度/mL | 滴定后刻度/mL |
| 第二次 | 1.56 | 30.30 |
| 第三次 | 0.22 | 26.32 |
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
解题方法
19. 天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。回答下列问题:
(1)乙烷在一定条件可发生反应:C2H6(g) C2H4(g)+H2(g) ΔH1
C2H4(g)+H2(g) ΔH1
已知:298K时,相关物质的相对能量如图。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。
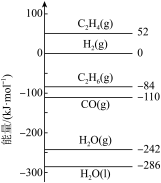
①ΔH1=____ kJ·mol−1。
②2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kx=_____ (用物质的量分数代替平衡浓度计算)。
(2)已知反应CaCO3(s)=CaO(s)+CO2(g) △H(298K)=+178.2kJ·mol-1,ΔS(298K)=+169.6J.mol-1·K-1则该反应能自发进行的最低温度为_____ K(假设反应的焓变与熵变不随温度变化而变化,结果保留整数)。
(3)恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g) CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3molCO,此时平衡将
CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3molCO,此时平衡将____ 移动(填“向右”、“向左”或“不”)。
(4)工业合成氨中制取氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4kJ·mol−1
CO(g)+3H2(g) ΔH=+206.4kJ·mol−1
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol−1
CO2(g)+H2(g) ΔH=-41.2kJ·mol−1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____ (填字母)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②下列措施可以提高CH4转化率的是_____ (填字母)。
a.适当升高温度
b.将H2从反应体系中分离出来
c.保持体积不变充入He,使体系总压强增大
d.按原比例再充入CH4(g)和H2O(g)
(1)乙烷在一定条件可发生反应:C2H6(g)
 C2H4(g)+H2(g) ΔH1
C2H4(g)+H2(g) ΔH1已知:298K时,相关物质的相对能量如图。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。

①ΔH1=
②2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kx=
(2)已知反应CaCO3(s)=CaO(s)+CO2(g) △H(298K)=+178.2kJ·mol-1,ΔS(298K)=+169.6J.mol-1·K-1则该反应能自发进行的最低温度为
(3)恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g)
 CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3molCO,此时平衡将
CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3molCO,此时平衡将(4)工业合成氨中制取氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4kJ·mol−1
CO(g)+3H2(g) ΔH=+206.4kJ·mol−1Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol−1
CO2(g)+H2(g) ΔH=-41.2kJ·mol−1①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②下列措施可以提高CH4转化率的是
a.适当升高温度
b.将H2从反应体系中分离出来
c.保持体积不变充入He,使体系总压强增大
d.按原比例再充入CH4(g)和H2O(g)
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、化学实验基础、常见无机物及其应用、有机化学基础、认识化学科学
试卷题型(共 19题)
题型
数量
单选题
12
多选题
3
填空题
1
计算题
1
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 勒夏特列原理的应用 盐类水解在解题方面的应用 盐类水解在生活、生产中的应用 电解原理的理解及判断 | |
| 2 | 0.65 | 中和热概念 中和热的测定与误差分析 | |
| 3 | 0.85 | 强电解质与弱电解质 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 | |
| 4 | 0.94 | 影响化学反应速率的因素 碰撞理论及活化能 活化能及其对反应速率的影响 催化剂对化学反应速率的影响 | |
| 5 | 0.85 | 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 6 | 0.85 | 测定溶液pH的方法 盐类水解在解题方面的应用 盐类水解在生活、生产中的应用 电镀 | |
| 7 | 0.65 | 盐类水解在解题方面的应用 制备与水解有关的物质 物质分离、提纯综合应用 | |
| 8 | 0.85 | 酸碱中和滴定实验基本操作及步骤 酸碱中和滴定的误差分析 | |
| 9 | 0.65 | 原电池电极反应式书写 燃料电池 原电池有关计算 | |
| 10 | 0.65 | 化学反应速率与化学计量数之间的关系 化学平衡图像分析 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 11 | 0.65 | 电解池电解基本判断 电解池电极反应式及化学方程式的书写与判断 电解原理的应用实验 | |
| 12 | 0.65 | 硝酸的物理性质 溶度积常数与溶解度的关系 苯酚的弱酸性 | |
| 二、多选题 | |||
| 13 | 0.65 | 反应热大小比较 等效平衡理论的综合应用 化学平衡常数的影响因素及应用 化学平衡题中基于图表数据的相关计算 | |
| 14 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 氢氧化铝与强碱反应 盐类双水解反应 常见阳离子的检验 | |
| 15 | 0.65 | 溶度积规则及其应用 溶度积常数相关计算 溶度积常数与溶解度的关系 | |
| 三、填空题 | |||
| 16 | 0.65 | 水溶液中水的电离程度及的计算 酸碱混合时的定性判断及计算 一元强酸与一元弱酸的比较 盐溶液中离子浓度大小的比较 | |
| 四、计算题 | |||
| 17 | 0.65 | 电解后溶液的复原 电解池电极反应式及化学方程式的书写与判断 电解池有关计算 利用电子守恒法进行多池串联相关计算 | |
| 五、解答题 | |||
| 18 | 0.65 | 常用仪器及使用 常见无机物的制备 中和滴定 探究物质组成或测量物质的含量 | 实验探究题 |
| 19 | 0.65 | 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 化学平衡常数的有关计算 转化率的相关计算及判断 复合判据 | 原理综合题 |



