(1)H2S中心原子的杂化类型为_________ 杂化 ,比较H2O 与H2S 分子的沸点, 其中沸点较高的是_____
(2)某种单质的晶体在不同温度下有两种堆积方式, 信息如下:
则方式 I与方式 I I中原子配位数之比为__________ ,晶体密度之比为________
(3)实验室配制 250 mL 1.0 mol•L-1 H2SO4溶液, 回答下列问题 。
① 所需的仪器除了需要玻璃棒、烧杯, 量筒之外 ,还需要________
② 通过计算,需要用量筒量取密度为 1.84 g/mL,质量分数为 98%的浓H2SO4的体积是_____ mL,若量取浓硫酸时仰视,则最后所配成的稀硫酸的浓度________ (填偏高、偏低或无影响)
(2)某种单质的晶体在不同温度下有两种堆积方式, 信息如下:
| 序号 | 堆积方式 | 晶胞棱长 ( cm) |
| I | 面心立方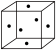 | a |
| II | 体心立方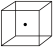 | b |
则方式 I与方式 I I中原子配位数之比为
(3)实验室配制 250 mL 1.0 mol•L-1 H2SO4溶液, 回答下列问题 。
① 所需的仪器除了需要玻璃棒、烧杯, 量筒之外 ,还需要
② 通过计算,需要用量筒量取密度为 1.84 g/mL,质量分数为 98%的浓H2SO4的体积是
更新时间:2020-08-18 10:04:17
|
相似题推荐
【推荐1】CuCl广泛应用于有机合成催化。例如 回答下列问题:
回答下列问题:
(1)CuCl中Cu+核外电子排布式为______________ ,Cu与Cl相比,第一电离能较大的是______________ 。
(2)已知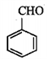 为平面分子,则-CHO中碳原子的杂化方式为
为平面分子,则-CHO中碳原子的杂化方式为______________ 。
(3)写出与CO互为等电子体的非极性分子的电子式______________ ,14gCO中含______________ molπ键。合成氨工业中用铜洗液吸收CO,形成配合物[Cu(NH3)3CO]Ac(HAc代表醋酸),其中______________ (填粒子符号)接受孤对电子形成配位键,配位数是______________ 。
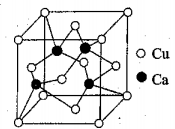
(4)铜钙可形成合金,单质铜的熔点比单质钙高,其原因是____________________________ ,其中一种合金的晶胞结构构如图所示,已知:该晶体的密度为ρg·cm-3,NA是阿伏伽德罗常数的值,则其中两个Ca原子核之间距离为______________ 。
 回答下列问题:
回答下列问题:(1)CuCl中Cu+核外电子排布式为
(2)已知
 为平面分子,则-CHO中碳原子的杂化方式为
为平面分子,则-CHO中碳原子的杂化方式为(3)写出与CO互为等电子体的非极性分子的电子式
(4)铜钙可形成合金,单质铜的熔点比单质钙高,其原因是

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
请回答:
(1)c属于_____________ 区的元素。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________ (用元素符号表示)。
(3)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________ ,A的空间构型为____________________ ;
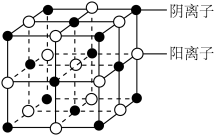
(4)d 的某氯化物晶体结构如图,每个阴离子周围等距离且最近的阴离子数为________ ;在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为_____________ 。
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
| d | 位于周期表中第1纵列 |
| e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于
(2)b与其同周期相邻元素第一电离能由大到小的顺序为
(3)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为
(4)d 的某氯化物晶体结构如图,每个阴离子周围等距离且最近的阴离子数为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第_______ 周期_______ 族,_______ 区。
(2)Zn形成金属晶体,其金属原子堆积属于下列_______ 模式。
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式_______ ;葡萄糖分子中碳原子的杂化方式有_______ 。
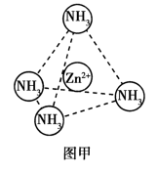
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体:NH3分子属于_______ (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在图甲中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键________ 。
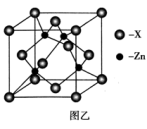
(5)图乙表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为_______ ;该化合物晶体的熔点比干冰高得多,原因是_______ 。
(1)指出锌在周期表中的位置:第
(2)Zn形成金属晶体,其金属原子堆积属于下列
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体:NH3分子属于

(5)图乙表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁为日常生活中常见的金属,有着广泛的用途。回答下列问题:

(1)基态铁原子的价电子轨道表示式为________________ 。
(2)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为___ 。
(3)已知配合物Fe(CO)x,在常温下呈液态,熔点为-20.5℃,沸点103℃,易溶于非极性溶剂。据此可判断晶体Fe(CO)x的晶体类型是_________________ 。
(4)Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。晶体Fe3O4的晶胞如图所示:

①晶胞中亚铁离子处于氧离子围成的_________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为_______ 。
③解释Fe3O4晶体能导电的原因:_________________________ 。
④若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_________ g/cm3。(阿伏伽德罗常数用NA表示)

(1)基态铁原子的价电子轨道表示式为
(2)Fe和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为
(3)已知配合物Fe(CO)x,在常温下呈液态,熔点为-20.5℃,沸点103℃,易溶于非极性溶剂。据此可判断晶体Fe(CO)x的晶体类型是
(4)Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。晶体Fe3O4的晶胞如图所示:

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因:
④若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氢、氮、氧、硫、镁、铁、铜、锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断 Mg 基态原子的核外电子排布为,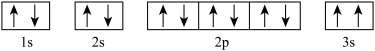 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了____
(2)Cu 位于____ 族____ 区,Cu+价电子排布式为____ 。
(3)MgCO3的分解温度____ BaCO3(填“>” 或、“<”)
(4)Ge、As、Se 元素的第一电离能由大到小的顺序为____
(5)已知 H3BO3是一元酸,1molH3BO3在水中完全电离得到的阴离子中含有σ键的数目为____
(6)下列有关说法不正确的是____ 。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与 CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4,原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
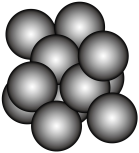
(7)晶体 Cu 的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________ ,设Cu原子半径为a,晶体的空间利用率为______ 。(用含π,a、的式子表示,不必化简)
(1)某同学根据已学知识,推断 Mg 基态原子的核外电子排布为,
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(2)Cu 位于
(3)MgCO3的分解温度
(4)Ge、As、Se 元素的第一电离能由大到小的顺序为
(5)已知 H3BO3是一元酸,1molH3BO3在水中完全电离得到的阴离子中含有σ键的数目为
(6)下列有关说法不正确的是
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与 CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4,原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体 Cu 的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜是人类广泛使用的一种金属,钼是一种难熔的稀有金属。两种物质在生产生活中都有着重要的应用。回答下列问题:
(1)基态Cu原子价层电子排布式为___________ ,在周期表中,Cu元素属于___________ 区,Cu能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-CN),其原因为___________ ,写出一种与SCN-互为等电子体分子的化学式___________ 。
(2)将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解反应的离子方程式:___________ 。
(3)向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。在该晶体中1mol[Cu(NH3)4]2+含有σ键的数目为___________ 。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是___________ 。
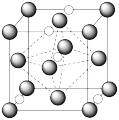
(4)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为___________ ,氮化钼晶胞边长为anm,晶体的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Cu原子价层电子排布式为
(2)将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解反应的离子方程式:
(3)向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。在该晶体中1mol[Cu(NH3)4]2+含有σ键的数目为
(4)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为

您最近半年使用:0次



