对氨基苯磺酸(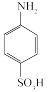 )是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO—SO3H)磺化得到。实验室可利用如图装置合成对氨基苯磺酸。实验步骤如下:
)是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO—SO3H)磺化得到。实验室可利用如图装置合成对氨基苯磺酸。实验步骤如下:
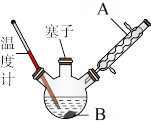
①在一个250 mL三口烧瓶中加入10 mL苯胺及少量固体B,把烧瓶放入冷水中,缓慢地加入 18 mL浓硫酸;②把三口烧瓶置于油浴中缓慢加热,控制温度为170~180 ℃,反应1~1.5 h;③将反应液冷却至约50 ℃,倒入盛有100 mL冷水的烧杯中,析出灰白色固体,进行操作C并用少量冷水洗涤固体,得到对氨基苯磺酸粗产品;④对粗产品进行操作D,再低温烘干即得到纯净的对氨基苯磺酸。
以下为两种有机物的部分物理性质,请回答有关问题。
(1)由苯胺生成对氨基苯磺酸的反应方程式___________ 。
(2)仪器A的名称为____ ,作用是______ 。
(3)固体B的作用是______ ;操作C的名称是______ 。
(4)下列说法正确的是______ 。
a.用油浴加热的好处是反应物受热均匀,便于控制温度
b.本实验步骤②也可以改用水浴加热
c.步骤③将反应液倒入100 mL冷水中的目的是分离苯胺和对氨基苯磺酸
d.步骤③用少量冷水洗涤的目的是除去固体表面的可溶性杂质,同时减少洗涤过程中的损失
(5)操作D的名称是___ ,具体过程包括:用适量__ 溶解粗产品→趁热抽滤→___ →过滤、洗涤。
 )是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO—SO3H)磺化得到。实验室可利用如图装置合成对氨基苯磺酸。实验步骤如下:
)是制取染料和一些药物的重要中间体,可由苯胺与浓硫酸(HO—SO3H)磺化得到。实验室可利用如图装置合成对氨基苯磺酸。实验步骤如下:
①在一个250 mL三口烧瓶中加入10 mL苯胺及少量固体B,把烧瓶放入冷水中,缓慢地加入 18 mL浓硫酸;②把三口烧瓶置于油浴中缓慢加热,控制温度为170~180 ℃,反应1~1.5 h;③将反应液冷却至约50 ℃,倒入盛有100 mL冷水的烧杯中,析出灰白色固体,进行操作C并用少量冷水洗涤固体,得到对氨基苯磺酸粗产品;④对粗产品进行操作D,再低温烘干即得到纯净的对氨基苯磺酸。
以下为两种有机物的部分物理性质,请回答有关问题。
| 苯胺 | 对氨基苯磺酸 | |
| 熔点 | -6.3 ℃ | 280 ℃ |
| 沸点 | 184 ℃ | 300 ℃开始分解炭化 |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于热水 |
(2)仪器A的名称为
(3)固体B的作用是
(4)下列说法正确的是
a.用油浴加热的好处是反应物受热均匀,便于控制温度
b.本实验步骤②也可以改用水浴加热
c.步骤③将反应液倒入100 mL冷水中的目的是分离苯胺和对氨基苯磺酸
d.步骤③用少量冷水洗涤的目的是除去固体表面的可溶性杂质,同时减少洗涤过程中的损失
(5)操作D的名称是
更新时间:2020-08-23 23:08:18
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
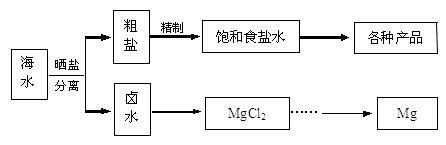
(1)粗盐中含Ca2+、Mg2+、Fe3+、SO42—及泥沙等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤; ⑦蒸发。正确的操作顺序是_____________ (填写序号字母)。
(2)NaCl做原料可以得到多种产品。
①工业上由金属钠制备过氧化钠的方法是:将金属钠迅速升温至熔化,并控制温度在300–400℃,通入经处理过的空气可制得过氧化钠,处理空气的目的是_____________________________ 。工业生产中因温度过低而得不到纯净的过氧化钠,你认为可能含有的杂质是____________ (填化学式)。
② 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为(常温下)________ (忽略反应前后溶液的体积变化)。
③ 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:____________________ 。
(3)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
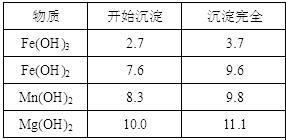
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。因此先向溶液中加入一种上述(1)中得到的物质NaClO,然后控制溶液的pH为_______________ 。
② 由MgCl2·6H2O晶体制备无水MgCl2的方法是____________________ 。

(1)粗盐中含Ca2+、Mg2+、Fe3+、SO42—及泥沙等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤; ⑦蒸发。正确的操作顺序是
| A.⑤①③②④⑥⑦ | B.⑤①②③⑥④⑦ |
| C.⑤③①②⑥④⑦ | D.⑤③②①⑥④⑦ |
(2)NaCl做原料可以得到多种产品。
①工业上由金属钠制备过氧化钠的方法是:将金属钠迅速升温至熔化,并控制温度在300–400℃,通入经处理过的空气可制得过氧化钠,处理空气的目的是
② 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为(常温下)
③ 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
(3)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。因此先向溶液中加入一种上述(1)中得到的物质NaClO,然后控制溶液的pH为

② 由MgCl2·6H2O晶体制备无水MgCl2的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】镁及其化合物在现代工业、国防建设中有着广泛的应用。回答下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的___________ ,还生成少量的___________ (填化学式)。
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价为___________ ,CH3MgCl水解时除生成甲烷外,还生成一种碱和一种盐。写出该反应的化学方程式:___________ 。
(3)Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3,不考虑杂质)为原料制备Mg(OH)2和CaCO3的工艺流程如下:

“煅烧”时称取27.6g白云石,高温加热到质量不再变化,收集到的CO2为6.72L(标准状况下),若工艺中不考虑Ca、Mg损失,则Mg(OH)2和CaCO3的质量分别为___________ 、___________ 。
(1)单质镁在空气中燃烧的主要产物是白色的
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价为
(3)Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3,不考虑杂质)为原料制备Mg(OH)2和CaCO3的工艺流程如下:

“煅烧”时称取27.6g白云石,高温加热到质量不再变化,收集到的CO2为6.72L(标准状况下),若工艺中不考虑Ca、Mg损失,则Mg(OH)2和CaCO3的质量分别为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含FeS、CuO、SiO2等杂质)制备NaBiO3的工艺流程如下图:
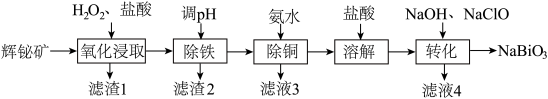
已知:i.Bi3+易水解;NaBiO3难溶于冷水
ii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质
iii.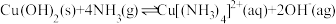
iv.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)为了提高辉铋矿的浸取率,可采取的措施为_______ 。(写一条)
(2)“滤渣1”的主要成分是_______ 。(填化学式)
(3)用硝酸替代“盐酸,H2O2”也可以实现“氧化浸取”,从环保角度考虑,存在的缺点是_______ 。
(4)检验“氧化浸取”液中是否含Fe2+,可选择的试剂是_______ (填标号)。
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液和双氧水
(5)“除铁”时,调节溶液pH值的范围是_______ 。
(6)“转化”时,生成NaBiO3的离子方程式是_______ 。
(7)“转化”后应冷却至室温再过滤,原因是_______ 。

已知:i.Bi3+易水解;NaBiO3难溶于冷水
ii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质
iii.
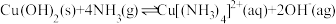
iv.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Bi3+ |
| 开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
| 沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)为了提高辉铋矿的浸取率,可采取的措施为
(2)“滤渣1”的主要成分是
(3)用硝酸替代“盐酸,H2O2”也可以实现“氧化浸取”,从环保角度考虑,存在的缺点是
(4)检验“氧化浸取”液中是否含Fe2+,可选择的试剂是
a.KSCN溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液和双氧水
(5)“除铁”时,调节溶液pH值的范围是
(6)“转化”时,生成NaBiO3的离子方程式是
(7)“转化”后应冷却至室温再过滤,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】由邻苯二甲酸酐和正丁醇制备邻苯二甲酸二丁酯的实验装置(部分装置省略)如图甲,实验操作流程如图乙。
已知:正丁醇的沸点为118℃;
纯邻苯二甲酸二丁酯沸点为340℃,温度超过180℃时易发生分解。

①向三颈烧瓶内依次加入6.0g邻苯二甲酸酐、11.4g正丁醇、少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,升温至160℃,搅拌、保温至反应结束。
③冷却至室温,将反应混合物倒出,通过操作X,得到粗产品。
④粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→减压蒸馏。
⑤得到产品6.7g。
请回答下列问题:
(1)仪器a的名称为_____ 。
(2)步骤②中需要不断从分水器(仪器a下面的仪器)下部分离出产物水的目的:_____ ,判断反应已结束的方法是_____ 。
(3)反应Ⅰ进行得迅速而完全,反应Ⅱ是可逆反应,进行得较缓慢,为提高反应速率,可采取的措施是_____ (任写一点即可)。
(4)操作X中,应先用5% 溶液洗涤,其作用是
溶液洗涤,其作用是_____ ;不能使用氢氧化钠洗涤的原因是_____ 。
(5)有机实验中,温度的调控尤为重要,步骤②中温度控制在105℃的目的是:_____ 。
(6)本实验中,邻苯二甲酸二丁酯的产率为_____ %(结果保留小数点后两位)。
已知:正丁醇的沸点为118℃;
纯邻苯二甲酸二丁酯沸点为340℃,温度超过180℃时易发生分解。

①向三颈烧瓶内依次加入6.0g邻苯二甲酸酐、11.4g正丁醇、少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,升温至160℃,搅拌、保温至反应结束。
③冷却至室温,将反应混合物倒出,通过操作X,得到粗产品。
④粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→减压蒸馏。
⑤得到产品6.7g。
请回答下列问题:
(1)仪器a的名称为
(2)步骤②中需要不断从分水器(仪器a下面的仪器)下部分离出产物水的目的:
(3)反应Ⅰ进行得迅速而完全,反应Ⅱ是可逆反应,进行得较缓慢,为提高反应速率,可采取的措施是
(4)操作X中,应先用5%
 溶液洗涤,其作用是
溶液洗涤,其作用是(5)有机实验中,温度的调控尤为重要,步骤②中温度控制在105℃的目的是:
(6)本实验中,邻苯二甲酸二丁酯的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示;试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体),已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下:
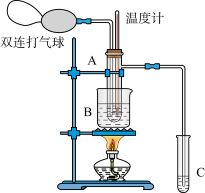
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)___________ 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置:
①在实验开始时温度计水银球的位置应在____________ 。
②当试管内的主要反应完成后温度计水银球的位置应在___________ ,目的是___________ 。
(3)烧杯B内盛装的液体可以是___________ (写出一种即可)。
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置:
①在实验开始时温度计水银球的位置应在
②当试管内的主要反应完成后温度计水银球的位置应在
(3)烧杯B内盛装的液体可以是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】对氯苯氧乙酸是一种植物生长调节剂中间体,它的一种合成方法的原理如下:

副反应:ClCH2COOH + 2NaOH → HOCH2COONa+ NaCl+ H2O
已知:对氯苯氧乙酸在水中溶解度较小而在乙醇中溶解度较大。
实验步骤:称取6.5g(0.05mol)对氯苯酚于仪器a(反应装置如图)中,加入10mL20%NaOH溶液,加入一定量KI溶液,在两恒压滴液漏斗中分别加入15 mL 20% NaOH溶液和5.3g氯乙酸水溶液。保持100~120° C加热,将两恒压滴液漏斗中的液体同时缓慢滴入仪器a中。反应完全后,停止加热,趁热将反应混合液倒入250 mL烧杯中,趁热边搅拌边滴加盐酸调pH至1,过滤得到对氯苯氧乙酸粗产品。
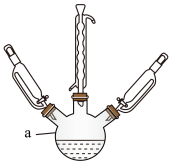
回答下列问题:
(1)仪器a的名称是____ ,保持反应温度在100~120 °C的加热方式为__ 。
(2)经实验测定原料配比 对产率的影响如表所示。
对产率的影响如表所示。
工业上选撣的最佳原料配比为______ 。
(3)对氯苯氧乙酸钠在水中溶解度_____ (填“大”或“小”)。所得粗产品加入____ 溶解,再加入水,冷却结晶,过滤,冷水洗涤,真空干燥,得到对氯苯氧乙酸8.2 g,则产率为_____ %(保留两位有效数字)。

副反应:ClCH2COOH + 2NaOH → HOCH2COONa+ NaCl+ H2O
已知:对氯苯氧乙酸在水中溶解度较小而在乙醇中溶解度较大。
实验步骤:称取6.5g(0.05mol)对氯苯酚于仪器a(反应装置如图)中,加入10mL20%NaOH溶液,加入一定量KI溶液,在两恒压滴液漏斗中分别加入15 mL 20% NaOH溶液和5.3g氯乙酸水溶液。保持100~120° C加热,将两恒压滴液漏斗中的液体同时缓慢滴入仪器a中。反应完全后,停止加热,趁热将反应混合液倒入250 mL烧杯中,趁热边搅拌边滴加盐酸调pH至1,过滤得到对氯苯氧乙酸粗产品。

回答下列问题:
(1)仪器a的名称是
(2)经实验测定原料配比
 对产率的影响如表所示。
对产率的影响如表所示。 | 产率(%) |
| 1 : 1.00 1 : 1.05 1 : 1.10 1 : 1.20 | 76.1 81.5 90. 1 89.9 |
(3)对氯苯氧乙酸钠在水中溶解度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】NaClO2是一种高效含氯消毒剂和漂白剂,主要用于自来水、污水等水环境的杀菌消毒,也常用作纸浆、砂糖、油脂的漂白剂。下图为生产NaClO2的流程之一(夹持装置省略)。
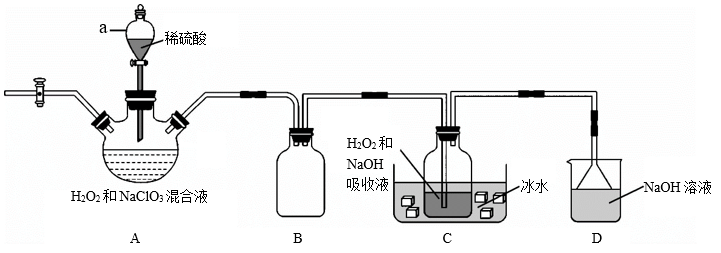
已知:NaClO2饱和溶液在低于38℃时会析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)NaClO2的化学名称是___________ 。
(2)装置A用来制取ClO2,仪器a的名称是___________ 。
(3)装置B的作用是___________ 。
(4)装置C中发生反应的离子方程式为___________ ,采用“冰水浴”的目的是___________ 。
(5)采用“滴定法”测样品纯度的方法为:准确称取所得NaClO2样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成500mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液用cmol/L的Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。(已知: 、
、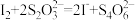 )
)
①达到滴定终点时的现象为___________ 。
②该样品中NaClO2的质量分数为___________ (用含m、c、V的代数式表示)。

已知:NaClO2饱和溶液在低于38℃时会析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)NaClO2的化学名称是
(2)装置A用来制取ClO2,仪器a的名称是
(3)装置B的作用是
(4)装置C中发生反应的离子方程式为
(5)采用“滴定法”测样品纯度的方法为:准确称取所得NaClO2样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成500mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液用cmol/L的Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。(已知:
 、
、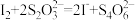 )
)①达到滴定终点时的现象为
②该样品中NaClO2的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
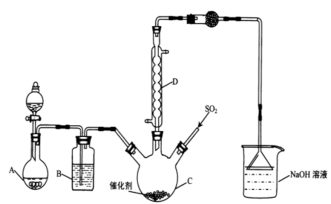
【推荐2】磺酰氯(SO2Cl2)是锂电池正极活性物质,熔点-54.1℃,沸点69.1℃,遇到潮湿的空气易水解。实验室可依据反应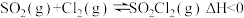 ,制备磺酰氯,实验装置如图(夹持装置均未画出)。
,制备磺酰氯,实验装置如图(夹持装置均未画出)。
回答下列问题:
(1)装置A中加入了KMnO4固体和浓盐酸制取氯气,则反应方程式为_______ 。
(2)装置B中的试剂是_______ 。仪器C的名称是_______ 。仪器D的作用是_______ 。
(3)实验中装置C采用冰水浴,目的是_______ 。
(4)SO2C12遇到潮湿的空气易产生大量白雾,该反应的化学方程式为_______ 。
(5)磺酰氯(SO2Cl2)应储存于阴凉、干燥、通风的库房,但久置后会呈现黄色,原因是_______ 。
(6)氯磺酸(HSO3C1)分解也可得到磺酰氯SO2Cl2,方程式为2HSO3C1=H2SO4+SO2C12,此方法得到的产品中混有硫酸。从分解产物中分离磺酰氯的方法是_______ 。
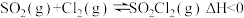 ,制备磺酰氯,实验装置如图(夹持装置均未画出)。
,制备磺酰氯,实验装置如图(夹持装置均未画出)。
回答下列问题:
(1)装置A中加入了KMnO4固体和浓盐酸制取氯气,则反应方程式为
(2)装置B中的试剂是
(3)实验中装置C采用冰水浴,目的是
(4)SO2C12遇到潮湿的空气易产生大量白雾,该反应的化学方程式为
(5)磺酰氯(SO2Cl2)应储存于阴凉、干燥、通风的库房,但久置后会呈现黄色,原因是
(6)氯磺酸(HSO3C1)分解也可得到磺酰氯SO2Cl2,方程式为2HSO3C1=H2SO4+SO2C12,此方法得到的产品中混有硫酸。从分解产物中分离磺酰氯的方法是
您最近一年使用:0次
【推荐3】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,易水解生成HNO2和HCl。某学习小组在实验室中用如图所示装置制备ClNO。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,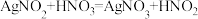 。
。
回答下列问题:
(1)仪器a在装置C中的作用是_____________ 。
(2)装置B的作用是_________________ 。
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中______ 时关闭K1、K2。向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(4)装置D中干燥管的作用是_________________________ 。
(5)实验过程中,若学习小组同学用酒精灯大火加热制取NO,对本实验造成的不利影响除了有反应速率过快,使NO来不及反应即大量逸出外,还可能有________________________ 。
(6)要验证ClNO与H2O反应后的溶液中存在Cl—和HNO2,合理的操作步骤及正确的顺序是___________ (填标号)。
a.向烧杯中滴加过量KI—淀粉溶液,溶液变蓝色
b.取1.0ml三颈瓶中产品于烧杯中,加入10.0mlH2O充分反应
c.向烧杯中滴加酸性 溶液,溶液紫色褪去
溶液,溶液紫色褪去
a.向烧杯中滴加足量 溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
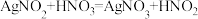 。
。
回答下列问题:
(1)仪器a在装置C中的作用是
(2)装置B的作用是
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中
(4)装置D中干燥管的作用是
(5)实验过程中,若学习小组同学用酒精灯大火加热制取NO,对本实验造成的不利影响除了有反应速率过快,使NO来不及反应即大量逸出外,还可能有
(6)要验证ClNO与H2O反应后的溶液中存在Cl—和HNO2,合理的操作步骤及正确的顺序是
a.向烧杯中滴加过量KI—淀粉溶液,溶液变蓝色
b.取1.0ml三颈瓶中产品于烧杯中,加入10.0mlH2O充分反应
c.向烧杯中滴加酸性
 溶液,溶液紫色褪去
溶液,溶液紫色褪去a.向烧杯中滴加足量
 溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
您最近一年使用:0次



