在某温度时,A+B⇌2C反应达到平衡。
(1)如果B为气态,增加体系的压强时,B的含量增加,则A为______ 态或______ 态,C为______ 态。
(2)如果升高温度,C的平衡浓度增大,则正反应方向是______ 热反应。
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
H2O2(l)= H2O(l)+ 1/2O2(g) ΔH=-98.23kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______ 。
(1)如果B为气态,增加体系的压强时,B的含量增加,则A为
(2)如果升高温度,C的平衡浓度增大,则正反应方向是
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
H2O2(l)= H2O(l)+ 1/2O2(g) ΔH=-98.23kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
更新时间:2021-01-07 21:07:15
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是__________________________ 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______________________ 。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=_________ 。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式____________________________________________ 。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式_______________ 。
 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】途径I: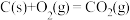
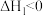 。
。
途径Ⅱ:先制水煤气
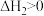 ,
,
再燃烧水煤气: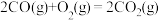
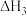 ,
,
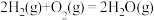
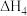 。
。
请回答下列问题:
(1)判断:途径I放出的热量______ (填“>”、“=”或“<”)途径Ⅱ放出的热量。
(2)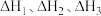 和
和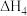 的数学关系式是
的数学关系式是______ 。
(3)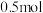 气态高能燃料乙硼烷(
气态高能燃料乙硼烷(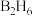 )在氧气中燃烧生成固态三氧化二硼(
)在氧气中燃烧生成固态三氧化二硼( )和液态水,放出
)和液态水,放出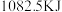 热量,其热化学方程式
热量,其热化学方程式______ 。
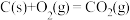
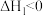 。
。途径Ⅱ:先制水煤气

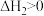 ,
,再燃烧水煤气:
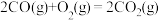
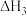 ,
,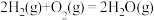
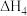 。
。请回答下列问题:
(1)判断:途径I放出的热量
(2)
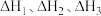 和
和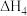 的数学关系式是
的数学关系式是(3)
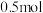 气态高能燃料乙硼烷(
气态高能燃料乙硼烷(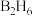 )在氧气中燃烧生成固态三氧化二硼(
)在氧气中燃烧生成固态三氧化二硼( )和液态水,放出
)和液态水,放出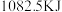 热量,其热化学方程式
热量,其热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】按要求回答下列问题:
(1)下列变化属于吸热反应的是______ (填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤ 固体溶于水
固体溶于水
(2)强酸与强碱的稀溶液发生中和反应生成1mol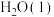 时的反应热
时的反应热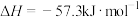 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为______ 。(结果保留小数点后一位)
(3)已知1g 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为______ ,试写出该反应的热化学方程式为______ 。
(4)试比较反应热的大小:
①

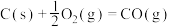
则
______  (填“>”或“<”,下同)。
(填“>”或“<”,下同)。
②已知常温时红磷比白磷稳定。
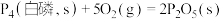

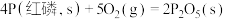

则
______  。
。
(5)已知:25℃、101kPa时,
①

②

③
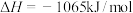
则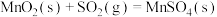

______ 。
(1)下列变化属于吸热反应的是
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤
 固体溶于水
固体溶于水(2)强酸与强碱的稀溶液发生中和反应生成1mol
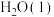 时的反应热
时的反应热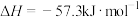 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为(3)已知1g
 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为(4)试比较反应热的大小:
①


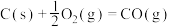
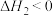
则

 (填“>”或“<”,下同)。
(填“>”或“<”,下同)。②已知常温时红磷比白磷稳定。
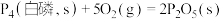

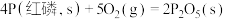

则

 。
。(5)已知:25℃、101kPa时,
①


②


③

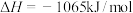
则
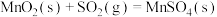

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变小;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,(填“吸”或“放”)且m+n_______ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_______ 。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_______ ,B的转化率_______ 。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ ;而维持容器内压强不变,充入氖气时,混合物颜色_______ (填“变深”“变浅”或“不变”)。
(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】“等效”是化学学科解决复杂体系问题的方法之一。密闭容器中充入4molSO2和2molO2,发生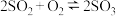
 ,回答问题
,回答问题
(1)恒温恒容,达平衡时SO2的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后SO2的体积分数仍为a%的是______。
(2)等体积的甲、乙、丙三个密闭容器,甲容器保持恒温恒容、乙容器保持恒温恒压、丙是恒容绝热容器,一段时间后三个容器均达到平衡,SO2的平衡转化率分别为 、
、 、
、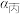 ,比较
,比较 、
、 、
、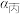 的大小
的大小______
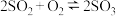
 ,回答问题
,回答问题(1)恒温恒容,达平衡时SO2的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后SO2的体积分数仍为a%的是______。
| A.2molSO3 | B.2molSO2+1molO2 |
| C.4molSO3 | D.2.5molSO2+1.25molO2+1.5molSO3 |
 、
、 、
、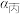 ,比较
,比较 、
、 、
、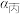 的大小
的大小
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】下列反应在210℃达到平衡:
PCl5(g) PCl3(g)+Cl2(g)△H>0 K=1 ①
PCl3(g)+Cl2(g)△H>0 K=1 ①
CO(g)+Cl2(g) COCl2(g)△H <0 K=5×104②
COCl2(g)△H <0 K=5×104②
COCl2(g) CO(g)+ Cl2(g)△H>0 ③
CO(g)+ Cl2(g)△H>0 ③
(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度的关系是:温度升高,K值_________ (填一定增大、一定减小、或可能增大也可能减小)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是_______
A.c(PCl5) = c(PCl3)= c(Cl2)=1 B.c(PCl5)= c(PCl3)·c(Cl2)=1 C.c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式_________ (填“相同”或“不同”)
(3)降低Cl2浓度,反应③的K值__________ (填“增大”、“减少”或“不变”)。
PCl5(g)
 PCl3(g)+Cl2(g)△H>0 K=1 ①
PCl3(g)+Cl2(g)△H>0 K=1 ①CO(g)+Cl2(g)
 COCl2(g)△H <0 K=5×104②
COCl2(g)△H <0 K=5×104②COCl2(g)
 CO(g)+ Cl2(g)△H>0 ③
CO(g)+ Cl2(g)△H>0 ③(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度的关系是:温度升高,K值
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是
A.c(PCl5) = c(PCl3)= c(Cl2)=1 B.c(PCl5)= c(PCl3)·c(Cl2)=1 C.c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式
(3)降低Cl2浓度,反应③的K值
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
①试比较K1、K2的大小,K1___ K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是___ (填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,2NH3(g) N2(g)+3H2(g)的K′=
N2(g)+3H2(g)的K′=___ (填数值)。
④400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正___ v(N2)逆(填“>”、“<”“=”或“不能确定”)。
⑤若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡___ (填“向左”、“向右”或“不”)移动;使用催化剂__ (填“增大”、“减小”或“不改变”)反应的ΔH。
在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,2NH3(g)
 N2(g)+3H2(g)的K′=
N2(g)+3H2(g)的K′=④400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
⑤若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是 A
A___  B。(填“>”、“<”、“=”);若打开活塞K2,气球B将
B。(填“>”、“<”、“=”);若打开活塞K2,气球B将_____ (填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______ (填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____ ,B中NO2的转化率将_______ (填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_____ 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___
 N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是
 A
A B。(填“>”、“<”、“=”);若打开活塞K2,气球B将
B。(填“>”、“<”、“=”);若打开活塞K2,气球B将(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为
您最近一年使用:0次



