常温下,下列有关溶液的叙述正确的是
A.在0.1 mol·L-1Na2C2O4溶液中: |
B.在Na2SO3溶液中: |
| C.pH=6的醋酸溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8 mol·L-1 |
D.浓度均为0.1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合: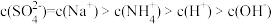 |
更新时间:2021-01-23 12:38:18
|
相似题推荐
多选题
|
较难
(0.4)
【推荐1】常温下,向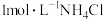 溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到从b点开始溶液中有白色沉淀生成。下列说法错误的是(已知
溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到从b点开始溶液中有白色沉淀生成。下列说法错误的是(已知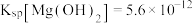 )
)

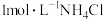 溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到从b点开始溶液中有白色沉淀生成。下列说法错误的是(已知
溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到从b点开始溶液中有白色沉淀生成。下列说法错误的是(已知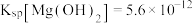 )
)
A.a点溶液中,离子浓度: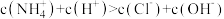 |
B.b点溶液中, |
| C.体系中,水的电离程度:a>c>b |
D.常温下, 的水解平衡常数的数量级为 的水解平衡常数的数量级为 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示。下列说法中不正确 的是


| A.a、b、c、d四点中水的电离程度最大的是c点 |
| B.a点时:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.c点时:c(H+)=c(CH3COOH)+c(OH-) |
| D.d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】H₂L为某邻苯二酚类配体,其pKa1=7.46,pK2=12.4(pKa=-lgKa)。常温下构建Fe(Ⅲ)-H₂I溶液体系,其中c0(Fe3+)=2.0×10-4mol·L,c0(H2L)=5.0×10-3mol⋅L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数  ,已知lg 5≈0.7。下列说法正确的是
,已知lg 5≈0.7。下列说法正确的是
 ,已知lg 5≈0.7。下列说法正确的是
,已知lg 5≈0.7。下列说法正确的是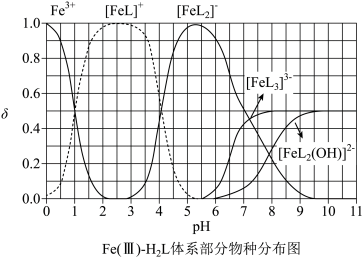
| A.当pH=0.5时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-) |
B.L²⁻+Fe³⁺ FeL⁺的平衡常数的lgK约为20 FeL⁺的平衡常数的lgK约为20 |
| C.pH在9.5~10.5之间,含L的物种主要为HL⁻ |
| D.当pH=10时,参与配位的c(L²⁻)≈2×10⁻⁴mol⋅L⁻¹ |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】某碱性溶液中只含有Na+、CH3COO-、H+、OH-4种离子。下列描述正确的是( )。
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐3】室温下,向H2A溶液中滴加NaOH溶液,若 ,则所得溶液中pc(H2A)、pc(HA-)、pc(A2-)与溶液pH的关系如图所示,已知醋酸的电离常数
,则所得溶液中pc(H2A)、pc(HA-)、pc(A2-)与溶液pH的关系如图所示,已知醋酸的电离常数 。下列说法正确的是
。下列说法正确的是

 ,则所得溶液中pc(H2A)、pc(HA-)、pc(A2-)与溶液pH的关系如图所示,已知醋酸的电离常数
,则所得溶液中pc(H2A)、pc(HA-)、pc(A2-)与溶液pH的关系如图所示,已知醋酸的电离常数 。下列说法正确的是
。下列说法正确的是
| A.CH3COO-与HA-可以大量共存 |
| B.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-) |
C.M点时,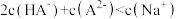 |
D.NaHA溶液中: |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】已知邻苯二甲酸(H2A)的Kal=1.1×10-3,Ka2=3.9×10-6常温下,用0.l0mol•L-1的NaOH溶液滴定20.0mL0.l0mol•L-1的邻苯二甲酸氢钾(KHA)溶液,溶液pH的变化曲线如图所示。下列叙述正确的是
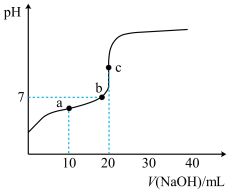

| A.a点的混合溶液中:c(K+)>c(HA-)>c(Na+)>c(A2-) |
| B.b点的混合溶液中:c(Na+)=c(A2-)+c(H2A) |
| C.c点的混合溶液中:c(OH-)-c(H+)=c(HA-)+2c(H2A) |
| D.从a点到c点水的电离程度逐渐增大 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.在0.1mol·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.在0.1mol·L-1CH3COOH中: c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C.0.2mol·L-1NaHCO3溶液与0.1mol·L-1KOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.2mol·L-1氨水与0.1mol·L-1HCl溶液等体积混合:c(Cl-)+c(H+)=c(NH3·H2O)+c(OH-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐3】室温下,下列混合溶液中,各离子浓度的关系正确的是
| A.pH=12的一元弱碱的溶液浓度一定比pH=2的一元强酸溶液浓度大 |
| B.浓度均为0.1mol/L的硫酸氢钠溶液与氢氧化钠溶液等体积混合后:c(Na+)=2c(SO42-)=0.2mol •L-1 |
| C.H2C2O4为二元弱酸,浓度均为0.1 mol/L的Na2C2O4溶液中: c(Na+) =2c(C2O42-) +c(HC2O4-) + c(H2C2O4) |
| D.浓度均为0.l mol/L的NaHSO3溶液和NaHCO3溶液中(R表示S或C):c(H+)<c(RO32-)+c(OH-) |
您最近一年使用:0次

 )[NH
)[NH ]随滴加HCl溶液体积V(HCl)的变化关系如图所示。下列有关说法错误的是
]随滴加HCl溶液体积V(HCl)的变化关系如图所示。下列有关说法错误的是


