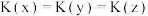已知反应N2(g)+3H2(g)⇌2NH3(g)ΔH=﹣92.2kJ·mol﹣1。当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示。下列说法正确的是
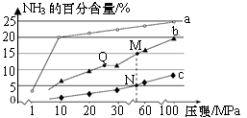

| A.若反应器中充入1molN2和3molH2,则反应达平衡时将释放92.2kJ热量 |
| B.从Q到M,平衡向左移动 |
| C.M、N、Q达到平衡所需时间关系为tQ>tM>tN |
| D.图中M、N、Q点平衡常数K的大小关系为K(N)>K(M)=K(Q) |
更新时间:2021-02-02 13:00:21
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列与热化学相关的说法正确的是
| A.已知:N2(g)+3H2(g)⇌2NH3(g) ∆H=-92 kJ/mol,增加氮气和氢气的用量,则∆H变大 |
| B.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| C.已知:S(g)+O2(g)=SO2(g) ∆H1;S(s)+O2(g)=SO2(g) ∆H2,则∆H1>∆H2 |
| D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) ∆H=-57.3 kJ/mol,若将1 mol NaOH固体加入1 L 1 mo/L的稀盐酸溶液中,放出的热量大于57.3 kJ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】20世纪初,德国化学家哈伯首次利用氨气和氢气合成了氨气N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
 2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是
2NH3(g) ΔH=-92.4kJ·mol-1,以氨气为原料可制得各种氮肥,大大提高了粮食产量。下列有关合成氨反应说法正确的是| A.使用催化剂能改变反应途径,提高反应的活化能 |
| B.及时液化分离出氨气,有利于提高反应物的转化率 |
| C.用E总表示物质能量之和,E总(反应物)<E总(生成物) |
| D.向合成塔中充入1molN2和3molH2,充分反应后放出92.4kJ 的热量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】反应条件与环境对化学反应会产生影响,下列说法错误的是
| 化学反应 | 影响因素 | |
| A | 过氧化氢不稳定,向溶液中加入少量 后分解速率明显加快 后分解速率明显加快 | 催化剂 |
| B | Na与 反应既能生成 反应既能生成 也能生成 也能生成 | 温度 |
| C | 20mL过氧化氢比10mL过氧化氢产生更多的 | 浓度 |
| D | 过氧化氢在酸、碱条件下将高锰酸钾分别还原成 、 、 | 溶液酸碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】将盐酸滴到碳酸钠粉未上,能使反应的最初速率加快的是
| A.盐酸浓度不变,使用量增大一倍 | B.盐酸浓度增加一倍,用量减至 |
| C.增大碳酸钠粉未的量 | D.使反应在较低温度下进行 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐3】苯乙烯与溴苯在一定条件下发生Heck反应: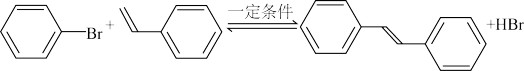 ,某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如表数据:
,某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如表数据:
下列说法不正确的是
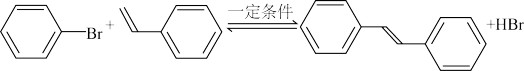 ,某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如表数据:
,某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如表数据:| 反应温度/℃ | 100 | 100 | 100 | 100 | 120 | 140 | 160 |
| 反应时间/h | 10 | 12 | 14 | 16 | 14 | 14 | 14 |
| 产率% | 81.2 | 84.4 | 86.6 | 86.6 | 93.5 | 96.6 | 96.0 |
| A.该反应为吸热反应 |
| B.由表中数据推测最佳反应条件为140℃、14h |
| C.在100℃时、反应时间10-14h内,产率增加的原因是反应速率增大 |
| D.从140℃到160℃,相同时间产率下降的原因可能是催化剂活性降低 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】将 和
和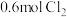 充入体积不变的密闭容器中,在一定条件下发生反应
充入体积不变的密闭容器中,在一定条件下发生反应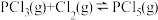 ,反应达到平衡时,测得
,反应达到平衡时,测得 为0.4mol,下列说法正确的是
为0.4mol,下列说法正确的是
 和
和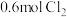 充入体积不变的密闭容器中,在一定条件下发生反应
充入体积不变的密闭容器中,在一定条件下发生反应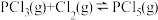 ,反应达到平衡时,测得
,反应达到平衡时,测得 为0.4mol,下列说法正确的是
为0.4mol,下列说法正确的是A. 的平衡转化率为50% 的平衡转化率为50% |
| B.该反应的平衡常数K=5 |
C. 的物质的量分数为40% 的物质的量分数为40% |
D.保持其他条件不变,再充入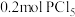 和 和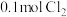 ,此时v(正)>v(逆) ,此时v(正)>v(逆) |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】已知: 和
和 存在平衡:
存在平衡: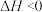 ,在
,在 时,平衡常数:
时,平衡常数: 。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离
。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离 和
和 。获得相同的吸附量(如
。获得相同的吸附量(如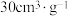 )时,
)时, 需要的时间至少是
需要的时间至少是 的2.5倍。下列叙述错误的是
的2.5倍。下列叙述错误的是
 和
和 存在平衡:
存在平衡: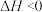 ,在
,在 时,平衡常数:
时,平衡常数: 。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离
。华南理工大学顾成课题组最近开发一种新材料(W),通过新材料吸附力不同高效分离 和
和 。获得相同的吸附量(如
。获得相同的吸附量(如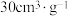 )时,
)时, 需要的时间至少是
需要的时间至少是 的2.5倍。下列叙述错误的是
的2.5倍。下列叙述错误的是A.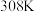 时,上述反应的平衡常数 时,上述反应的平衡常数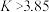 |
B.达到平衡后增大 的量,则上述反应速率增大 的量,则上述反应速率增大 |
C.相同条件下,上述材料对 吸附速率小于 吸附速率小于 |
D.上述混合物通过W材料,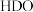 平衡浓度降低 平衡浓度降低 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】已知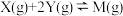 反应的平衡常数如表所示:
反应的平衡常数如表所示:
该反应的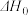
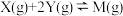 反应的平衡常数如表所示:
反应的平衡常数如表所示:| 温度/℃ | 0 | 100 | T | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1.0×10-5 |
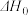
| A.大于0 | B.小于0 | C.等于0 | D.无法判断 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】下列关于平衡常数的说法正确的是( )
| A.在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度 |
| B.在任何条件下,化学平衡常数是一个恒定值 |
| C.平衡常数的大小与温度、浓度、压强、催化剂等无关 |
| D.从平衡常数的大小可以推断一个反应进行的程度 |
您最近一年使用:0次

 和
和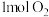 充分反应后放出热量196.6
充分反应后放出热量196.6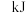 ,则
,则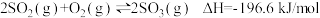
 的单位中“
的单位中“ ”是指“每摩尔反应”
”是指“每摩尔反应” ,则HNC(g)更稳定
,则HNC(g)更稳定 ,则甲烷燃烧的热化学方程式表示为
,则甲烷燃烧的热化学方程式表示为
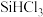 的方程式为
的方程式为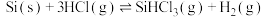 ,同时还有其他副反应发生。当反应体系的压强为
,同时还有其他副反应发生。当反应体系的压强为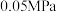 时,分别改变进料比
时,分别改变进料比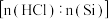 和反应温度,二者对
和反应温度,二者对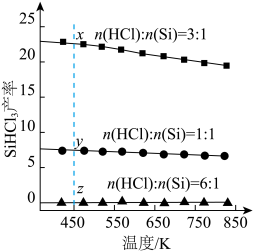
 的用量,
的用量, ,平衡常数:
,平衡常数: