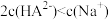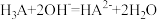常温下,Ka(HCOOH)=1.8×10-4,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5,下列说法正确的是
| A.浓度均为0.1mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者 |
| B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 |
| C.0.2mol·L-1HCOOH与0.1mol·L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(H+)+c(HCOOH) |
| D.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
20-21高二上·河北石家庄·阶段练习 查看更多[2]
河北正定中学2020-2021学年高二上学期第一次月考化学试题(已下线)3.3.4 溶液中粒子浓度的关系(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
更新时间:2021-09-15 12:12:45
|
相似题推荐
多选题
|
较难
(0.4)
【推荐1】向20 mL 0.3 mol·L-1 H3XO3溶液中滴加同浓度的NaOH溶液,此过程中含X的粒子分布系数δ随溶液pH的变化关系如图所示,当加入40 mL NaOH溶液时pH为a (忽略溶液体积变化)下列说法正确的是
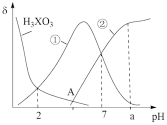

A.曲线①代表δ(HXO ),曲线②代表δ(H2XO ),曲线②代表δ(H2XO ) ) |
B.H3XO3的第三级电离为: HXO  H++XO H++XO ;Ka3=10-7 ;Ka3=10-7 |
C.A点溶液中存在关系式: c(Na+)<c(H3XO3)+c(H2XO )+c(HXO )+c(HXO ) ) |
D.pH为a时,c(H2XO )约为106-a mol·L-1 )约为106-a mol·L-1 |
您最近一年使用:0次
多选题
|
较难
(0.4)
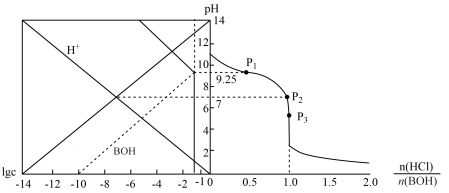
【推荐2】25℃时,用HCl气体调节0.1mol·L-1碱BOH的pH,体系中粒子浓度的对数值(1gc)、反应物的物质的量之比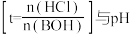 的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
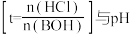 的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
| A.25℃时,BOH的电离平衡常数为10-9.25 |
| B.t=0.5,2c(H+)+c(BOH)=2c(OH-)+c(B+) |
| C.P1所示溶液:c(C1-)<0.05mol·L-1 |
| D.P2所示溶液:c(B+) >100c(BOH) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐1】已知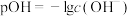 。初始温度25℃时,向
。初始温度25℃时,向 氨水中滴加
氨水中滴加 的稀硫酸,测得混合溶液的温度T、pOH随加入稀硫酸体积V的变化如图所示。下列说法正确的是
的稀硫酸,测得混合溶液的温度T、pOH随加入稀硫酸体积V的变化如图所示。下列说法正确的是

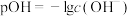 。初始温度25℃时,向
。初始温度25℃时,向 氨水中滴加
氨水中滴加 的稀硫酸,测得混合溶液的温度T、pOH随加入稀硫酸体积V的变化如图所示。下列说法正确的是
的稀硫酸,测得混合溶液的温度T、pOH随加入稀硫酸体积V的变化如图所示。下列说法正确的是
A.a、b、c三点对应 的水解平衡常数: 的水解平衡常数: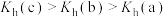 |
B.a点溶液中水电离产生的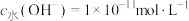 |
C.图中x=7,b点溶液中,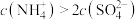 |
D.若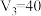 ,则c点对应溶液中 ,则c点对应溶液中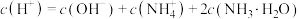 |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐2】已知: 。室温下,几种弱酸的
。室温下,几种弱酸的 如下表所示:
如下表所示:
下列有关微粒浓度的说法正确的是
 。室温下,几种弱酸的
。室温下,几种弱酸的 如下表所示:
如下表所示:| 化学式 |  |  |  |
 | 4.74 | 3.74 | 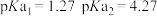 |
A.浓度均为 和 和 溶液中: 溶液中: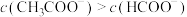 |
B.浓度为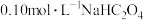 溶液中: 溶液中: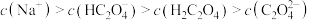 |
C.室温下, 的 的 和 和 的混合溶液中: 的混合溶液中: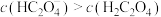 |
D.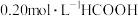 溶液与 溶液与 溶液等体积混合后: 溶液等体积混合后: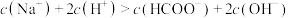 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐3】25 ℃,c(HCN)+c(CN-) =0.1 mol·L-1的一组HCN和NaCN的混合溶液,溶液中c (HCN)、c(CN-)与pH的关系如图所示。下列有关离子浓度关系叙述正确的是
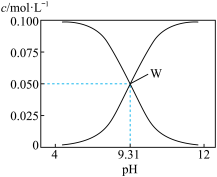

| A.将0.1 mol·L-1的HCN溶液和0.1 mol·L-1NaCN溶液等体积混合(忽略溶液体积变化):c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+) |
| B.W点表示溶液中:c(Na+) + c(H+) = c(HCN) |
| C.pH = 8的溶液中:c(Na+) + c(H+) + c(HCN) = 0.1 mol·L-1 + c(OH-) |
| D.将0.3 mol·L-1 HCN溶液和0.2 mol·L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-) + 3c(OH-) = 2c(HCN)+ 3c(H+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】室温下,向20.00mL HX溶液中逐滴滴加
HX溶液中逐滴滴加 NaOH溶液。已知
NaOH溶液。已知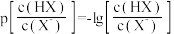 ,溶液pH随
,溶液pH随 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
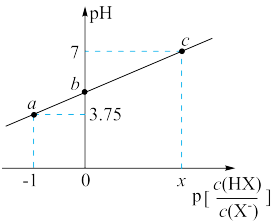
 HX溶液中逐滴滴加
HX溶液中逐滴滴加 NaOH溶液。已知
NaOH溶液。已知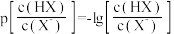 ,溶液pH随
,溶液pH随 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是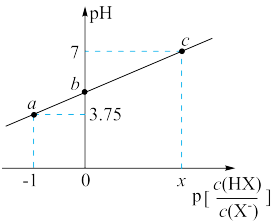
A.常温下,HX的电离常数的数量级为 |
| B.x=2.25 |
| C.水的电离程度:a>b>c |
D.当 时,加入NaOH溶液的体积大于10.00mL 时,加入NaOH溶液的体积大于10.00mL |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。下列说法正确的是
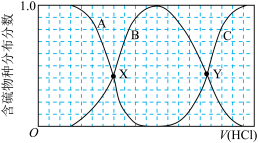

| A.含硫物种B表示HS- |
| B.在滴加盐酸过程中,溶液中c(Na+)与含硫物种浓度的关系为:c(Na+)=2[c(H2S)+c(HS-)+c(S2-)] |
| C.X、Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka1 |
| D.NaHS溶液呈碱性,若向该溶液中加入CuSO4溶液,恰好完全反应时所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+ |
您最近一年使用:0次

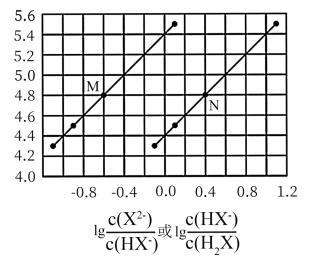
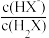 的变化关系
的变化关系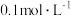 弱酸
弱酸 中滴加等浓度的
中滴加等浓度的 溶液,测得混合溶液中各物种的物质的量分数
溶液,测得混合溶液中各物种的物质的量分数 以及
以及 、
、 分别与
分别与 的关系如图所示。[比如
的关系如图所示。[比如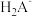 的物质的量分数:
的物质的量分数: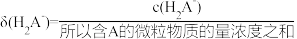 ]。
]。 、
、 。
。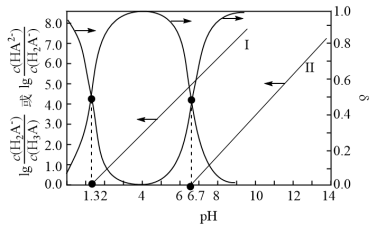
 时,
时,