天然气的主要成分为CH4,一般还含有C2H6等烃类,重要的燃料和化工原料。乙烷在一定条件可发生如下反应:C2H6(g)→C2H4(g)+H2(g) ∆H,相关物质的燃烧热数据如下表所示:
下列说法不正确的是
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热∆H/(kJ/mol) | -1560 | -1411 | -286 |
| A.燃烧热指在101kpa时,1mol纯物质完全燃烧生成指定产物时所放出的热量 |
| B.∆H=-137kJ/mol |
| C.提高该反应平衡转化率的方法有升高温度、减小压强 |
D.容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=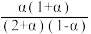 ×p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) ×p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) |
更新时间:2021/11/08 21:24:54
|
相似题推荐
多选题
|
适中
(0.65)
解题方法
【推荐1】CO、H2、C2H5OH三种物质燃烧的热化学方程式如下:
①CO(g)+1/2O2(g)=CO2(g) ΔH1=a kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH2=b kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=c kJ/mol
下列说法不正确的是
①CO(g)+1/2O2(g)=CO2(g) ΔH1=a kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH2=b kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=c kJ/mol
下列说法不正确的是
| A.ΔH1<0 |
| B.2CO(g)+4H2(g)=H2O(g)+C2H5OH(l) ΔH=(2a+4b-c) kJ/mol |
| C.CO2与H2合成C2H5OH反应的原子利用率为100% |
| D.2H2O(l)=2H2(g)+O2(g) ΔH=-2b kJ/mol |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐2】相同条件下,下列各组热化学方程式中△H1>△H2的是
A.C(s)+ O2(g)=CO(g) △H1;C(s)+O2(g)=CO2(g) △H2 O2(g)=CO(g) △H1;C(s)+O2(g)=CO2(g) △H2 |
B.2Al(s)+ O2(g)=Al2O3(s) △H1;2Fe(s)+ O2(g)=Al2O3(s) △H1;2Fe(s)+ O2(g)=Fe2O3(s) △H2 O2(g)=Fe2O3(s) △H2 |
| C.2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1;2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2 |
| D.NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g) △H1;CaO(s)+H2O(l)=Ca(OH)2(s) △H2 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐1】下列说法中正确的是( ΔH的绝对值均正确)
| A.热值指在一定条件下单位质量的物质完全燃烧所放出的热量,则CO热值为10.1kJ/g |
| B.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ/mol |
| C.C2H5OH的燃烧热C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1367.0kJ/mol |
| D.H2 + 1/2O2 = H2O △H=-241.8 kJ/mol |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】下列依据热化学方程式得出的结论正确的是
| A.S(g)+O2(g) =SO2(g) ΔH1;S(s)+O2(g) =SO2(g) ΔH2,则ΔH1<ΔH2 |
| B.已知C(石墨,s)⇌C(金刚石,s) △H= +1.9 kJ·mol−1,则石墨比金刚石稳定 |
| C.2C(s)+O2(g)=2CO(g) ΔH= −221 kJ·mol−1,则碳的燃烧热等于110.5 kJ·mol−1 |
| D.500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)⇌2NH3(g) ΔH= −38.6 kJ·mol−1 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐1】在一定条件下,下列叙述与图像对应正确的是
 |  |  |  |
| 图Ⅰ | 图Ⅱ | 图Ⅲ | 图Ⅳ |
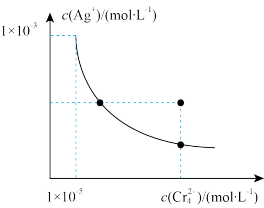
A.图Ⅰ表示T℃时, 在水溶液中的沉淀溶解平衡曲线, 在水溶液中的沉淀溶解平衡曲线, 的 的 为 为 |
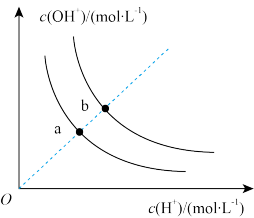
B.图Ⅱ表示不同温度下水中 和 和 的浓度变化曲线,图中a点对应温度低于b点 的浓度变化曲线,图中a点对应温度低于b点 |
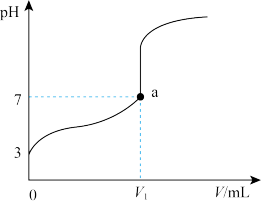
C.图Ⅲ表示某温度下向 溶液中逐滴加入NaOH溶液,该滴定过程宜选用甲基橙作指示剂 溶液中逐滴加入NaOH溶液,该滴定过程宜选用甲基橙作指示剂 |
D.图Ⅳ表示在一定温度下,改变起始时 对反应 对反应 的影响,a、b、c三点中,a点时 的影响,a、b、c三点中,a点时 的转化率最大 的转化率最大 |
您最近一年使用:0次
多选题
|
适中
(0.65)
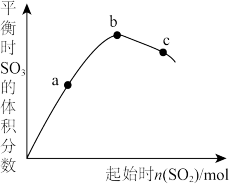
【推荐2】我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程,该反应经历了I、II、III三个过渡态。图中显示的是反应路径中每一阶段内各驻点的能量相对于此阶段内反应物能量的能量之差。下列说法正确的是
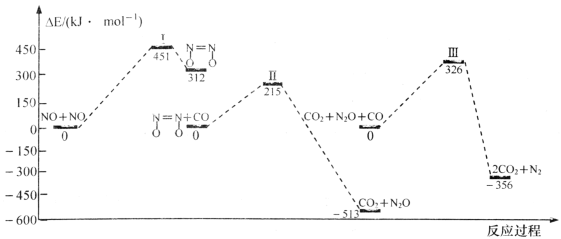

A.N2O比 更容易与CO发生反应 更容易与CO发生反应 |
| B.整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大 |
| C.2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H<0 |
| D.其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率 |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐3】某科研小组研究表明:臭氧-碱液法脱除废气中的NO是一种高效脱氮的方法,其中臭氧氧化步骤涉及的反应有:
①NO(g)+O3(g) NO2(g)+O2(g) ΔH<0
NO2(g)+O2(g) ΔH<0
②2NO(g)+O2(g) 2NO2(g) ΔH<0
2NO2(g) ΔH<0
③碱液吸收时发生反应2NO2+2NaOH=NaNO3+NaNO2+H2O
在某反应器中以固定速率通入NO和O3,分别在催化剂Ⅰ、催化剂Ⅱ作用下发生上述反应,相同时间内测得O3的转化率与温度的关系如图所示。

下列说法错误的是
①NO(g)+O3(g)
 NO2(g)+O2(g) ΔH<0
NO2(g)+O2(g) ΔH<0②2NO(g)+O2(g)
 2NO2(g) ΔH<0
2NO2(g) ΔH<0 ③碱液吸收时发生反应2NO2+2NaOH=NaNO3+NaNO2+H2O
在某反应器中以固定速率通入NO和O3,分别在催化剂Ⅰ、催化剂Ⅱ作用下发生上述反应,相同时间内测得O3的转化率与温度的关系如图所示。

下列说法错误的是
| A.反应①的平衡常数:K(M)>K(N) |
| B.在T1 ℃、催化剂Ⅱ作用下,O3的平衡转化率为a% |
| C.催化剂Ⅰ的催化效果比催化剂Ⅱ的好 |
D.若n(NO2)∶n(NaOH)=1∶1充分反应,所得溶液中存在c(Na+)<c(NO )+c(OH-)+c(NO )+c(OH-)+c(NO ) ) |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐1】温度为T1时,在三个容积均为1 L的恒容密闭容器中均发生反应:
2NO2(g) 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
下列说法正确的是
2NO2(g)
 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
| A.容器Ⅱ达到平衡前v正>v逆 |
| B.达到平衡时,容器Ⅲ中NO的体积分数大于50% |
C.设K为该反应的化学平衡常数,则有K=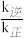 |
D.当温度改变为T2时,若T2>T1,则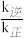 <1.25 <1.25 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐2】在160℃、200℃条件下,分别向两个容积为2L的刚性容器中充入2molCO(g)和2molN2O(g),发生反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH<0。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是
CO2(g)+N2(g) ΔH<0。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是
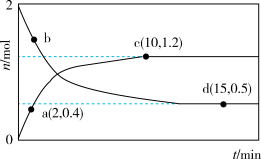
 CO2(g)+N2(g) ΔH<0。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是
CO2(g)+N2(g) ΔH<0。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是
| A.CO的转化率:d﹥c |
| B.ac段N2的平均反应速率为0.10mol/(L·min) |
| C.该反应达到平衡状态时c(CO)+c(CO2)=2mol/L |
| D.200℃时,该反应的平衡常数Kc=2.25 |
您最近一年使用:0次

 )在太阳能作用下将
)在太阳能作用下将 、
、 转变成
转变成 、CO,其过程如下:
、CO,其过程如下: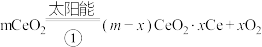 ;
;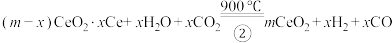 。下列说法不正确的是
。下列说法不正确的是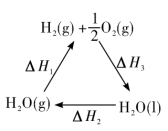
 变成
变成 是熵增的过程
是熵增的过程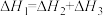
 的反应热小于
的反应热小于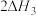
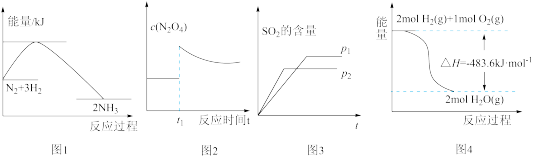
 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 和
和 ,发生下述反应:
,发生下述反应: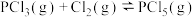 ,10min后达到平衡,
,10min后达到平衡, 为0.4mol。下列说法正确的是
为0.4mol。下列说法正确的是 表示的平均反应速率为
表示的平均反应速率为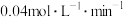
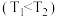 ,反应的平衡常数减小,则平衡时
,反应的平衡常数减小,则平衡时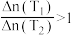
 和
和 ,在相同温度下达到平衡时
,在相同温度下达到平衡时

