 排放量增速趋缓。我国力争2030年前实现碳达峰,2060年前实现碳中和。综合利用
排放量增速趋缓。我国力争2030年前实现碳达峰,2060年前实现碳中和。综合利用 是实现目标的有效途径。
是实现目标的有效途径。(1)工业上常将
 转化为有机物实现碳循环。方法如下:
转化为有机物实现碳循环。方法如下: ;
; 。
。已知
 ,其正反应的活化能为
,其正反应的活化能为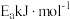 ,则逆反应的活化能为
,则逆反应的活化能为(2)工业上常用反应ⅰ:

制取甲醇(CH3OH),其中的原料气

常用反应ⅱ:
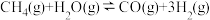 来制备。
来制备。①已知
 ,写出表示
,写出表示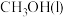 燃烧热的热化学议程为
燃烧热的热化学议程为②在T℃时的10L密闭容器中,充入
 和
和 发生反应ⅱ,经过5min达到平衡,此时
发生反应ⅱ,经过5min达到平衡,此时 的转化率为50%,则从开始到平衡,
的转化率为50%,则从开始到平衡, 的平均反应速率为
的平均反应速率为 、
、 、
、 、和
、和 发生反应ⅱ,若温度仍为T℃,此时v正
发生反应ⅱ,若温度仍为T℃,此时v正③若某温度下,将
 和
和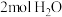 通入压强为200kPa的恒压密闭容器中发生反应ⅱ,正反应速率v正=k正×P(CH4)×P(H2O),逆反应速率v逆=k逆×P(CO)×P3(H2),P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=
通入压强为200kPa的恒压密闭容器中发生反应ⅱ,正反应速率v正=k正×P(CH4)×P(H2O),逆反应速率v逆=k逆×P(CO)×P3(H2),P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp= ,当
,当 消耗20%时,v正=
消耗20%时,v正=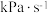 (保留两位有效数字)
(保留两位有效数字)
相似题推荐
【推荐1】油气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。
I.已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ∆H1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ∆H2
③2H2(g)+O2(g)=2H2O(g) ∆H3
④2H2S(g)=S2(g)+2H2(g) ∆H4
(1)∆H4=
(2)已知∆H4>0,
A.低温 B.高温
(3)处理H2S普遍采用的方法是克劳斯工艺,即利用反应①和②生成S2;另一种方法是利用反应④分解H2S。相比克劳斯工艺,分解法的优点是
II.在1373K、100 kPa下,分别将n(H2S):n(Ar)为4:1、1:1、1:4、1:9的H2S-Ar混合气体置于密闭容器中发生反应④,反应过程中H2S转化率随时间的变化如下图所示:
(4)n(H2S):n(Ar)=1:9对应图中曲线
A.a B.b C.c D.d
(5)n(H2S):n(Ar)=1:4的混合气体投料后,若将温度升高至1473K,达到平衡时混合气体中H2S与H2的分压相等,H2S平衡转化率为
III.在真空克劳斯法脱硫中,用K2CO3溶液吸收H2S。
电离平衡常数 | H2CO3 | H2S |
K1 | 4.2×10-7 | 5.6×10-8 |
K2 | 5.6×10-11 | 1.2×10-15 |
(6)下列关于K2CO3溶液中微粒关系正确的是___________。
A.c(OH-)>c(HCO ) ) | B.c(H+)>c(HCO ) ) |
C.c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) | D.2c(K+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
(7)K2CO3溶液吸收少量H2S的离子方程式为
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=
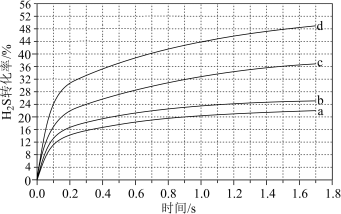
(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5CO⇌Fe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。
①T1
②T2温度下,上述反应的平衡常数K=
(3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。
①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为
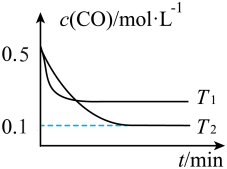
②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示。
向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为
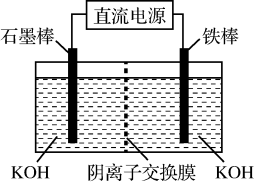
(4)电解法可制得K2FeO4,装置如图所示。阳极的电极反应式为
(1)已知:①C2H4(g)+H2O(g) = C2H5OH(g) △H1=-a kJ•mol−1
②2CH3OH(g) = CH3OCH3(g) +H2O(g) △H2=-b kJ•mol−1
③C2H5OH(g) = CH3OCH3(g) △H3=+c kJ•mol−1
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:
(2)若在体积为
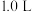 的恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)
的恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),二氧化碳的平衡转化率和温度的关系如下图A曲线所示。
CH3OH(g)+H2O(g),二氧化碳的平衡转化率和温度的关系如下图A曲线所示。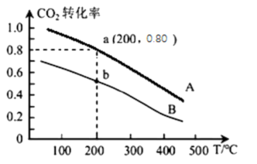
① 下列有关说法正确的是
A.该反应为放热反应
B.B平衡曲线相对于A平衡曲线改变的条件为减小了容器的体积
C.当v正(CO2)=3 v逆(H2),该反应达到平衡状态
D.容器内压强和混合气体平均相对分子质量不变,均可以说明该反应达到平衡状态
② 计算a点该反应的化学平衡常数K=
(3)若在T2℃、10 MPa条件下,往一密闭容器通入CO和H2合成甲醇[其中n(CO):n(H2)=1:2],其反应为:CO(g)+2H2(g)
 CH3OH(g),测得容器内总压强与反应时间的关系如图所示。
CH3OH(g),测得容器内总压强与反应时间的关系如图所示。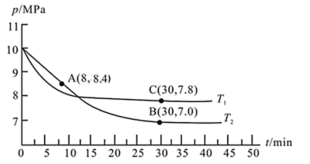
①T1
②在其他条件不变的情况下,测得T1℃时压强的变化曲线如图所示,则C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系:vC(正)
③图中B点的压强平衡常数Kp=
(1)汽车尾气是雾霾形成的原因之一、研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:




根据图示判断提高脱硝效率的最佳条件是

(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH>0在T1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
N2(g)+CO2(g) ΔH>0在T1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
①根据图表数据分析不T1℃时,该反应在0~20min的平均反应速率
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
F.适当升高温度
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应:
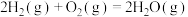 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为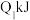 、
、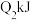 、
、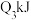 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为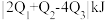 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: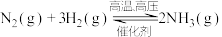 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为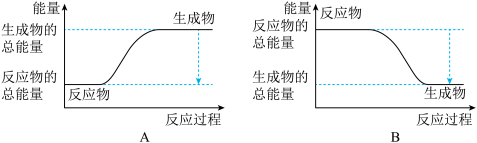
(2)反应
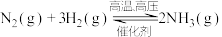 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| ② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| ③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.15 | 0.15 | 0.15 | 0.15 |
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
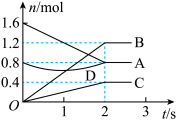
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为
(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术:
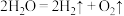 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为
 ,则A极是电池的
,则A极是电池的②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式
(1)为比较
 、
、 对
对 分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察
分解的催化效果,某实验小组同学设计了如图所示的实验。通过观察 、
、 的催化效果的差异。有同学提出将
的催化效果的差异。有同学提出将 溶液改为
溶液改为 溶液更合理,其理由是
溶液更合理,其理由是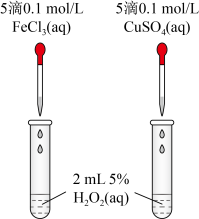
 和
和 (草酸)反应速率的影响,设计实验方案如下:
(草酸)反应速率的影响,设计实验方案如下:实验序号 | 草酸溶液 | 酸性高锰酸钾溶液 |
① |
|
|
② |
|
|
(3)工业制硫酸的反应之一为
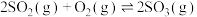 ,在2L恒温恒容密闭容器中投入2mol
,在2L恒温恒容密闭容器中投入2mol 和1mol
和1mol 在一定条件下充分反应,下图是
在一定条件下充分反应,下图是 和
和 随时间的变化曲线。
随时间的变化曲线。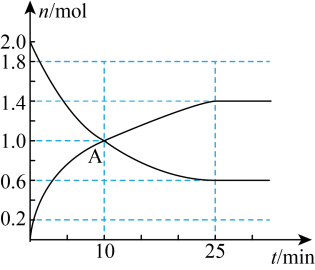
 的平均反应速率为
的平均反应速率为(2)A点的

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)微生物作用下,废水中的
 可转化为
可转化为 ,该反应分两步反应:
,该反应分两步反应:Ⅰ:

Ⅱ:
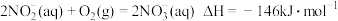
则低浓度氨氮废水中的
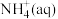 氧化生成
氧化生成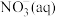 的热化学方程式为
的热化学方程式为(2)在容积固定的密闭容器中,通入一定量的
 ,发生反应
,发生反应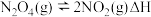 ,随温度升高,混合气体的颜色变深。
,随温度升高,混合气体的颜色变深。①温度T时反应达平衡,混合气体平衡总压强为
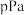 ,
, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应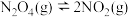 的平衡常数
的平衡常数
 值将
值将②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向
 和
和 都能合成甲醇,同时有利于减少二氧化碳的排放。已知在一定温度和压强下,发生如下反应:
都能合成甲醇,同时有利于减少二氧化碳的排放。已知在一定温度和压强下,发生如下反应:
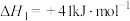

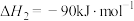
(1)则反应


(2)利用反应
 合成甲醇。T℃时向固定容积的密闭容器中充入CO、H2,反应到t时刻测得各组分的浓度如下:
合成甲醇。T℃时向固定容积的密闭容器中充入CO、H2,反应到t时刻测得各组分的浓度如下:| 物质 |  |  |  |  |
浓度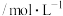 | 0.60 | 0.40 | 1.20 | 1.20 |
 ,比较t时刻正、逆反应速率的大小:v正
,比较t时刻正、逆反应速率的大小:v正(3)向1L的恒容密闭容器中按物质的量之比1∶2充入一定量CO和
 ,在催化剂的作用下合成甲醇,测得平衡时混合物中
,在催化剂的作用下合成甲醇,测得平衡时混合物中 的体积分数在不同压强下随温度的变化如图甲所示。(已知
的体积分数在不同压强下随温度的变化如图甲所示。(已知 时最初充入1mol CO。)
时最初充入1mol CO。)
①下列说法正确的是
A.该反应的
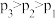
B.反应速率:
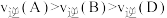
C.A、B、C的平衡常数大小:
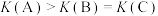
D.在压强为
 下,反应经过5min达到B点的平衡状态,则
下,反应经过5min达到B点的平衡状态,则
②D点时反应
 的平衡常数K=
的平衡常数K=(4)T℃时向恒容密闭容器中充入
 和
和 ,发生反应
,发生反应 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:
①c点转化率比a点低的原因是
②下列措施有利于提高
 转化为
转化为 的平衡转化率的有
的平衡转化率的有A.恒容条件下充入稀有气体He
B.在达到平衡后的体系中移出部分甲醇
C.保持反应容器的体积不变,平衡时再按照原投料比投入一定量的原料
D.选择催化效率更高的催化剂
③维持温度
 足够长时间,则
足够长时间,则 的转化率
的转化率(1)热分解法制氢。某温度,H2O(g)
 H2(g)+1/2O2(g)。该反应平衡常数表达式K=
H2(g)+1/2O2(g)。该反应平衡常数表达式K=(2)热化学循环制氢。制备H2的反应步骤如下:
①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1
②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1
③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1
④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1
则 H2O(g)
 H2(g)+1/2O2(g) ΔH =
H2(g)+1/2O2(g) ΔH =(3)光电化学分解制氢,钛酸锶光电极:4OH--4e-
 O2+2H2O,则铂电极的电极反应为
O2+2H2O,则铂电极的电极反应为
(4)水煤气法制氢。CO(g) + H2O(g)
 CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。① 若升高温度到950℃时,达到平衡时K
② 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
(5)甲烷制氢。将1.0 mol CH4和2.0 mol H2O (g)通入容积为100 L的反应室,在一定条件下发生反应:CH4(g) + H2O (g)=CO (g) + 3H2(g)。测得达到平衡所需的时间为5 min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质。该反应的化学方程式为
| 化学反应 | 平衡常数 | 温度/K | ||
| 770 | 970 | 1070 | ||
| ①2H2(g)+CO(g)⇌CH3OH(g) ΔH1 | K1 | 2.5 | 0.5 | 0.2 |
| ②H2(g)+CO2(g)⇌H2O(g)+CO(g) ΔH2 | K2 | 1.2 | 1.7 | 2.5 |
| ③CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3 | K3 | m | n | q |
(1)根据表格中K2的数据可知,ΔH2
(2)m=
(3)T1K下,将6molCO2和8molH2充入一容积为2L的恒容密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得H2的物质的量浓度随时间的变化如下图所示。请回答下列问题:

①T1=
②生产中,欲提高CH3OH的平衡产率可采取的措施有
③下列叙述能说明该反应达到平衡的是
a.容器内压强不再改变
b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变
d.容器内各物质的物质的量相等
(4)用电解法可将CO2转化为多种原料,原理如图。

若铜电极上只产生C2H4和CO气体,写出产生C2H4的电极反应式

(1)写出图1中岩溶的化学方程式:
(2)CO2是引起温室效应的主要物质,可用于生产甲醇。在恒容的密闭容器中,通入1molCO2和1.5molH2,发生的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H<0,测得CO2的转化率随温度和压强的变化如图2。
CH3OH(g)+H2O(g)△H<0,测得CO2的转化率随温度和压强的变化如图2。①X代表的物理量是
②Y1
③保持温度不变,反应达到平衡后,测得气体压强p为起始压强p0的0.8倍,则反应平衡常数KP=
(3)已知常温下,H2CO3的电离平衡常数:K1=4.4×10-7、K2=4.7×10-11,则CO
 +H2O
+H2O HCO
HCO +OH-的平衡常数K=
+OH-的平衡常数K=时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
⑴在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
⑵此条件下该反应的化学平衡常数的值约为
⑶若达到平衡后,降低温度,气体颜色会变浅,则该反应的平衡常数将
⑷若在相同情况下最初向该容器中充入的是N2O4气体,要达到初始数据表中同样的平衡状态,N2O4的起始浓度是
⑸计算⑷中条件下达到平衡后N2O4的转化率

 、20mL
、20mL 、30mL
、30mL 、20mL
、20mL

