常温下,有以下五种溶液:
请回答以下问题:
(1)向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①_______ (填“>”、“<”或“=”)v②,若收集等体积的 ,则消耗时间更短的是
,则消耗时间更短的是_______ (填化学式),醋酸和锌反应的离子方程式为_______ 。
(2)若向⑤溶液中加入少量④,⑤的 将
将_______ (填“增大”、“减小”或“不变”,下同);若加入少量②,⑤的水解程度将_______ 。
(3)将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的 由大到小的顺序是
由大到小的顺序是_______ (填编号)。
(4)分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是_______ (填化学名称)。
(5)将等体积的①和②溶液混合后,加入 蒸馏水,溶液中
蒸馏水,溶液中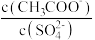 将
将_______ (填“增大”、“减小”或“不变”)。
(6)①,②,③,④,⑤五种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是_______ (填编号)。
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | 醋酸 | 硫酸 | 氨水 | 氢氧化钠 | 氯化铵 |
 | 3 | 3 | 11 | 11 | 3 |
(1)向等体积的①和②溶液中分别加入形状、大小一样的锌块(足量),反应一段时间后的速率v①
 ,则消耗时间更短的是
,则消耗时间更短的是(2)若向⑤溶液中加入少量④,⑤的
 将
将(3)将等体积的①,②,③,④溶液分别加水稀释至原来的100倍,溶液的
 由大到小的顺序是
由大到小的顺序是(4)分别向等体积的③和④溶液中加入②至恰好完全反应,消耗②更多的是
(5)将等体积的①和②溶液混合后,加入
 蒸馏水,溶液中
蒸馏水,溶液中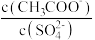 将
将(6)①,②,③,④,⑤五种溶液中由水电离出的
 浓度由大到小的顺序是
浓度由大到小的顺序是
更新时间:2022-01-15 21:56:46
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】25℃时,往25 mL氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如图所示:
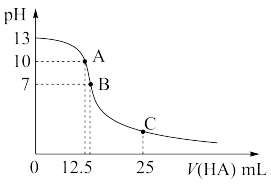
(1)该氢氧化钠溶液的物质的量浓度为________________ mol/L-1。
(2)A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出 的c(OH-)=______ mol/L-1。
(3)在B点所得混合溶液中,c(Na+)、c(A-)、c(H+)、c(OH-)由大到小的顺序是__________ 。
(4)在C点所得混合溶液中,下列说法正确的是____________ (填字母序号)。
A.HA的电高程度大于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(Na+)+ c(H+)= c(A-)+c(OH-)
D.c(HA)+ c(A-)=0.2 mol·L-1

(1)该氢氧化钠溶液的物质的量浓度为
(2)A点对应酸的体积为12.5mL,则所得混合溶液中
(3)在B点所得混合溶液中,c(Na+)、c(A-)、c(H+)、c(OH-)由大到小的顺序是
(4)在C点所得混合溶液中,下列说法正确的是
A.HA的电高程度大于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(Na+)+ c(H+)= c(A-)+c(OH-)
D.c(HA)+ c(A-)=0.2 mol·L-1
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ι.(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中由水电离出的c(H+)=10-9 mol·L-1,则该电解质可能是____ (填序号)。
A.CuSO4 B. Na2CO3 C.HCl D.NaOH E.K2SO4
(2)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①c(OH-)=1.0×10-3 mol·L-1的氨水b L;
②浓度为1.0×10-3 mol·L-1的氨水c L;
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d之间的关系是____ 。
Ⅱ. N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10ˉ6,则0.01 mol·Lˉ1 N2H4水溶液的pH约等于________ (忽略N2H4的二级电离和H2O的电离)。
III.已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)该溶液的pH=________ 。
(2)升高温度时,K将________ (填“增大”、“减小”或“不变”),pH将________ (填“增大”、“减小”或“不变”)。
(3)由HA电离出的c(H+)约为水电离出的c(H+)的________ 倍。
A.CuSO4 B. Na2CO3 C.HCl D.NaOH E.K2SO4
(2)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
①c(OH-)=1.0×10-3 mol·L-1的氨水b L;
②浓度为1.0×10-3 mol·L-1的氨水c L;
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d之间的关系是
Ⅱ. N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10ˉ6,则0.01 mol·Lˉ1 N2H4水溶液的pH约等于
III.已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)该溶液的pH=
(2)升高温度时,K将
(3)由HA电离出的c(H+)约为水电离出的c(H+)的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】温度为t℃时,某NaOH稀溶液中c(H+)=10 -amol·L -1,c(OH -)=10 -bmol·L -1;已知:a+b=13,请回答下列问题:
(1)该温度下水的离子积常数Kw=_______ ,t_______ (填“<”、“>”或“=”)25。
(2)该NaOH溶液中NaOH的物质的量浓度为_______ ,该NaOH溶液中由水电离出的c(OH-)为_______ 。
(3)回答下列有关醋酸的问题。在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示:
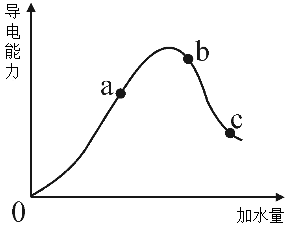
a、b、c三点醋酸电离程度由大到小的顺序为_______ ;a、b、c三点对应的溶液中,pH最小的是_______ ;a、b、c三点对应的溶液中,水的电离程度最大的是_______ 。
(1)该温度下水的离子积常数Kw=
(2)该NaOH溶液中NaOH的物质的量浓度为
(3)回答下列有关醋酸的问题。在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示:

a、b、c三点醋酸电离程度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)常温下,将m mol·L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合后,溶液的pH=7,则m与n的大小关系是m____ n(填“>”、“<”或“=”,下同),原酸中c(H+)与碱中c(OH-)的大小关系是c(H+)____ c(OH-)。
(2)常温下,将浓度均为0.1mol·L-1的CH3COONa、CH3COOH溶液等体积混合后,溶液呈酸性。则混合溶液中各离子浓度由大到小排序为_____ 。关于该混合溶液的说法不正确的是___ (填代号)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
b.此溶液一定有c(Na+)=c(CH3COOH)+c(CH3COO-)
c.此溶液中水的电离程度一定大于纯水的电离程度
d.向此溶液中加少量氢氧化钠或盐酸,溶液pH变化不大
(3)用0.1000 mol·L-1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,滴定曲线如右图所示。其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。列式并计算醋酸的电离常数_____ ,CH3COOH的物质的量浓度为____ mol·L-1。
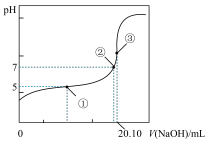
(1)常温下,将m mol·L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合后,溶液的pH=7,则m与n的大小关系是m
(2)常温下,将浓度均为0.1mol·L-1的CH3COONa、CH3COOH溶液等体积混合后,溶液呈酸性。则混合溶液中各离子浓度由大到小排序为
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
b.此溶液一定有c(Na+)=c(CH3COOH)+c(CH3COO-)
c.此溶液中水的电离程度一定大于纯水的电离程度
d.向此溶液中加少量氢氧化钠或盐酸,溶液pH变化不大
(3)用0.1000 mol·L-1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,滴定曲线如右图所示。其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。列式并计算醋酸的电离常数

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知水的电离平衡曲线如图示,试回答下列问题:
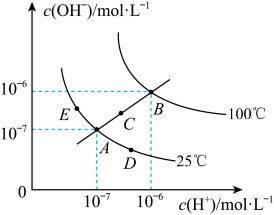
(1)图中A、B、C三点Kw的由小到大的顺序是_____________ 。
(2)若从A点到B点,可采用的措施是___ 。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=13的NaOH溶液与pH=2的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____ 。
(4)B对应温度下,将pH=11的苛性钠溶液V1L与0.05 mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=_________________ 。
(5) A对应温度下,将V mL、0.1000 mol·L-1 氢氧化钠溶液逐滴加入到20.00mL、0.1000 mol·L-1醋酸溶液中充分反应。如果溶液pH=7,此时V的取值_______ 20.00(填“>”“<”或“=”)。

(1)图中A、B、C三点Kw的由小到大的顺序是
(2)若从A点到B点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=13的NaOH溶液与pH=2的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)B对应温度下,将pH=11的苛性钠溶液V1L与0.05 mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=
(5) A对应温度下,将V mL、0.1000 mol·L-1 氢氧化钠溶液逐滴加入到20.00mL、0.1000 mol·L-1醋酸溶液中充分反应。如果溶液pH=7,此时V的取值
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】下表为四种弱酸的电离平衡常数:
回答下列问题:
(1) 、
、 、
、 、
、 结合质子(
结合质子( )的能力由大到小的顺序为
)的能力由大到小的顺序为___________ 。
(2) 通入
通入 溶液中能否生成
溶液中能否生成 ?
?___________ (填“是”或“否”)。
(3)少量 通入足量
通入足量 溶液中发生反应的离子方程式为
溶液中发生反应的离子方程式为___________ 。
(4)常温下,向

 溶液和
溶液和

 溶液中分别加入足量的锌粉。
溶液中分别加入足量的锌粉。
①反应开始时,产生 的速率:
的速率:
___________  (填“>”、“<”或“=”,下同);
(填“>”、“<”或“=”,下同);
②充分反应后,两溶液中生成 的体积
的体积
___________  。
。
(5)25℃,向 溶液中加入一定量的
溶液中加入一定量的 ,所得溶液的
,所得溶液的 ,则混合液中
,则混合液中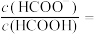
___________ 。
| 弱酸 |  |  |  |  |
电离常数( ) ) | 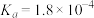 | 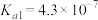 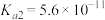 | 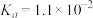 | 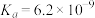 |
(1)
 、
、 、
、 、
、 结合质子(
结合质子( )的能力由大到小的顺序为
)的能力由大到小的顺序为(2)
 通入
通入 溶液中能否生成
溶液中能否生成 ?
?(3)少量
 通入足量
通入足量 溶液中发生反应的离子方程式为
溶液中发生反应的离子方程式为(4)常温下,向


 溶液和
溶液和

 溶液中分别加入足量的锌粉。
溶液中分别加入足量的锌粉。①反应开始时,产生
 的速率:
的速率:
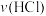 (填“>”、“<”或“=”,下同);
(填“>”、“<”或“=”,下同);②充分反应后,两溶液中生成
 的体积
的体积
 。
。(5)25℃,向
 溶液中加入一定量的
溶液中加入一定量的 ,所得溶液的
,所得溶液的 ,则混合液中
,则混合液中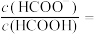
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向________ (填“正”或“逆”)反应方向移动;溶液中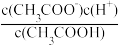 的值
的值________ (填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol·L-1;
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________ 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________ 性,NH4HCO3溶液中物质的量浓度最大的离子是________ (填化学式)。
(3)99 ℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________ 。
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=__________ 。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________ 。
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________ 。
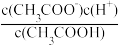 的值
的值(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol·L-1;
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈
(3)99 ℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)某浓度的氨水中存在平衡: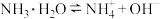 。若要增大
。若要增大 的浓度而不增大
的浓度而不增大 的浓度,应采取的措施是
的浓度,应采取的措施是______ (填字母)。
a.适当升高温度 b.加入 固体 c.通入
固体 c.通入 d.加入少量浓盐酸
d.加入少量浓盐酸
(2)常温下,有 相同、体积相同的醋酸和盐酸两种溶液。
相同、体积相同的醋酸和盐酸两种溶液。
①加适量醋酸钠晶体后,醋酸溶液中
______ (填“增大”“减小”或“不变”,下同),盐酸中
______ 。
②加水稀释10倍后,溶液中 :醋酸
:醋酸______ (填“>”“=”或“<”)盐酸。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸______ (填“>”“=”或“<”)盐酸。
④溶液温度都升高20℃,溶液中 :醋酸
:醋酸______ (填“>”“=”或“<”)盐酸。
⑤分别与足量的锌粉发生反应,下列关于氢气体积( )随时间(
)随时间( )变化的示意图正确的是
)变化的示意图正确的是______ (填字母)。(①表示盐酸,②表示醋酸)
a. b.
b. c.
c.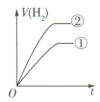 d.
d.
(3)将 的
的 加水稀释,有关稀释后醋酸溶液的说法正确的是
加水稀释,有关稀释后醋酸溶液的说法正确的是______ (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
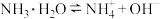 。若要增大
。若要增大 的浓度而不增大
的浓度而不增大 的浓度,应采取的措施是
的浓度,应采取的措施是a.适当升高温度 b.加入
 固体 c.通入
固体 c.通入 d.加入少量浓盐酸
d.加入少量浓盐酸(2)常温下,有
 相同、体积相同的醋酸和盐酸两种溶液。
相同、体积相同的醋酸和盐酸两种溶液。①加适量醋酸钠晶体后,醋酸溶液中


②加水稀释10倍后,溶液中
 :醋酸
:醋酸③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
④溶液温度都升高20℃,溶液中
 :醋酸
:醋酸⑤分别与足量的锌粉发生反应,下列关于氢气体积(
 )随时间(
)随时间( )变化的示意图正确的是
)变化的示意图正确的是a.
 b.
b. c.
c. d.
d.
(3)将
 的
的 加水稀释,有关稀释后醋酸溶液的说法正确的是
加水稀释,有关稀释后醋酸溶液的说法正确的是a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某温度下,部分酸的电离平衡常数如下表:
(1)在温度相同时,各酸的Ka值与酸性的相对强弱的关系为_______ 。
(2)室温下①0.1 mol·L-1 HCOONa、②0.1 mol·L-1 NaClO、③0.1 mol·L-1 Na2CO3、④0.1 mol·L-1 NaHCO3溶液中pH由大到小的顺序为_______ 。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为_______ 。
(4)下列离子方程式正确的是_______ (填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为_______ 。
| 酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各酸的Ka值与酸性的相对强弱的关系为
(2)室温下①0.1 mol·L-1 HCOONa、②0.1 mol·L-1 NaClO、③0.1 mol·L-1 Na2CO3、④0.1 mol·L-1 NaHCO3溶液中pH由大到小的顺序为
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO
 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为(4)下列离子方程式正确的是
a.2ClO-+H2O+CO2=2HClO+CO

b.2HCOOH+CO
 =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑c.H2SO3+2HCOO-=2HCOOH+SO

(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】利用所学化学反应原理,解决以下问题:
(1) 可做净水剂,其原理是
可做净水剂,其原理是_______ (用离子方程式表示)。
(2) 溶液蒸干并灼烧得到的固体物质是
溶液蒸干并灼烧得到的固体物质是_______ (填化学式)。
(3)物质的量相同的下列四种溶液:① ②
② ③
③ ④氨水,
④氨水, 。由大到小的顺序是
。由大到小的顺序是_______ 。
(4)物质的量浓度为 的下列物质:a.
的下列物质:a. 、b.
、b. 、c.
、c. 、d.
、d. ;
; 由大到小的顺序是:
由大到小的顺序是:_______ (填编号)。
(5)常温下,1体积 和2体积
和2体积 的
的 溶液混合后,溶液
溶液混合后,溶液 ,则二者物质的量浓度之比为
,则二者物质的量浓度之比为_______ 。
(6)常温下两种溶液:a. 的
的 b.
b. 的盐酸,其中水电离出的
的盐酸,其中水电离出的 之比为
之比为_______ 。
(7)泡沫灭火器灭火原理:_______ 。(用离子方程式表示)
(8)25℃时, 相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的
相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的 仍相同,则m
仍相同,则m_______ n。(填“>”、“<”或“=”)
(1)
 可做净水剂,其原理是
可做净水剂,其原理是(2)
 溶液蒸干并灼烧得到的固体物质是
溶液蒸干并灼烧得到的固体物质是(3)物质的量相同的下列四种溶液:①
 ②
② ③
③ ④氨水,
④氨水, 。由大到小的顺序是
。由大到小的顺序是(4)物质的量浓度为
 的下列物质:a.
的下列物质:a. 、b.
、b. 、c.
、c. 、d.
、d. ;
; 由大到小的顺序是:
由大到小的顺序是:(5)常温下,1体积
 和2体积
和2体积 的
的 溶液混合后,溶液
溶液混合后,溶液 ,则二者物质的量浓度之比为
,则二者物质的量浓度之比为(6)常温下两种溶液:a.
 的
的 b.
b. 的盐酸,其中水电离出的
的盐酸,其中水电离出的 之比为
之比为(7)泡沫灭火器灭火原理:
(8)25℃时,
 相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的
相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的 仍相同,则m
仍相同,则m
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】电离平衡常数是衡量弱电电解质电离程度的量。已知部分物质的电离平衡常数如下表数据所示(25℃):
(1)25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为_______ (填字母)。
(2)25°C时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______ 。
(3)现有浓度为0.02mol/L的HCN与0.01mol/L的NaOH等体积混合后测得c(Na+)>c(CN-),下列关系正确的是_______ (填字母)。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)浓Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子方程式表示其灭火原理:_______ 。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小顺序:___ ;该溶液中的电荷守恒表达式为___ 。
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.9×10-7 K2=4.7×10-11 |
(2)25°C时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(3)现有浓度为0.02mol/L的HCN与0.01mol/L的NaOH等体积混合后测得c(Na+)>c(CN-),下列关系正确的是
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)浓Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子方程式表示其灭火原理:
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小顺序:
您最近一年使用:0次

 的
的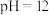 的NaOH溶液等体积混合
的NaOH溶液等体积混合

