氮氧化物的排放是造成大气污染的原因之一,消除氮氧化物的污染对生态文明建设具有重要意义,回答下列问题:
(1)①
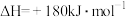
②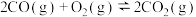
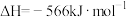
则相同条件下

___________  。
。
(2)一定温度下,将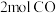 、
、 充入恒压密闭容器中发生反应
充入恒压密闭容器中发生反应 。已知起始压强为10MPa,10min时反应达到平衡状态,测得
。已知起始压强为10MPa,10min时反应达到平衡状态,测得 的物质的量为0.5mol,则:
的物质的量为0.5mol,则:
①0~10min内,平均反应速率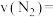
___________  (保留2位小数)。
(保留2位小数)。
②此反应的平衡常数
___________ ( 是以物质的量分数表示的平衡常数)。
是以物质的量分数表示的平衡常数)。
③该条件下,可判断此反应达到平衡状态的标志是___________ 。
A.单位时间内, 断裂
断裂 同时形成
同时形成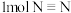
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.CO与NO的转化率比值不再改变
④若此时再向容器中充入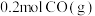 和
和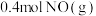 ,达到新平衡时NO的转化率将
,达到新平衡时NO的转化率将___________ (填“增大”“减小”或“不变”)。
(3)为探究温度及不同催化剂对反应 的影响,保持其它初始条件不变,分别在不同催化剂(M、N)、不同温度下,测得相同时间内NO转化率与温度的关系如图所示:
的影响,保持其它初始条件不变,分别在不同催化剂(M、N)、不同温度下,测得相同时间内NO转化率与温度的关系如图所示:
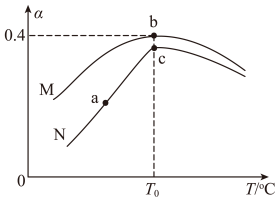
图中c点对应的速率
___________  (填“>”、“<”或“=”),其理由为
(填“>”、“<”或“=”),其理由为___________ 。
(1)①

②
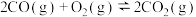
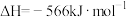
则相同条件下


 。
。(2)一定温度下,将
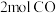 、
、 充入恒压密闭容器中发生反应
充入恒压密闭容器中发生反应 。已知起始压强为10MPa,10min时反应达到平衡状态,测得
。已知起始压强为10MPa,10min时反应达到平衡状态,测得 的物质的量为0.5mol,则:
的物质的量为0.5mol,则:①0~10min内,平均反应速率
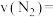
 (保留2位小数)。
(保留2位小数)。②此反应的平衡常数

 是以物质的量分数表示的平衡常数)。
是以物质的量分数表示的平衡常数)。③该条件下,可判断此反应达到平衡状态的标志是
A.单位时间内,
 断裂
断裂 同时形成
同时形成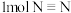
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.CO与NO的转化率比值不再改变
④若此时再向容器中充入
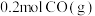 和
和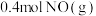 ,达到新平衡时NO的转化率将
,达到新平衡时NO的转化率将(3)为探究温度及不同催化剂对反应
 的影响,保持其它初始条件不变,分别在不同催化剂(M、N)、不同温度下,测得相同时间内NO转化率与温度的关系如图所示:
的影响,保持其它初始条件不变,分别在不同催化剂(M、N)、不同温度下,测得相同时间内NO转化率与温度的关系如图所示:
图中c点对应的速率

 (填“>”、“<”或“=”),其理由为
(填“>”、“<”或“=”),其理由为
更新时间:2022-01-21 10:27:11
|
相似题推荐
【推荐1】 肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
①工业上合成氨的反应N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=____ kJ·mol-1
②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是____ 。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式____ 。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;
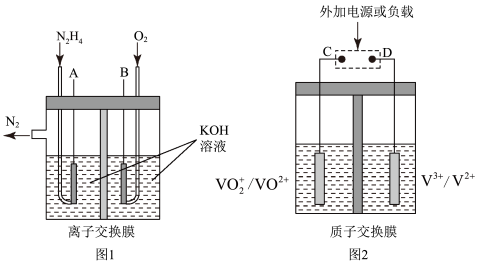
①肼-空气燃料电池的负极反应式为____ 。
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式____ 。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是____ 。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
| 化学键 | H—H | N≡N | N—H |
| 键能/kJ·molˉ1 | a | b | c |
 2NH3(g) ΔH=
2NH3(g) ΔH=②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是
您最近一年使用:0次
【推荐2】合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)如图所示为利用 和空气中的
和空气中的 以
以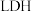 超薄纳米为催化剂在光催化作用下合成氨的原理。
超薄纳米为催化剂在光催化作用下合成氨的原理。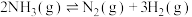

Ⅱ.
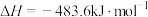
则上述合成氨的热化学方程式为___________ 。
(2)合成尿素 的反应为
的反应为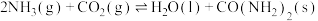
 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示。
的转化率随时间的变化情况如图所示。 的浓度变化表示反应速率,则
的浓度变化表示反应速率,则 点的逆反应速率
点的逆反应速率___________ B点的正反应速率(填“>”“<”或“=”)。
②下列叙述中不能说明该反应达到平衡状态的是___________ (填序号)。
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C. 的消耗速率和
的消耗速率和 的消耗速率之比为
的消耗速率之比为
D.固体质量不再发生变化
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量 。实验发现,
。实验发现, 易发生二聚反应
易发生二聚反应 并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为
并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为 和
和 时NO的转化率随时间变化的结果如图所示。
时NO的转化率随时间变化的结果如图所示。 时,达到平衡时体系的总压强为
时,达到平衡时体系的总压强为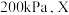 点
点 的物质的量分数为
的物质的量分数为___________ (保留三位有效数字), 点对应的平衡常数
点对应的平衡常数
___________  (用分压表示,保留小数点后三位);提高NO平衡转化率的条件为
(用分压表示,保留小数点后三位);提高NO平衡转化率的条件为___________ (任写两点)。
②如图所示,利用电解原理,可将废气中的 转化为
转化为 ,阳极的电极反应式为
,阳极的电极反应式为___________ ,通入 的目的是
的目的是___________ 。
(1)如图所示为利用
 和空气中的
和空气中的 以
以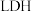 超薄纳米为催化剂在光催化作用下合成氨的原理。
超薄纳米为催化剂在光催化作用下合成氨的原理。
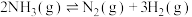

Ⅱ.

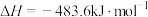
则上述合成氨的热化学方程式为
(2)合成尿素
 的反应为
的反应为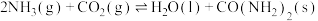
 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示。
的转化率随时间的变化情况如图所示。
 的浓度变化表示反应速率,则
的浓度变化表示反应速率,则 点的逆反应速率
点的逆反应速率②下列叙述中不能说明该反应达到平衡状态的是
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C.
 的消耗速率和
的消耗速率和 的消耗速率之比为
的消耗速率之比为
D.固体质量不再发生变化
(3)汽车尾气已成为许多大城市空气的主要污染源,其中存在大量
 。实验发现,
。实验发现, 易发生二聚反应
易发生二聚反应 并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为
并快速达到平衡。向真空钢瓶中充入一定量的NO进行反应,测得温度分别为 和
和 时NO的转化率随时间变化的结果如图所示。
时NO的转化率随时间变化的结果如图所示。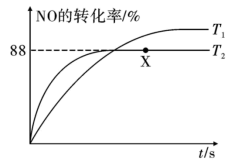
 时,达到平衡时体系的总压强为
时,达到平衡时体系的总压强为 点
点 的物质的量分数为
的物质的量分数为 点对应的平衡常数
点对应的平衡常数
 (用分压表示,保留小数点后三位);提高NO平衡转化率的条件为
(用分压表示,保留小数点后三位);提高NO平衡转化率的条件为②如图所示,利用电解原理,可将废气中的
 转化为
转化为 ,阳极的电极反应式为
,阳极的电极反应式为 的目的是
的目的是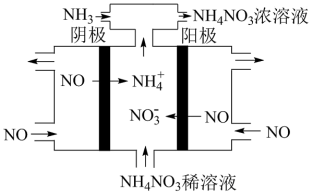
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】高纯度的氢氟酸是制造芯片的重要原料之一。
(1)已知:HF(aq)⇌H+(aq)+F-(aq) ΔH=-10.4kJ/mol
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
则:HF(aq)+NaOH(aq) =NaF(aq) +H2O(l)的ΔH=_______ 。
(2)HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是_______ ,写出(HF)2发生第二步电离的电离方程式_______ 。
(3)如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。

若固定隔板于“5”处,当右侧容器内反应2HF(g)⇌(HF)2(g)达到平衡状态时,右侧容器内压强为P1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器内压强为P2,则P1_______ P2(填“大于”“小于”或“等于”)。该温度下,2HF(g)⇌(HF)2(g) 反应的平衡常数KP=_______ kPa-1(KP为以分压表示的平衡常数,计算结果保留2位有效数字)。
(4)若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平衡状态的是_______ 。
A.容器右侧气体的密度不再改变
B.容器右侧的温度不再改变
C.容器右侧气体的压强不再改变
D.容器右侧气体的平均相对分子质量不再改变
E.
(5)某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀释时,溶液pH变化如图所示。
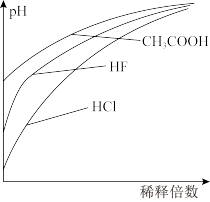
图中,氢氟酸溶液在稀释初期的pH上升特别快,据此判断,(HF)2与HF的酸性相比,较强的是_______ 。
(6)NaF和HF的混合溶液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保持不变。试结合方程式和必要的文字解释之_____ 。
(1)已知:HF(aq)⇌H+(aq)+F-(aq) ΔH=-10.4kJ/mol
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
则:HF(aq)+NaOH(aq) =NaF(aq) +H2O(l)的ΔH=
(2)HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是
(3)如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。

若固定隔板于“5”处,当右侧容器内反应2HF(g)⇌(HF)2(g)达到平衡状态时,右侧容器内压强为P1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器内压强为P2,则P1
(4)若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平衡状态的是
A.容器右侧气体的密度不再改变
B.容器右侧的温度不再改变
C.容器右侧气体的压强不再改变
D.容器右侧气体的平均相对分子质量不再改变
E.

(5)某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀释时,溶液pH变化如图所示。

图中,氢氟酸溶液在稀释初期的pH上升特别快,据此判断,(HF)2与HF的酸性相比,较强的是
(6)NaF和HF的混合溶液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保持不变。试结合方程式和必要的文字解释之
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】某科研团队利用 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为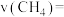
_______ ,此时的化学平衡常数 为
为_______ (保留两位小数),若在此温度下时向A容器的平衡体系中再充入 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②a点时该反应的平衡常数为 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为_______ 。
(2)对于反应③: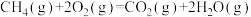 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。如果d点已经达到平衡状态,则e点的
____  逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是____ 。
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol
 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。
 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为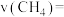
 为
为 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②a点时该反应的平衡常数为
 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为
(2)对于反应③:
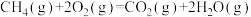 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。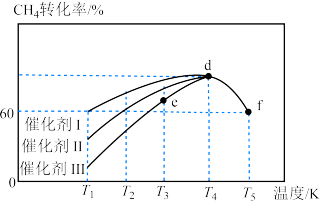

 逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】在一定条件下,CO2可以合成一系列化工原料或燃料,在工农业生产中具有重大意义,根据以下合成过程,回答问题。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。
已知:
该反应△H=________ KJ/mol。
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
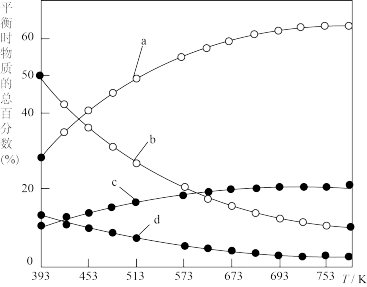
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=________ ;
②曲线a表示的物质为H2,理由是________ ;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________ (列举2项).
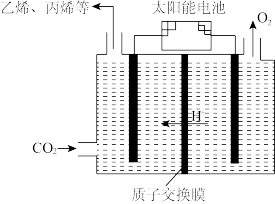
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式________ 。
(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
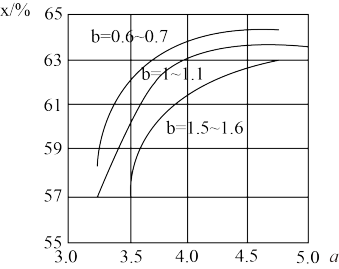
①b宜控制在________ (填序号)范围内
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是________ 。
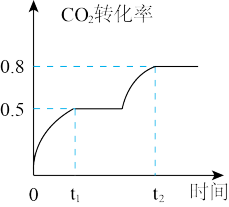
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g) CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" ________ " mL。
(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。已知:
| 共价键 | C=O | H—H | C—O | C—H | O—H |
| 键能(KJ·mol-1) | 750 | 436 | 358 | 413 | 463 |
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
②曲线a表示的物质为H2,理由是
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式

(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2
 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
①b宜控制在
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g)
 CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" 
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】乙二醇在生产、生活中有着广泛的用途,某传统工艺制取乙二醇所涉及的反应如下:
Ⅰ: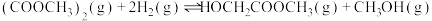
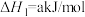
Ⅱ: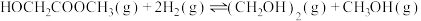
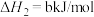
Ⅲ: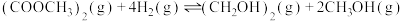

回答下列问题:
(1)则
___________ ;该工艺中制备乙二醇的缺点是___________ (填写1点即可)。
(2)在压强一定的条件下,将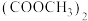 、
、 按一定比例、流速通过装有催化剂的反应管,同时发生
按一定比例、流速通过装有催化剂的反应管,同时发生 的反应Ⅰ、反应Ⅲ。测得
的反应Ⅰ、反应Ⅲ。测得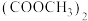 的转化率与
的转化率与 、
、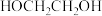 的选择性【
的选择性【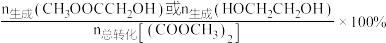 】随温度变化的关系如下图所示:
】随温度变化的关系如下图所示:

①表示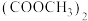 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是___________ (填“a”“b”或“c”)。
②试分析190~198℃范围内,温度升高,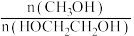 的值
的值___________ (填“增大”“减小”或“不变”)
③由X、Y点可推断反应中
___________ 。
(3)工业生产中,“反应Ⅲ”的体系压强控制在2.3~2.5MPa的原因是___________ 。
(4)在日常生活中乙二醇的用途是___________ 。
Ⅰ:
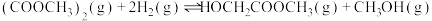
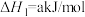
Ⅱ:
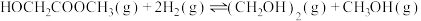
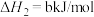
Ⅲ:
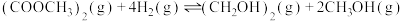

回答下列问题:
(1)则

(2)在压强一定的条件下,将
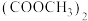 、
、 按一定比例、流速通过装有催化剂的反应管,同时发生
按一定比例、流速通过装有催化剂的反应管,同时发生 的反应Ⅰ、反应Ⅲ。测得
的反应Ⅰ、反应Ⅲ。测得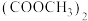 的转化率与
的转化率与 、
、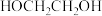 的选择性【
的选择性【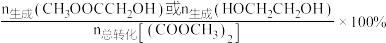 】随温度变化的关系如下图所示:
】随温度变化的关系如下图所示:
①表示
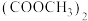 的转化率随温度变化的曲线是
的转化率随温度变化的曲线是②试分析190~198℃范围内,温度升高,
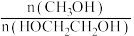 的值
的值③由X、Y点可推断反应中

(3)工业生产中,“反应Ⅲ”的体系压强控制在2.3~2.5MPa的原因是
(4)在日常生活中乙二醇的用途是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ∆H1=−362kJ∙mol−1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ∆H2=−1172kJ∙mol−1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___________ 。
(2)可以用K2CO3溶液吸收H2S,其原理K2CO3+H2S⇌KHS+KHCO3,该反应的平衡常数为___________ (已知H2CO3的Ka1=4.2×10−7,Ka2=5.6×10−11;H2S的Ka1=5.6×10−8,Ka2=1.2×10−15)
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应反应的化学方程式为___________ 。
(4)一定温度下在恒容的密闭容器中发生可逆反应为COS(g)+H2O(g)⇌CO2(g)+H2S(g) ∆H<0.能判断该反应一定达到化学平衡状态的依据是___________(填选项编号)。
(5)某温度时,反应COS(g)+H2O(g)⇌CO2(g)+H2S(g)△H<0用活性α−Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。
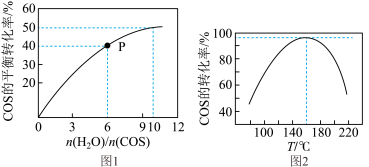
其它条件相同,改变反应温度,测得一定时间内COS水解转化率如图2所示
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]___________ ,温度___________
②P点对应的平衡常数为___________ 。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___________ (写出两条)
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ∆H1=−362kJ∙mol−1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ∆H2=−1172kJ∙mol−1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为
(2)可以用K2CO3溶液吸收H2S,其原理K2CO3+H2S⇌KHS+KHCO3,该反应的平衡常数为
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应反应的化学方程式为
(4)一定温度下在恒容的密闭容器中发生可逆反应为COS(g)+H2O(g)⇌CO2(g)+H2S(g) ∆H<0.能判断该反应一定达到化学平衡状态的依据是___________(填选项编号)。
| A.容器中气体的压强不随时间而变化 | B.v正(H2O)=v逆(H2S) |
| C.容器中气体的密度不随时间而变化 | D.消耗n molH2O的同时消耗n molCO2 |

其它条件相同,改变反应温度,测得一定时间内COS水解转化率如图2所示
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]
②P点对应的平衡常数为
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图______________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________ 。
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应: 。溶液中
。溶液中 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是________ (填标号)。
a.溶液的pH不再变化
b.v(I-)=2v( )
)
C. /
/ 不再变化
不再变化
d.c(I-)=2ymol·L-1
②tm时,V正________ V逆(填“大于”“小于”或“等于”)。
③tm时V逆________ tm时V逆(填“大于”“小于”或“等于”),理由是____________________________ 。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(4)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)________ 。
(5)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式__________________________
正极反应式__________________________

(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应:
 。溶液中
。溶液中 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I-)=2v(
 )
)C.
 /
/ 不再变化
不再变化d.c(I-)=2ymol·L-1
②tm时,V正
③tm时V逆
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(4)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)
(5)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式
正极反应式

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反应中①中,每吸收1molCO2,就有_______ molFeO被氧化。
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式___________ 。
Ⅱ.一定条件下,二氧化碳转化为甲烷。向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g) CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
(3)在300℃是,将各物质按下列起始浓度(mol·L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是_____________ 。
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓
度________ (填字母)。
A.c(CH4)=0.8mol·L-1 B.0.8mol • L-1 >c(CH4) >1.6mol • L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol • L-1
(5)在300℃时,如果向该容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,则该可逆反应初始速率v正_____ v逆 (填“>” 或“<”)。
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H_________ 0(填“>”或“<”)。
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e- =C+2CO32-,则阳极的电极反应式为______________ 。
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) , ΔH=-76.0 kJ·mol-1
②3FeO(s)+H2O(g)= Fe3O4(s)+H2(g) ΔH=-18.7 kJ·mol-1
(1)在上述反应中①中,每吸收1molCO2,就有
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式
Ⅱ.一定条件下,二氧化碳转化为甲烷。向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。
CH4(g)+2H2O(g) 。达到平衡时,各物质的浓度分别为CO2 0.2mol·L-1、CH4 0.8mol·L-1、H2 0.8mol·L-1,H2O 1.6mol·L-1。(3)在300℃是,将各物质按下列起始浓度(mol·L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓
度
A.c(CH4)=0.8mol·L-1 B.0.8mol • L-1 >c(CH4) >1.6mol • L-1
C.c(CH4)=l.6mol·L-1 D.C(CH4)>1.6mol • L-1
(5)在300℃时,如果向该容器中加入CO20.8 mol·L-1、H21.0 mol·L-1、CH4 2.8 mol·L-1、H2O 2.0mol·L-1,则该可逆反应初始速率v正
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
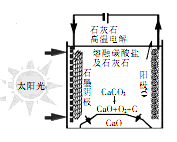
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e- =C+2CO32-,则阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g) CH2O(g)+H2O(g) ∆H。请回答下列问题:
CH2O(g)+H2O(g) ∆H。请回答下列问题:
(1)已知:①CH2O(g)+O2(g)=CO2(g)+H2O(g) ∆H1= -480kJ/mol
②相关化学键的键能数据如表所示:
则CO2(g)+2H2(g)  CH2O(g)+H2O(g) ∆H=
CH2O(g)+H2O(g) ∆H=_______ 。
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g) CH2O(g)+H2O(g)。
CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是_______ (填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_______ (填选项字母)。
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)= 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 _______ kPa∙min-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数,只写表达式)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的 关系如图所示:
关系如图所示:

当 =2时,反应达到平衡后,若再向容器中加入CO2,则达到新平衡时CO2的转化率将
=2时,反应达到平衡后,若再向容器中加入CO2,则达到新平衡时CO2的转化率将_______ (填“增大”“减小”或“不变”)。
②当 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点_______ (填“D”“E”或“F”),原因为_______ 。
 CH2O(g)+H2O(g) ∆H。请回答下列问题:
CH2O(g)+H2O(g) ∆H。请回答下列问题:(1)已知:①CH2O(g)+O2(g)=CO2(g)+H2O(g) ∆H1= -480kJ/mol
②相关化学键的键能数据如表所示:
化学键 | O=O | H-H | O-H |
键能/kJ∙mol-1 | 498 | 436 | 464 |
 CH2O(g)+H2O(g) ∆H=
CH2O(g)+H2O(g) ∆H=(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)
 CH2O(g)+H2O(g)。
CH2O(g)+H2O(g)。①下列说明反应已经达到平衡状态的是
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:2的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ②T1℃时,反应的平衡常数Kp的代数式为Kp=
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的
 关系如图所示:
关系如图所示:
当
 =2时,反应达到平衡后,若再向容器中加入CO2,则达到新平衡时CO2的转化率将
=2时,反应达到平衡后,若再向容器中加入CO2,则达到新平衡时CO2的转化率将②当
 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理 NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) K1
CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g) K2
CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=______ (用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)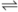 N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
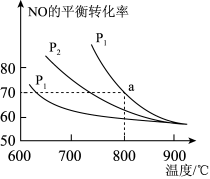
①则该反应的△H________ 0(填“﹤”“﹥”或“=”)。
②对于气相反应,用某组分(B)的平衡分压强 p(B)代替物质的量浓度 c(B) 也可表示平衡常数kp,则该反应的平衡常数表达式kp=________ ,如果p1 =1.65MPa,求a点的平衡常数kp =_________ (MPa)−1 (结果保留 3 位有效数字,分压=总压×物质的量分数)。
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率—浓度关系曲线: v正~c(NO)和v逆~c(CO2 )
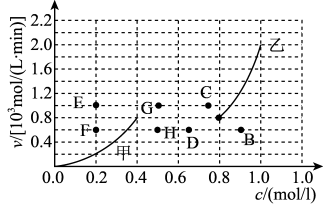
则:与曲线 v正~c(NO)相对应的是图中曲线________ (填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,v正和v逆相应的平衡点分别为______ (填字母)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72−的废水,如图所示;电解过程中溶液发生反应:Cr2O72−+6Fe2++14H+=2Cr3++6Fe3+ +7H2O。
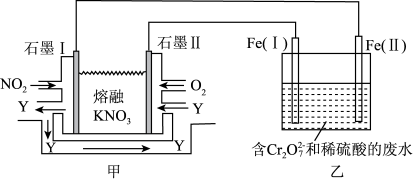
①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为________ 。乙池中的pH________ (填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积_____ 。
(4)已知H3PO4为三元酸,Ka1=7.0×10−3mol·L−1,Ka2=6.2×10−8 mol·L−1,Ka3=4.5×10−13mol·L −1。则 Na2HPO4水溶液呈________ (填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由________________ 。
(1)处理 NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) K1
CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g) K2
CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
①则该反应的△H
②对于气相反应,用某组分(B)的平衡分压强 p(B)代替物质的量浓度 c(B) 也可表示平衡常数kp,则该反应的平衡常数表达式kp=
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率—浓度关系曲线: v正~c(NO)和v逆~c(CO2 )

则:与曲线 v正~c(NO)相对应的是图中曲线
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72−的废水,如图所示;电解过程中溶液发生反应:Cr2O72−+6Fe2++14H+=2Cr3++6Fe3+ +7H2O。

①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积
(4)已知H3PO4为三元酸,Ka1=7.0×10−3mol·L−1,Ka2=6.2×10−8 mol·L−1,Ka3=4.5×10−13mol·L −1。则 Na2HPO4水溶液呈
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:
(1)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t 的变化如下表所示[t=∞时,N2O5(g)完全分解]:
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2NO2(g)=N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)=2NO2(g)+ O2(g)的ΔH=
O2(g)的ΔH=________ kJ·mol-1。
②研究表明,N2O5(g)分解的反应速率v=2×10-3× kPa·min-1。t=62 min时,测得体系中
kPa·min-1。t=62 min时,测得体系中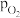 =2.9 kPa,则此时
=2.9 kPa,则此时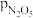 =
=________ kPa,v=________ kPa·min-1。
③若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)________ 63.1 kPa(填“大于”“等于”或“小于”),原因是________________________ 。
④25 ℃时N2O4(g) 2NO2(g)反应的平衡常数Kp=
2NO2(g)反应的平衡常数Kp=________ (Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g) 4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3 NO+NO2+O2 慢反应
NO+NO2+O2 慢反应
第三步 NO+NO3 2NO2 快反应
2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是________ (填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
(1)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t 的变化如下表所示[t=∞时,N2O5(g)完全分解]:
| t/min | 0 | 40 | 80 | 160 | 260 | 1 300 | 1 700 | ∞ |
| p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
2NO2(g)=N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)=2NO2(g)+
 O2(g)的ΔH=
O2(g)的ΔH=②研究表明,N2O5(g)分解的反应速率v=2×10-3×
 kPa·min-1。t=62 min时,测得体系中
kPa·min-1。t=62 min时,测得体系中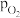 =2.9 kPa,则此时
=2.9 kPa,则此时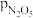 =
=③若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)
④25 ℃时N2O4(g)
 2NO2(g)反应的平衡常数Kp=
2NO2(g)反应的平衡常数Kp=(3)对于反应2N2O5(g)
 4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:第一步 N2O5
 NO2+NO3 快速平衡
NO2+NO3 快速平衡第二步 NO2+NO3
 NO+NO2+O2 慢反应
NO+NO2+O2 慢反应第三步 NO+NO3
 2NO2 快反应
2NO2 快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
您最近一年使用:0次



