利用酸碱中和滴定过程中溶液电导变化的转折来确定滴定终点的方法称为电导滴定。某同学用 的NaOH溶液分别滴定同体积的稀HCl溶液和稀HR溶液
的NaOH溶液分别滴定同体积的稀HCl溶液和稀HR溶液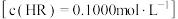 ,溶液电导率变化如图(忽略溶液体积的微小变化)。下列有关判断正确的是
,溶液电导率变化如图(忽略溶液体积的微小变化)。下列有关判断正确的是
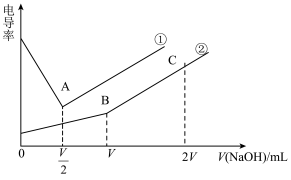
 的NaOH溶液分别滴定同体积的稀HCl溶液和稀HR溶液
的NaOH溶液分别滴定同体积的稀HCl溶液和稀HR溶液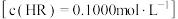 ,溶液电导率变化如图(忽略溶液体积的微小变化)。下列有关判断正确的是
,溶液电导率变化如图(忽略溶液体积的微小变化)。下列有关判断正确的是
A.A点: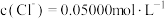 |
B.B点溶液中: |
C.C点溶液中: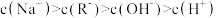 |
| D.水的电离程度:B>C>A |
更新时间:2022-03-10 11:01:39
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】某化学兴趣小组在实验中发现一瓶溶液标签上标有“CaCl2 0.1 mol·L-1”的字样,下面是该小组成员对溶液的叙述正确的是
| A.配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中 |
| B.用NA表示阿伏加德罗常数,0.1 mol·L-1CaCl2溶液中所含的Ca2+为0.1NA |
| C.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol·L-1 |
| D.将该瓶溶液稀释至原体积的2倍,则所得溶液的c(Cl-)为0.1 mol·L-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】从2mol·L-1的氯化铜溶液中取出含Cl-为7.1g的溶液,所取溶液的体积是
| A.25mL | B.50mL | C.12.5mL | D.0.025mL |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】室温下,下列各组离子在指定溶液中可能大量共存的是
A.饱和氯水中Cl-、Na+、SO 、NO 、NO |
B.水电离的氢离子浓度为1.0×10-13mol/L 溶液中:CO 、K+、SO 、K+、SO 、Br- 、Br- |
C.pH=12的溶液中NO 、 I-、Na+、Al3+ 、 I-、Na+、Al3+ |
D.Na2S溶液中SO 、K+、Cl-、Cu2+ 、K+、Cl-、Cu2+ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】室温下,关于10mL 0.1mol/L HClO溶液,下列判断一定正确的是
| A.该溶液中ClO-的数目为0.001NA |
| B.加入水稀释后,溶液的pH降低,水电离程度增加 |
| C.用0.1mol/L NaOH溶液来滴定,刚好中和时,消耗的NaOH溶液的体积小于10mL |
| D.与等体积、等浓度的NaClO溶液混合后,2c(Na+)=c(ClO-)+c(HClO) |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】常温下,在pH都等于4的HCl和NH4Cl两种溶液中,设由水电离产生的H+ 离子浓度分别为A mol/L与B mol/L,则A和B关系为
| A.A>B | B.A=10-6 B | C.B=10-6 A | D.A=B |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】室温下,在10mL浓度均为0.1mol/L的醋酸和盐酸混合液中,滴加0.1mol/L的NaOH溶液VmL,则下列关系正确的是
| A.V=0时:c(H+)>c(Cl-)=c(CH3COOH) |
| B.V=10mL时:c(OH﹣)+c(CH3COO﹣)=c(H+) |
| C.V=20mL时:c(Na+)<c(CH3COO﹣)+c(Cl﹣) |
| D.加入NaOH溶液至pH=7时,V>20mL |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐3】关于常温下pH=2的H3PO4溶液,下列说法正确的是
A.c(H3PO4)=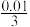 mol/L mol/L |
B.c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH-) )+c(OH-) |
| C.加水稀释使电离度增大,溶液pH减小 |
| D.加入NaH2PO4固体,溶液酸性增强 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】25℃时,用 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 被滴定分数
被滴定分数 及微粒分布分数
及微粒分布分数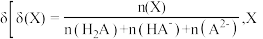 表示
表示 或
或 ]的关系如图所示:
]的关系如图所示:
 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 被滴定分数
被滴定分数 及微粒分布分数
及微粒分布分数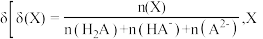 表示
表示 或
或 ]的关系如图所示:
]的关系如图所示: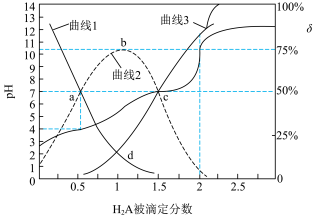
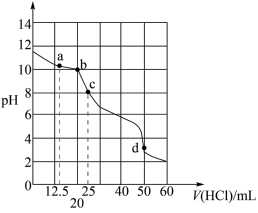
A.曲线2代表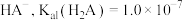 |
B.b点溶液中: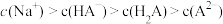 |
C.d点溶液的 为5.5 为5.5 |
D. 被滴定分数为2时,溶液中 被滴定分数为2时,溶液中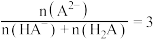 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】在 CH3COONa溶液中离子浓度最大的是
| A.H | B.OH | C.CH3COO | D.Na |
您最近一年使用:0次

 、Na+、AlO
、Na+、AlO 、SO
、SO 、Cl-、NO
、Cl-、NO
 )>c(HCO
)>c(HCO

