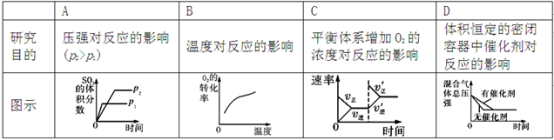
下列说法正确的是
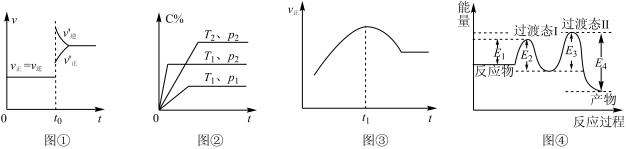

A.图①可表示向达到平衡状态的反应: ,在 ,在 时刻充入了一定量的 时刻充入了一定量的 |
B.由图②可知, 满足反应: 满足反应: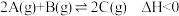 |
C.图③为在绝热恒容密闭容器中通入A和B,发生反应: 时刻体系达到平衡 时刻体系达到平衡 |
D.图④为某反应加入催化剂后相关能量变化,该总反应的活化能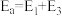 |
更新时间:2022-03-01 10:47:21
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列有关活化分子的说法正确的是
| A.活化分子间所发生的所有碰撞均为有效碰撞 |
| B.增大反应物浓度能够增大活化分子百分数,化学反应速率一定增大 |
| C.催化剂能使活化能降低,使活化分子百分数增大,反应速率加快 |
| D.增大压强,活化分子数一定增加,化学反应速率一定增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】能改变反应物分子中活化分子百分数的外界条件是
①催化剂、②温度、③压强、④浓度
①催化剂、②温度、③压强、④浓度
| A.①② | B.②③④ | C.③④ | D.①④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列说法中正确的说法有几个
①活化分子间的碰撞不一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多
④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
⑤也能用固体或纯液体的变化量来表示反应快慢
⑥催化剂能增大活化分子百分数,从而增大化学反应速率
①活化分子间的碰撞不一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多
④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
⑤也能用固体或纯液体的变化量来表示反应快慢
⑥催化剂能增大活化分子百分数,从而增大化学反应速率
| A.①②③ | B.①③⑥ | C.①④⑤ | D.③⑤⑥ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列叙述中,不正确的是 ( )
| A.某特定反应的平衡常数仅是温度的函数 |
| B.化学平衡发生移动,平衡常数必发生变化 |
| C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动 |
| D.催化剂不能改变平衡常数的大小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A. | 加热麦芽糖和稀硫酸的混合溶液,冷却后加入 溶液至碱性,再加入银氨溶液,加热 溶液至碱性,再加入银氨溶液,加热 | 有银镜产生 | 水解产物中一定含有还原糖 |
| B. | 向盛有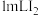 的 的 溶液的试管中加入 溶液的试管中加入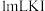 浓溶液,振荡 浓溶液,振荡 |  层紫色变浅 层紫色变浅 | 水能萃取 中 中 |
| C. | 压缩盛有 气体的容器体积 气体的容器体积 | 气体颜色变浅 | 加压, 平衡正向移动 平衡正向移动 |
| D. | 向 溶液中插入电导率传感器,逐滴加入 溶液中插入电导率传感器,逐滴加入 溶液 溶液 | 电导率先减小后增大 | 电导率最小时,两者恰好完全反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】在t℃时,某体积可变的密闭容器内,加入适量反应物发生反应:mA(g)+nB(g) pC(g),已知通过逐渐改变容器的体积使压强增大,每次改变后达到平衡时测得A的物质的量浓度和重新达到平衡所需时间如下表:
pC(g),已知通过逐渐改变容器的体积使压强增大,每次改变后达到平衡时测得A的物质的量浓度和重新达到平衡所需时间如下表:
则下列有关说法中不正确的是()
 pC(g),已知通过逐渐改变容器的体积使压强增大,每次改变后达到平衡时测得A的物质的量浓度和重新达到平衡所需时间如下表:
pC(g),已知通过逐渐改变容器的体积使压强增大,每次改变后达到平衡时测得A的物质的量浓度和重新达到平衡所需时间如下表:| 压强 | c(A) | 重新达到平衡所需时间 | |
| 第一次达到平衡 | 2×105Pa | 0.08mol/L | 4min |
| 第二次达到平衡 | 5×105Pa | 0.20mol/L | xmin |
| 第三次达到平衡 | 1×106Pa | 0.44mol/L | 0.8min |
| A.第二次平衡到第三次平衡中,A的平均反应速率为0.3mol/(L·min) |
| B.维持压强为2×105Pa,假设当反应达到平衡状态时体系中共有amol气体,再向体系中加入bmolB,则重新达到平衡时体系中共有(a+b)mol气体 |
C.当压强为1×106Pa时,此反应的平衡常数表达式为K=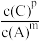 |
| D.m+n=p,x=0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】体积均为1L的两个恒容密闭容器I、Ⅱ中,均充入2mol CO(g)和2mol NO(g),发生反应: ,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是
,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是
 ,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是
,相对容器Ⅱ,容器I只改变一个外界条件,测得N2的物质的量与时间关系如图所示。下列叙述正确的是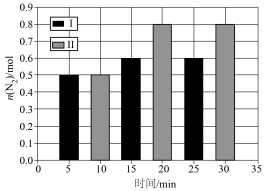
| A.该反应是吸热反应,容器I改变的条件可能是使用了催化剂 |
| B.相对容器Ⅱ,容器I改变的条件可能是升温或者加压 |
| C.容器Ⅱ中NO的平衡转化率为80% |
D.容器Ⅱ中0~10min内,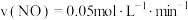 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】在催化剂作用下, 氧化
氧化 可获得
可获得 。其主要化学反应如下:
。其主要化学反应如下:
反应Ⅰ.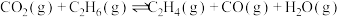

反应Ⅱ.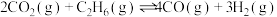

压强分别为 、
、 时,将
时,将
 和
和
 的混合气体置于密闭容器中反应,不同温度下体系中乙烷的平衡转化率、乙烯的选择性[
的混合气体置于密闭容器中反应,不同温度下体系中乙烷的平衡转化率、乙烯的选择性[ ]如图所示。下列说法正确的是
]如图所示。下列说法正确的是
 氧化
氧化 可获得
可获得 。其主要化学反应如下:
。其主要化学反应如下:反应Ⅰ.
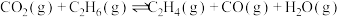

反应Ⅱ.
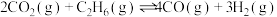

压强分别为
 、
、 时,将
时,将
 和
和
 的混合气体置于密闭容器中反应,不同温度下体系中乙烷的平衡转化率、乙烯的选择性[
的混合气体置于密闭容器中反应,不同温度下体系中乙烷的平衡转化率、乙烯的选择性[ ]如图所示。下列说法正确的是
]如图所示。下列说法正确的是
A. |
B.压强为 、温度为210℃时,反应达平衡时, 、温度为210℃时,反应达平衡时, |
C. 的选择性下降的原因可能是随着温度的升高,反应Ⅱ中生成的 的选择性下降的原因可能是随着温度的升高,反应Ⅱ中生成的 抑制了反应Ⅰ的进行 抑制了反应Ⅰ的进行 |
D.研发低温下 转化率高和 转化率高和 选择性高的催化剂,可以提高平衡时 选择性高的催化剂,可以提高平衡时 产率 产率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】在恒容密闭容器中加入浓度均为0.2 mol·L−1的CO和H2O, T℃发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
 CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是| A.单位时间内消耗1 mol CO同时生成1 mol CO2 |
| B.混合气体的密度不再变化 |
| C.CO、H2O、CO2和H2 的浓度不再变化 |
| D.混合气体的平均摩尔质量不再变化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】T℃时,向绝热恒容密闭容器中通入a mol SO2和b mol NO2,一定条件下发生反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g) ΔH<0,测得SO3的浓度随时间变化如图所示,
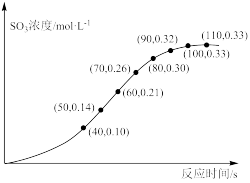
下列说法不正确 的是

下列说法
| A.容器内压强不再改变说明反应已达平衡 |
| B.SO3在40~50 s内的平均反应速率大于50~60 s内的平均反应速率 |
| C.NO2速率v(正)(t=60 s时)大于v(逆)(t=80 s时) |
| D.T℃时,若在恒温恒容下,向原容器通入a mol SO2和b mol NO2,达到平衡时c(SO3)>0.33 mol·L−1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】2SO2(g)+O2(g)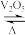 2SO3(g) △H=-196.6KJ/mol是制备硫酸的重要反应。下列关于该反应的叙述不正确的是
2SO3(g) △H=-196.6KJ/mol是制备硫酸的重要反应。下列关于该反应的叙述不正确的是
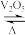 2SO3(g) △H=-196.6KJ/mol是制备硫酸的重要反应。下列关于该反应的叙述不正确的是
2SO3(g) △H=-196.6KJ/mol是制备硫酸的重要反应。下列关于该反应的叙述不正确的是| A.反应达到平衡状态后,SO3(g)浓度保持不变 | B.催化剂V2O5能够提高SO2的平衡转化率 |
| C.增加O2的浓度有利于提高SO2的平衡转化率 | D.采用450℃高温可以缩短反应达到平衡的时间 |
您最近一年使用:0次

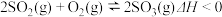 ,下列研究目的和示意图相符的是
,下列研究目的和示意图相符的是