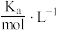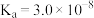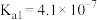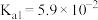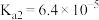Ⅰ.已知:在相同条件下醋酸与氨水电离程度相同,现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是 填序号
填序号
____ 。
(2)若④、⑤、⑥、⑦、⑧五种溶液中NH 浓度相等,则五种溶液的物质的量浓度由大到小的顺序是
浓度相等,则五种溶液的物质的量浓度由大到小的顺序是 填序号
填序号
___ 。
Ⅱ 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(3)pH相等的下列溶液,它们的物质的量浓度由大到小排列的顺序是____ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____ (填准确数值 。
。
(6)25℃时,将amol•L-1的醋酸与bmol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____ 。
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是
 填序号
填序号
(2)若④、⑤、⑥、⑦、⑧五种溶液中NH
 浓度相等,则五种溶液的物质的量浓度由大到小的顺序是
浓度相等,则五种溶液的物质的量浓度由大到小的顺序是 填序号
填序号
Ⅱ
 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4,.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
 。
。(6)25℃时,将amol•L-1的醋酸与bmol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
更新时间:2022-03-29 15:30:33
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】一定温度下,冰醋酸(纯醋酸)加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
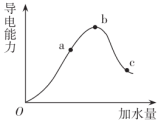
(1)Oa段溶液的导电能力逐渐增强的原因是_______ 。
(2)c点溶液的pH_______ (填“>”或“<”)b点。
(3)a点溶液中H+的物质的量________ (填“>”或“<”)c点。
(4)若使c点溶液中的c(CH3COO-)减小,可以采取下列措施中的______ (填选项序号)。
A.加水 B.通入HCl(g) C.加入锌粒

(1)Oa段溶液的导电能力逐渐增强的原因是
(2)c点溶液的pH
(3)a点溶液中H+的物质的量
(4)若使c点溶液中的c(CH3COO-)减小,可以采取下列措施中的
A.加水 B.通入HCl(g) C.加入锌粒
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】水溶液中存在多种多样的化学反应和平衡,按要求完成下列填空。
(1)25 ℃时,pH=3的盐酸和pH=10的Ba(OH)2溶液中由水电离出的c(H+)之比为___________ 。
(2)在不同温度下的水溶液中离子浓度曲线如图所示。
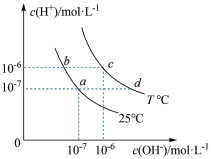
①a、b、c、d四点中溶液呈碱性的点为___________ 。
②25℃时,将pH=2的盐酸溶液与pH=13的NaOH溶液以一定体积比混合,溶液pH=11,盐酸溶液与NaOH溶液的体积比为___________ 。
(3)已知25℃时:H2CO3:Ka1=4.5×10-7;Ka2=4.7×10-11;HClO:Ka=3.0×10-8。
① 的电离平衡常数表达式为
的电离平衡常数表达式为___________ 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方式___________ 。
(1)25 ℃时,pH=3的盐酸和pH=10的Ba(OH)2溶液中由水电离出的c(H+)之比为
(2)在不同温度下的水溶液中离子浓度曲线如图所示。

①a、b、c、d四点中溶液呈碱性的点为
②25℃时,将pH=2的盐酸溶液与pH=13的NaOH溶液以一定体积比混合,溶液pH=11,盐酸溶液与NaOH溶液的体积比为
(3)已知25℃时:H2CO3:Ka1=4.5×10-7;Ka2=4.7×10-11;HClO:Ka=3.0×10-8。
①
 的电离平衡常数表达式为
的电离平衡常数表达式为②将少量CO2气体通入NaClO溶液中,写出该反应的离子方式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
回答下列问题:
(1) 的电离方程式为
的电离方程式为___________ 。
(2)物质的量浓度相同的HF、HClO、 、
、 中,
中, 由大到小的顺序是
由大到小的顺序是___________ 。
(3)常温下, 的氨水的pH约为
的氨水的pH约为___________ ( )。
)。
(4)常温下, 的水溶液的pH
的水溶液的pH___________ 7(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(5)常温下,在 的
的 溶液中,水电离出来的
溶液中,水电离出来的 为
为___________  。
。
| 化学式 | HF | HClO |  |  |  |
| 电离常数 | 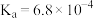 | 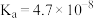 | 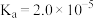 | 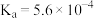 | 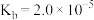 |
(1)
 的电离方程式为
的电离方程式为(2)物质的量浓度相同的HF、HClO、
 、
、 中,
中, 由大到小的顺序是
由大到小的顺序是(3)常温下,
 的氨水的pH约为
的氨水的pH约为 )。
)。(4)常温下,
 的水溶液的pH
的水溶液的pH ”、“
”、“ ”或“
”或“ ”)。
”)。(5)常温下,在
 的
的 溶液中,水电离出来的
溶液中,水电离出来的 为
为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Ⅰ.常温下,用实验确定某酸HA是弱电解质。三个同学的方案是:
甲:①称取一定质量的HA晶体,配制成0.1 mol/L的溶液100 mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=3的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
丙:取NaA固体溶解于水中配成溶液,测溶液的pH值。
(1)在甲、乙两个方案的第①步中,都要用到的定量玻璃仪器是____________________
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH>1。乙方案中,说明HA是弱电解质的现象下列描述正确的是______________ 。
A.装HCl溶液的试管中放出H2的速率快; B.装HA溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
丙方案测得溶液的pH值>7则说明HA为弱酸。
Ⅱ.(3)常温下,现有电解质溶液:①NaClO;②NaOH;③NaHCO3;④CH3COONa。当几种溶液的pH相同时,其物质的量浓度最大的是(填编号)__________
(4)氯化铁主要用于金属蚀刻、污水处理,具有效果好、价格便宜等优点。配制FeCl3溶液需要加入少量盐酸抑制水解,则FeCl3作净水剂的原理用离子方程式解释是____________
(5)明矾也可以做净水剂,向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子恰好沉淀完全时,溶液pH________ 7(选填“>”、“<”或“=”);向明矾溶液中逐滴加入氢氧化钡溶液至铝离子恰好沉淀完全时,离子反应总方程式是__________________
甲:①称取一定质量的HA晶体,配制成0.1 mol/L的溶液100 mL;②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=3的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
丙:取NaA固体溶解于水中配成溶液,测溶液的pH值。
(1)在甲、乙两个方案的第①步中,都要用到的定量玻璃仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH>1。乙方案中,说明HA是弱电解质的现象下列描述正确的是
A.装HCl溶液的试管中放出H2的速率快; B.装HA溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
丙方案测得溶液的pH值>7则说明HA为弱酸。
Ⅱ.(3)常温下,现有电解质溶液:①NaClO;②NaOH;③NaHCO3;④CH3COONa。当几种溶液的pH相同时,其物质的量浓度最大的是(填编号)
(4)氯化铁主要用于金属蚀刻、污水处理,具有效果好、价格便宜等优点。配制FeCl3溶液需要加入少量盐酸抑制水解,则FeCl3作净水剂的原理用离子方程式解释是
(5)明矾也可以做净水剂,向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子恰好沉淀完全时,溶液pH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】表是25℃时某些弱酸的电离平衡常数。
(1)pH相同的NaClO和 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
______ NaClO(填“ ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
______  。
。
(2)若
 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
______ 。
(3)取10mL 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中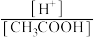 的比值将
的比值将______ (填“增大”“减小”或“无法确定”)。
(4)向碳酸钠溶液中滴加少量氯水的离子方程式______ 。
化学式 |
|
|
|
|
|
|
|
|
|
 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
 ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
 。
。(2)若

 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
(3)取10mL
 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中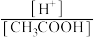 的比值将
的比值将(4)向碳酸钠溶液中滴加少量氯水的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】现有HA、HB、HC三种一元弱酸,分析并回答下列问题:
①等PH值的三种酸,加水稀释的PH值变化如图比较三种酸的酸性强弱_________ 〉___________ 〉__________ 三种酸的物质的量浓度由大到小的顺序___________ 。

②同浓度的NaA, NaB, NaC,PH值的大小_____________ 〉_____________ 〉__________ 。
③25℃时若已知NH4B的溶液显中性,则NH4A溶液的PH值__________ 7,写出NH4C的水解的离子方程式______________________________ 。
④PH=2的HA与PH=12的NaOH等体积混合后,溶液中离子浓度由大到小的顺序是______ 。
①等PH值的三种酸,加水稀释的PH值变化如图比较三种酸的酸性强弱

②同浓度的NaA, NaB, NaC,PH值的大小
③25℃时若已知NH4B的溶液显中性,则NH4A溶液的PH值
④PH=2的HA与PH=12的NaOH等体积混合后,溶液中离子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】25℃时,电离常数:
请回答下列问题:
(1)物质的量浓度为 的下列四种溶液:a.
的下列四种溶液:a. 溶液 b.
溶液 b. 溶液c.
溶液c. 溶液 d.
溶液 d. 溶液,
溶液, 由大到小的顺序是
由大到小的顺序是________ (用序号填空)。
(2)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:________________ 。
(3)25℃时, 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中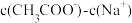
________ (填准确数值), =
= ________ 。
(4)某温度时,纯水的 。该温度下
。该温度下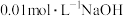 溶液的
溶液的
________ ,向该温度下的纯水中加入少量的碳酸钠固体,使溶液 为9,则水电离出的
为9,则水电离出的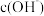 =
=_________ 。
| 化学式 |  |  |  |
| 电离常数 |  | K1=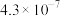 K2= 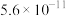 |  |
(1)物质的量浓度为
 的下列四种溶液:a.
的下列四种溶液:a. 溶液 b.
溶液 b. 溶液c.
溶液c. 溶液 d.
溶液 d. 溶液,
溶液, 由大到小的顺序是
由大到小的顺序是(2)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:
(3)25℃时,
 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中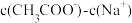
 =
= (4)某温度时,纯水的
 。该温度下
。该温度下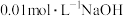 溶液的
溶液的
 为9,则水电离出的
为9,则水电离出的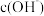 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】请根据所学知识回答下列问题:
(1)NaHSO3溶液中共存在7种微粒,它们是Na+、HSO 、H+、SO
、H+、SO 、H2O、
、H2O、_______ 、_______ (填微粒符号)。
(2)常温下,物质的量浓度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH )最大的是:
)最大的是:_______ ,最小的是:_______ (填序号)
(3)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为_______ (填序号)
(4)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):_______ 把AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是_______ (填化学式)
| 酸 | 电离常数 |
| CH3COOH | K = 1.8×10 -5 |
| H2CO3 | K1= 4.3×10 -7,K2= 5.6×10 -11 |
| H2SO3 | K1=1.54×10-2 , K2=1.02×10-7 |
 、H+、SO
、H+、SO 、H2O、
、H2O、(2)常温下,物质的量浓度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH
 )最大的是:
)最大的是:(3)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为
(4)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):
您最近一年使用:0次