铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,并测定氧化膜厚度,操作步骤如下:
(1)铝片预处理
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为:_______ ;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪器有_______ 、_______ 、玻璃棒和胶头滴管。
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源_______ 极,产生氧化膜的电极反应式为_______ ,氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为_____ ,A阶段电压逐渐增大的原因是_____ 。
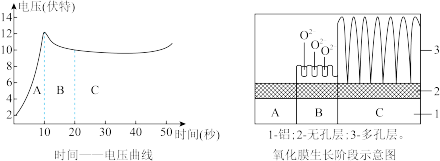
(3)氧化膜质量检验
取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式:_______ 。
(4)氧化膜厚度测定
①取氧化完毕的铝片,测得表面积为4.0cm2,洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3,可以计算得出氧化膜厚度为_______ μm(1μm=1×10-4cm)。
(1)铝片预处理
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为:
(2)电解氧化
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源

(3)氧化膜质量检验
取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式:
(4)氧化膜厚度测定
①取氧化完毕的铝片,测得表面积为4.0cm2,洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3,可以计算得出氧化膜厚度为
2022·四川德阳·三模 查看更多[9]
(已下线)第4讲 电解池 金属的电化学腐蚀与防护(已下线)考点20 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 铝、镁及其重要化合物(已下线)第4讲 镁、铝及其化合物超重点7 金属与非金属交界处的3种重要元素(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破(已下线)第08讲 铝、镁及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点19 电解池-备战2023年高考化学一轮复习考点帮(全国通用)四川省绵阳市2022届高三第三次诊断性考试理综化学试题
更新时间:2022-04-21 13:35:17
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】绿矾( )是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al、
)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al、 和
和 )制备磁性
)制备磁性 胶体粒子、绿矾和净水剂
胶体粒子、绿矾和净水剂 的实验流程如图:
的实验流程如图:
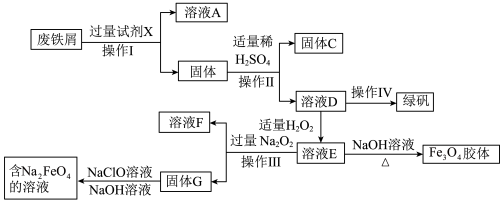
回答下列问题:
(1)试剂X为_____________ ,操作Ⅰ、Ⅱ、Ⅲ均为_____________ 操作。
(2)固体C为_________________ ,溶液D中加入KSCN溶液,无血红色产生,原因是(用离子方程式表示)_________________________ 。
(3)D中加入适量 反应的离子方程式
反应的离子方程式_________________________ ;若D中含a mol  ,则理论上加入
,则理论上加入____________ mol  可使溶液E中铁元素恰好转化为
可使溶液E中铁元素恰好转化为 胶体。
胶体。
(4)证明 胶体已经生成的方法是
胶体已经生成的方法是______________________________ 。
(5) 中铁元素的化合价为
中铁元素的化合价为_____________ ,由固体G生成 的离子方程式为
的离子方程式为___________________________________________________ 。
(6)由 配制450mL 1
配制450mL 1
 溶液,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、
溶液,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、_____________ 。
(7)以下操作会导致所配溶液浓度偏低的是 (填字母)。
 )是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al、
)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al、 和
和 )制备磁性
)制备磁性 胶体粒子、绿矾和净水剂
胶体粒子、绿矾和净水剂 的实验流程如图:
的实验流程如图:
回答下列问题:
(1)试剂X为
(2)固体C为
(3)D中加入适量
 反应的离子方程式
反应的离子方程式 ,则理论上加入
,则理论上加入 可使溶液E中铁元素恰好转化为
可使溶液E中铁元素恰好转化为 胶体。
胶体。(4)证明
 胶体已经生成的方法是
胶体已经生成的方法是(5)
 中铁元素的化合价为
中铁元素的化合价为 的离子方程式为
的离子方程式为(6)由
 配制450mL 1
配制450mL 1
 溶液,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、
溶液,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、(7)以下操作会导致所配溶液浓度偏低的是 (填字母)。
| A.转移前容量瓶中有少量水 |
| B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中 |
| C.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
| D.定容时俯视容量瓶刻度线 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之),也是分析化学中常用的分析手段。
I.现有 酸性
酸性 和未知浓度的
和未知浓度的 水溶液。反应离子方程式是:
水溶液。反应离子方程式是: 。请回答下列问题:
。请回答下列问题:
(1)该滴定实验一定不需要用到的仪器有_______(填序号)。
(2)滴定时是否需要添加指示剂_______ (填“是”或“否”),并说明理由:_______ 。
II.用氧化还原滴定方法测定粗品中Na2S2O3•5H2O的质量分数。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O = 2I﹣+S4O
= 2I﹣+S4O ),消耗Na2S2O3溶液25.00mL。回答下列问题:
),消耗Na2S2O3溶液25.00mL。回答下列问题:
(3)向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O 被还原成Cr3+,写出该反应的离子方程式:
被还原成Cr3+,写出该反应的离子方程式:_______ 。
(4)用Na2S2O3溶液滴定至终点的现象为:_______ 。
(5)粗品中Na2S2O3•5H2O的质量分数为_______ 。
(6)若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外,则测定结果偏_______ (填“高”、“低”或“不变”)。
I.现有
 酸性
酸性 和未知浓度的
和未知浓度的 水溶液。反应离子方程式是:
水溶液。反应离子方程式是: 。请回答下列问题:
。请回答下列问题:(1)该滴定实验一定不需要用到的仪器有_______(填序号)。
| A.酸式滴定管(50mL) | B.碱式滴定管(10mL) |
| C.白纸 | D.量筒(10mL) |
II.用氧化还原滴定方法测定粗品中Na2S2O3•5H2O的质量分数。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O
 = 2I﹣+S4O
= 2I﹣+S4O ),消耗Na2S2O3溶液25.00mL。回答下列问题:
),消耗Na2S2O3溶液25.00mL。回答下列问题:(3)向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O
 被还原成Cr3+,写出该反应的离子方程式:
被还原成Cr3+,写出该反应的离子方程式:(4)用Na2S2O3溶液滴定至终点的现象为:
(5)粗品中Na2S2O3•5H2O的质量分数为
(6)若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外,则测定结果偏
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去)。请回答下列问题。
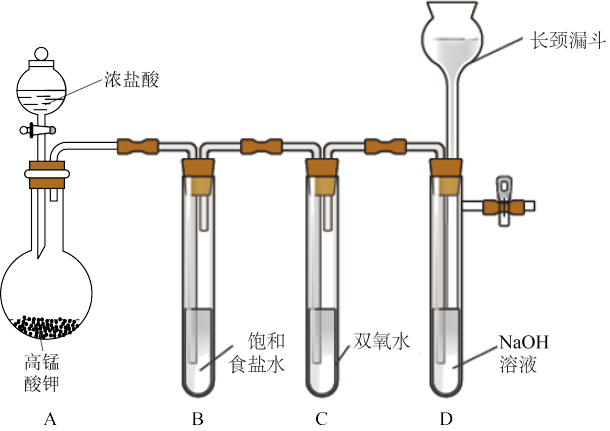
(1)A中的离子反应方程式为_____ 。
(2)试管C中加入5mL30%双氧水,发生反应的化学方程式_____ 。
(3)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为_____ ,试管D中的气体检验方法为_____ 。
(4)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有:_____ (用化学方程式回答)。对于质疑可以采用对比实验来解决。

(1)A中的离子反应方程式为
(2)试管C中加入5mL30%双氧水,发生反应的化学方程式
(3)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为
(4)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,W溶液中加入KSCN溶液出现红色。各物质之间的转化关系如下图所示,请回答下列问题:
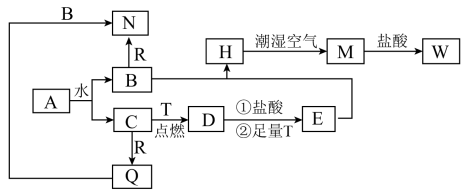
(1)写出化学式:D_______ ,W_______ 。
(2)H在潮湿空气中变成M的化学方程式_______ 。
(3)写出Q+B→N的离子方程式_______ ;在B与R反应中,当有1molN物质生成时,参与反应的氧化剂有_______ mol。
(4)D→E过程中①的离子反应方程式_______ 。
(5)将一定量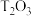 和
和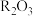 混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
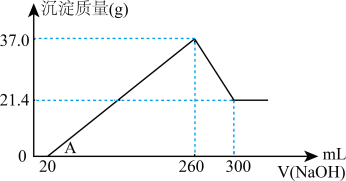
①混合物中含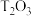 的质量为
的质量为_______ g;
②所用硫酸溶液物质的量浓度为_______  。
。

(1)写出化学式:D
(2)H在潮湿空气中变成M的化学方程式
(3)写出Q+B→N的离子方程式
(4)D→E过程中①的离子反应方程式
(5)将一定量
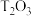 和
和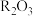 混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含
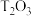 的质量为
的质量为②所用硫酸溶液物质的量浓度为
 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C是单质,其中A是金属,各种物质间的转化关系如下图,根据图示转化关系回答:
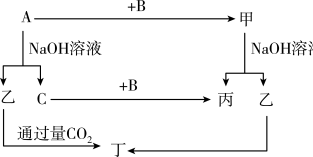
(1)写出下列物质的化学式:A_______ ,B_________ ,乙____ 。
(2)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式_________ ;
②甲与NaOH溶液反应的化学方程式_________ ;
③乙通入过量CO2反应的离子方程式__________ 。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为______ ,转移电子的物质的量为______ 。
(4)A物质在高温作用下能与氧化铁发生反应,请写出反应的化学方程式__________ 。

(1)写出下列物质的化学式:A
(2)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式
②甲与NaOH溶液反应的化学方程式
③乙通入过量CO2反应的离子方程式
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为
(4)A物质在高温作用下能与氧化铁发生反应,请写出反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是____________ (写化学式,下同);加碘盐中的含碘化合物为______ 。
(2)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为___________________ 。
(3)缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是____________ 。
(4)FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。
①现用绿矾对某工厂酸性废水(含有强氧化性离子 )进行处理,写出该过程的离子方程式
)进行处理,写出该过程的离子方程式___________ 。
②绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:___________________ 。该反应中氧化产物是___________ 。
(1)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是
(2)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为
(3)缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
(4)FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。
①现用绿矾对某工厂酸性废水(含有强氧化性离子
 )进行处理,写出该过程的离子方程式
)进行处理,写出该过程的离子方程式②绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
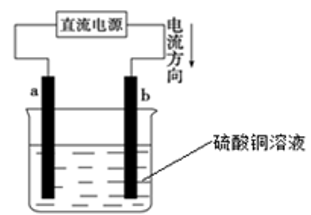
【推荐1】用惰性电极电解饱和硫酸铜溶液,装置由右图所示,则直流电源左端为______ 极(填“正”或“负”),b电极的电极反应式为:_______________ ;电解一段时间后,电解质溶液的pH_______ (填“变大”、“变小”或“不变”)。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:
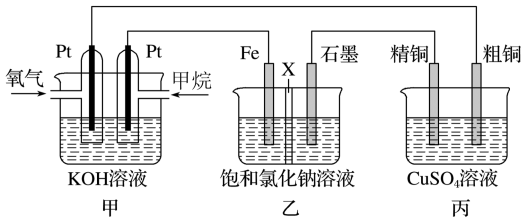
(1)甲烷燃料电池的负极反应式______ .
(2)石墨电极(C)的电极反应式为______ .
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______ (填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______ ;丙装置中阴极析出铜的质量为______ .

(1)甲烷燃料电池的负极反应式
(2)石墨电极(C)的电极反应式为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为
您最近一年使用:0次
【推荐3】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.已知甲池的总反应式为: 2CH3OH+3O2+4KOH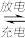
 2K2CO3+6H2O
2K2CO3+6H2O
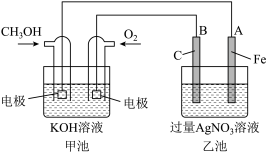
请填空:
(1)充电时:①燃料电池的正极与电源______ 极相连.
②阳极的电极反应式为__________________________________ .
(2)放电时:负极的电极反应式为______________________________ .
(3)在此过程中若完全反应,乙池中A极的质量增加324g,则甲池中理论上消耗O2______ L(标准状况下).
(4)工业上用3克氢气与足量二氧化碳反应生成气态甲醇(CH3OH)和水蒸气,放出24.5千焦的热量,请写出该反应的热化学反应方程式:_________________________ .
(5)用该电池为电源电解氯化镁制取金属镁,消耗甲醇1.6g,可制得金属镁______ g.
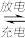
 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)充电时:①燃料电池的正极与电源
②阳极的电极反应式为
(2)放电时:负极的电极反应式为
(3)在此过程中若完全反应,乙池中A极的质量增加324g,则甲池中理论上消耗O2
(4)工业上用3克氢气与足量二氧化碳反应生成气态甲醇(CH3OH)和水蒸气,放出24.5千焦的热量,请写出该反应的热化学反应方程式:
(5)用该电池为电源电解氯化镁制取金属镁,消耗甲醇1.6g,可制得金属镁
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】钼系催化剂主要用于石油炼制和化学工业中,从废催化剂(主要成分为MoS、 和
和 )中提取比较贵重的金属钒和钼,工艺流程如下:
)中提取比较贵重的金属钒和钼,工艺流程如下:
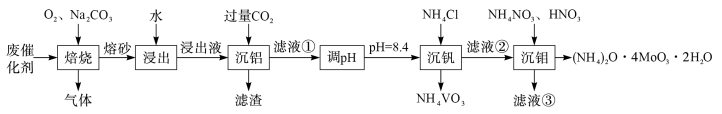
回答下列问题:
(1)“焙烧”过程中MoS、 和
和 均转化为对应的钠盐,写出MoS转化为
均转化为对应的钠盐,写出MoS转化为 的化学方程式
的化学方程式___________ 。
(2)“滤渣”的化学式为___________ 。滤液①的主要成分为 、
、___________ 。
(3)“沉钼”的离子方程式为___________ 。
(4)高温用 还原
还原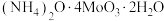 得金属钼,氧化剂与还原剂物质的量之比为
得金属钼,氧化剂与还原剂物质的量之比为___________ 。
 和
和 )中提取比较贵重的金属钒和钼,工艺流程如下:
)中提取比较贵重的金属钒和钼,工艺流程如下:
回答下列问题:
(1)“焙烧”过程中MoS、
 和
和 均转化为对应的钠盐,写出MoS转化为
均转化为对应的钠盐,写出MoS转化为 的化学方程式
的化学方程式(2)“滤渣”的化学式为
 、
、(3)“沉钼”的离子方程式为
(4)高温用
 还原
还原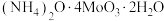 得金属钼,氧化剂与还原剂物质的量之比为
得金属钼,氧化剂与还原剂物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
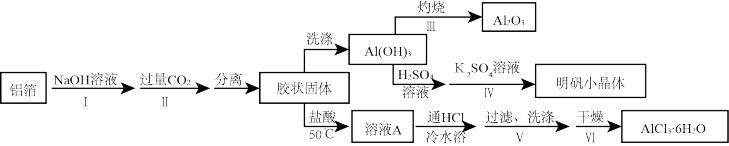
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
请回答:
(1)步骤II中发生的化学方程式___________ ;步骤Ⅲ发生的化学方程式___________ 。
(2)步骤Ⅲ,下列操作合理的是___________ 。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅴ,过滤时,用到的玻璃仪器有___________ ;
(4)步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___________ 。
(5)由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室需用下列装置制备。
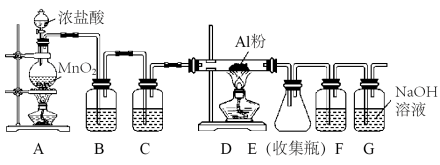
①装置A中发生反应的离子方程式为___________ 。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是___________ 。
③F中试剂的作用是___________ ,用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为___________ 。

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
| 溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)步骤II中发生的化学方程式
(2)步骤Ⅲ,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅴ,过滤时,用到的玻璃仪器有
(4)步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
(5)由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室需用下列装置制备。

①装置A中发生反应的离子方程式为
②装置B中盛放饱和NaCl溶液,该装置的主要作用是
③F中试剂的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学在实验室利用KMnO4分解制取O2的残渣(K2MnO4和MnO2)制取KMnO4(反应原理为K2MnO4+CO2→KMnO4+MnO2↓+K2CO3)并回收MnO2,实验装置如图所示。
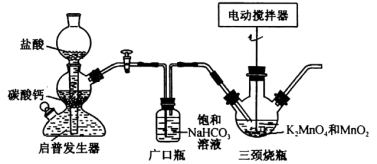
回答下列问题:
(1)广口瓶的作用是_______ 。
(2)写出启普发生器中发生反应的离子方程式:_______ 。
(3)实验室还可以用启普发生器制备的气体是_______ (填化学式,任写一种)。
(4)配平化学方程式:K2MnO4+CO2=KMnO4+MnO2↓+K2CO3,_______ ,其中氧化剂是_______ 。
(5)实验中,若CO2通入过量,则KMnO4中混有_______ (填“K2CO3”或“KHCO3”)。

回答下列问题:
(1)广口瓶的作用是
(2)写出启普发生器中发生反应的离子方程式:
(3)实验室还可以用启普发生器制备的气体是
(4)配平化学方程式:K2MnO4+CO2=KMnO4+MnO2↓+K2CO3,
(5)实验中,若CO2通入过量,则KMnO4中混有
您最近一年使用:0次



