1998年,LiW,Dhandapani B等制备了一种具有良好加氢脱氮性质的催化剂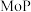 ,开辟了一类全新的催化材料。近年来,过渡金属磷化物(
,开辟了一类全新的催化材料。近年来,过渡金属磷化物(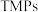 )作为一种新型催化材料,开始广泛应用在电化学、生物学、光学、催化等方面。常见的过渡金属磷化物有
)作为一种新型催化材料,开始广泛应用在电化学、生物学、光学、催化等方面。常见的过渡金属磷化物有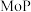 、
、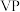 、
、 、
、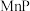 、
、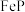 、
、 等,在金属磷化物中金属原子围绕着非金属原子形成正三棱柱,非金属原子位于正三棱柱的中心。请回答下列问题:
等,在金属磷化物中金属原子围绕着非金属原子形成正三棱柱,非金属原子位于正三棱柱的中心。请回答下列问题:
(1)基态磷原子的价电子排布式为_______ 。基态 与
与 中未成对电子数之比为
中未成对电子数之比为_______ 。
(2) 、P、S三种元素的第一电离能由大到小的顺序是
、P、S三种元素的第一电离能由大到小的顺序是_______ 。电负性:P_______ As(填“>、=或<”),原因是_______ 。
(3) 分子的空间构型为
分子的空间构型为_______ ,其中P的杂化轨道类型为_______ 杂化。
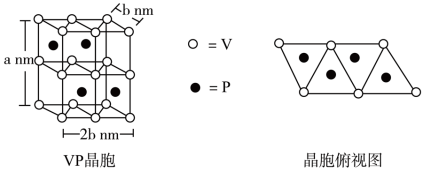
(4)磷化钒(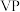 )的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有
)的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有_______ 个,晶胞的各参数见下图,设阿伏加德罗常数为 ,则
,则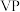 晶体的密度为
晶体的密度为_______  。(列出计算式)
。(列出计算式)
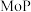 ,开辟了一类全新的催化材料。近年来,过渡金属磷化物(
,开辟了一类全新的催化材料。近年来,过渡金属磷化物(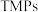 )作为一种新型催化材料,开始广泛应用在电化学、生物学、光学、催化等方面。常见的过渡金属磷化物有
)作为一种新型催化材料,开始广泛应用在电化学、生物学、光学、催化等方面。常见的过渡金属磷化物有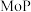 、
、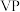 、
、 、
、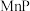 、
、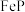 、
、 等,在金属磷化物中金属原子围绕着非金属原子形成正三棱柱,非金属原子位于正三棱柱的中心。请回答下列问题:
等,在金属磷化物中金属原子围绕着非金属原子形成正三棱柱,非金属原子位于正三棱柱的中心。请回答下列问题:(1)基态磷原子的价电子排布式为
 与
与 中未成对电子数之比为
中未成对电子数之比为(2)
 、P、S三种元素的第一电离能由大到小的顺序是
、P、S三种元素的第一电离能由大到小的顺序是(3)
 分子的空间构型为
分子的空间构型为(4)磷化钒(
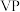 )的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有
)的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有 ,则
,则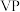 晶体的密度为
晶体的密度为 。(列出计算式)
。(列出计算式)
更新时间:2022-05-27 11:11:07
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】锌钡白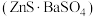 ,又名立德粉,为白色粉末,是一种常用的白色颜料。回答下列问题:
,又名立德粉,为白色粉末,是一种常用的白色颜料。回答下列问题:
(1)基态 原子的核外电子排布式为
原子的核外电子排布式为_______ ,基态 有
有_______ 种能量不同的电子。
(2)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。则基态
表示,称为电子的自旋磁量子数。则基态 原子中电子自旋磁量子数的代数和为
原子中电子自旋磁量子数的代数和为_______ 。
(3) 的三聚体环状结构如图1所示,图中
的三聚体环状结构如图1所示,图中 原子的轨道杂化方式为
原子的轨道杂化方式为_______ , 和
和 形成的共价键有两类(分别以
形成的共价键有两类(分别以 和
和 表示),其中键长较短的键为
表示),其中键长较短的键为_______ (填“a”或“b”)。

(4)立方硫化锌的晶胞结构如图2所示。 填充在
填充在 围成的
围成的_______ 空隙中。 与
与 之间的核间距为
之间的核间距为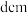 ,则该晶体的密度为
,则该晶体的密度为_______  (列出计算式即可,设
(列出计算式即可,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

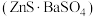 ,又名立德粉,为白色粉末,是一种常用的白色颜料。回答下列问题:
,又名立德粉,为白色粉末,是一种常用的白色颜料。回答下列问题:(1)基态
 原子的核外电子排布式为
原子的核外电子排布式为 有
有(2)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。则基态
表示,称为电子的自旋磁量子数。则基态 原子中电子自旋磁量子数的代数和为
原子中电子自旋磁量子数的代数和为(3)
 的三聚体环状结构如图1所示,图中
的三聚体环状结构如图1所示,图中 原子的轨道杂化方式为
原子的轨道杂化方式为 和
和 形成的共价键有两类(分别以
形成的共价键有两类(分别以 和
和 表示),其中键长较短的键为
表示),其中键长较短的键为
(4)立方硫化锌的晶胞结构如图2所示。
 填充在
填充在 围成的
围成的 与
与 之间的核间距为
之间的核间距为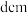 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可,设
(列出计算式即可,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】如图是元素周期表中的前四周期,①~⑨为相应的元素,从中选择合适的元素回答问题:___________ 。
(2)第二周期元素中第一电离能介于②、④之间的有___________ 种;元素⑨基态原子的核外电子占据___________ 个原子轨道。
(3)①、④两元素形成的简单化合物的空间结构为___________ ,其中心原子的杂化轨道类型为___________ 。
(4)元素⑦与CO可形成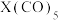 型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于___________ (填晶体类型)晶体。
(5)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为___________ 。

(2)第二周期元素中第一电离能介于②、④之间的有
(3)①、④两元素形成的简单化合物的空间结构为
(4)元素⑦与CO可形成
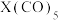 型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于(5)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
(1)写出BA3的电子式___________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(3)D的基态原子有___________ 种不同能量的电子,___________ 种不同运动状态的电子。
(4)已知BE3水解可生成一种漂白性的物质和一种碱性气体,则B和E中电负性较大的是__________ (填元素符号)。
(5)C与D的第一电离能大小为___________ 。
(6)G的基态原子的外围电子排布图为___________ ,位于___________ 区。F元素的原子结构示意图___________ ,前四周期中未成对电子数最多的原子的元素符号为___________ 。
(7)已知Be和Al的电负性均为1.5,请出向BeCl2溶液中滴加过量NaOH溶液所发生的离子反应方程式___________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol |
| D元素简单离子半径是第三周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
(1)写出BA3的电子式
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)D的基态原子有
(4)已知BE3水解可生成一种漂白性的物质和一种碱性气体,则B和E中电负性较大的是
(5)C与D的第一电离能大小为
(6)G的基态原子的外围电子排布图为
(7)已知Be和Al的电负性均为1.5,请出向BeCl2溶液中滴加过量NaOH溶液所发生的离子反应方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________ 。
(2)根据元素周期律,电负性S______ Se,第一电离能Se________ As(填“>”或“<”)。
(3)H2O的沸点______________ (填“>”或“<”)H2Se的沸点,其原因是:______ 。
(4)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于______ 。若已知铜的原子半径为d厘米,表示原子空间占有率的代数式为_____________

(5)A是短周期中原子半径最大的元素; C是A所在周期电负性最大的元素;A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图。
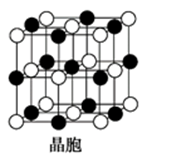
晶胞中距离一个A+最近的C-围成的图形是______________ (写名称),若晶体密度为ρ g·cm-3,阿伏伽德罗常数的值用NA表示,晶体中距离最近的两个A+之间的距离为________ cm(用含NA与ρ的式子表达)。
(1)锌离子的电子排布式是
(2)根据元素周期律,电负性S
(3)H2O的沸点
(4)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于

(5)A是短周期中原子半径最大的元素; C是A所在周期电负性最大的元素;A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图。

晶胞中距离一个A+最近的C-围成的图形是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】下图是元素周期表的一部分,已知a、b、c、d、e、f、g都是周期表中的前四周期元素,它们在周期表中的位置如图所示。
试回答下列问题:
(l)f元素基态原子的价电子排布式为______________ 。
(2)a、b、c的第一电离能由大到小的顺序______________ (用元素符号表示)。
(3)与b元素单质分子互为等电子体的阴离子为______________ 。
(4)下图为a元素某种氧化物的晶胞,其分子中心原子采用_____ 杂化,每个分子周围有___ 个分子与之距离相等且最近。若晶胞棱长为x pm,则该晶体密度的表达式为________ g•cm-3。
(5)g元素的最简单氢化物分子的空间构型为______ ,其沸点比b元素最简单的氢化物_______ (填 “高” 或“低”),其原因是______________________________ 。
(6)向CuSO4溶液中滴加入b元素最简单氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,加入乙醇析出深蓝色晶体的化学式为______________________ 。
(7)已知b的电负性大于氯,则bC13水解反应方程式为______________________________ 。
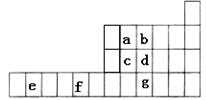
试回答下列问题:
(l)f元素基态原子的价电子排布式为
(2)a、b、c的第一电离能由大到小的顺序
(3)与b元素单质分子互为等电子体的阴离子为
(4)下图为a元素某种氧化物的晶胞,其分子中心原子采用

(5)g元素的最简单氢化物分子的空间构型为
(6)向CuSO4溶液中滴加入b元素最简单氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,加入乙醇析出深蓝色晶体的化学式为
(7)已知b的电负性大于氯,则bC13水解反应方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Cu是一种重要的金属元素,许多铜的化合物在医药、工农业生产中有重要作用。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ ;比较Cu2+和Zn2+稳定性并分析原因:___________ 。
(2)一种铜的配合物结构如图1所示,其对肿瘤有明显的抑制作用,该配合物中几种非金属元素的电负性由大到小的顺序为___________ ,配位原子的杂化方式为___________ 。

(3)金属铜单独与氨水或过双氧水都不反应,但可与氨气和双氧水的混合溶液反应,其原因___________ 。
(4)NH3分子中H-N-H键角为107° ,在[Cu(NH3)4]2+中的H-N-H键角为109.5° ,键角变大的原因是___________ 。
(5)Cu2O 晶体结构与CsCl (图2)相似,只是利用Cu4O占据CsCl晶体中C1的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有___________ 个 “Cu2O”;Cu2O晶胞中Cu的配位数是___________ ;若①处Cu原子坐标为( ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为___________ 。

(1)基态Cu原子的价电子排布式为
(2)一种铜的配合物结构如图1所示,其对肿瘤有明显的抑制作用,该配合物中几种非金属元素的电负性由大到小的顺序为

(3)金属铜单独与氨水或过双氧水都不反应,但可与氨气和双氧水的混合溶液反应,其原因
(4)NH3分子中H-N-H键角为107° ,在[Cu(NH3)4]2+中的H-N-H键角为109.5° ,键角变大的原因是
(5)Cu2O 晶体结构与CsCl (图2)相似,只是利用Cu4O占据CsCl晶体中C1的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有
 ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】(1)依据第2周期元素第一电离能的变化规律,参照下图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______ 。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2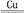 NF3+3NH4F。基态铜原子的核外电子排布式为
NF3+3NH4F。基态铜原子的核外电子排布式为________ 。
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及________ (填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________ ,阴离子的中心原子轨道采用________ 杂化。
(4)已知苯酚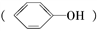 具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子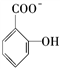 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________ Ka(苯酸)(填“>”或“<”),其原因是______________________ 。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2
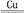 NF3+3NH4F。基态铜原子的核外电子排布式为
NF3+3NH4F。基态铜原子的核外电子排布式为(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为
(4)已知苯酚
 具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____________ ;
(2)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。请回答下列问题
①石墨烯的作用是______________________________
②电池工作时,外电路中流过0.02 mol电子,负极材料减重____________ g
③充电过程中,电池中Li2S2的量越来越少,请写出Li2S2转化为Li2S4的电极反应式:___________ 。
(3)H2Se的酸性比H2S________ (填“强”或“弱”)。气态SeO3分子的立体构型为________ ,Na2SO3溶液呈碱性的原因是_________________________________ (用离子方程式表示);
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_______________________________ ;
②H2SeO4比H2SeO3酸性强的原因:_______________________________________ 。

(2)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。请回答下列问题

①石墨烯的作用是
②电池工作时,外电路中流过0.02 mol电子,负极材料减重
③充电过程中,电池中Li2S2的量越来越少,请写出Li2S2转化为Li2S4的电极反应式:
(3)H2Se的酸性比H2S
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】填空。
(1)工业上采用向饱和食盐水中先后通入NH3和CO2的方式制取重要的化工原料纯碱。CO2的电子式是_______ ,分子中的键角为_______ ;NH3的结构式是_______ ,其分子构型为_______ 。两者中属于非极性分子的是_______ ,其所含化学键为_______ (填“极性”或“非极性”)键。
(2)氢化锂(LiH)是_______ (填“离子”或“共价”)化合物,写出其电子式_______ ,其构成微粒的半径大小关系为_______ (用微粒符号表示)。与同类型的NaH相比,_______ 的熔点高,理由是_______ 。
(3)实验数据表明,氯化铝在2.02×105Pa时熔点为190℃,且在180℃时开始升华。
①推测氯化铝是_______ (填“离子”或“共价”)化合物,导电性实验发现熔化的氯化铝不导电,氯化铝属于_______ (填“电解质”、“非电解质”或“既不是电解质也不是非电解质”)。
②实验测得氯化铝蒸气的密度折算成标准状况下为11.92g·L-1,则氯化铝的化学式为_______ 。
(1)工业上采用向饱和食盐水中先后通入NH3和CO2的方式制取重要的化工原料纯碱。CO2的电子式是
(2)氢化锂(LiH)是
(3)实验数据表明,氯化铝在2.02×105Pa时熔点为190℃,且在180℃时开始升华。
①推测氯化铝是
②实验测得氯化铝蒸气的密度折算成标准状况下为11.92g·L-1,则氯化铝的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】氮族元素包括氮、磷、砷、锑、铋,它们的单质及其化合物在生产生活中具有十分重要的应用。回答下列问题:
(1)As元素原子核外电子占据的最高能层的符号是___ 。Bi3+的价层电子排布式为__ 。
(2)NH3、PH3、AsH3分子的键角大小顺序为__ 。HNO3的酸性强于HNO2的原因是__ 。
(3)我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl。其中N 为平面五边形结构,N的杂化方式为
为平面五边形结构,N的杂化方式为__ ,N 离子中含有的大
离子中含有的大 键表示为
键表示为__ ,该盐中所含元素的电负性大小顺序为____ ,H3O+的空间构型是___ 。
(4)氨硼烷(NH3BH3)是种具有潜力的固体储氢材料,分子中接受电子对的原子是___ 。与氨硼烷互为等电子体的分子是的___ (写名称),其熔点比(NH3BH3低,原因是___ 。
(5)PCl5固体是离子化合物,是由PCl 和PCl
和PCl 组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为___ g•cm-3(写出数学表达式)。
(1)As元素原子核外电子占据的最高能层的符号是
(2)NH3、PH3、AsH3分子的键角大小顺序为
(3)我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl。其中N
 为平面五边形结构,N的杂化方式为
为平面五边形结构,N的杂化方式为 离子中含有的大
离子中含有的大 键表示为
键表示为(4)氨硼烷(NH3BH3)是种具有潜力的固体储氢材料,分子中接受电子对的原子是
(5)PCl5固体是离子化合物,是由PCl
 和PCl
和PCl 组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
组成,晶体结构和氯化铯类似。假设P原子间的最短距离为anm,则PCl5固体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在该晶胞中,X离子的价电子排布图为_______ ,与X离子距离最近的Y离子数目为_______ 。
②该化合物的化学式为_______ 。若其晶胞边长为540.0pm,则密度为_______ 。(列出计算式即可)
(2)Z与氢可形成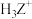 ,
,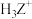 的空间构型为
的空间构型为_______ (用文字描述)。
(3)Y与Z可形成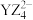 ,
,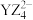 中Y原子的杂化类型为
中Y原子的杂化类型为_______ 。
(4)X的氯化物与氨水反应可形成配合物 ,0.5mol该配合物中含有
,0.5mol该配合物中含有 键的数目为
键的数目为_______ 。
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在该晶胞中,X离子的价电子排布图为
②该化合物的化学式为
(2)Z与氢可形成
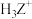 ,
,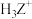 的空间构型为
的空间构型为(3)Y与Z可形成
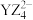 ,
,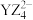 中Y原子的杂化类型为
中Y原子的杂化类型为(4)X的氯化物与氨水反应可形成配合物
 ,0.5mol该配合物中含有
,0.5mol该配合物中含有 键的数目为
键的数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】据报道纳米晶在生物医学领域有很大需求。我国科研团队以 作保护气,油酸等为溶剂,用氧化镉(CdO)和硒、硫前驱体制得纳米晶CdS、CdSe。回答下列问题:
作保护气,油酸等为溶剂,用氧化镉(CdO)和硒、硫前驱体制得纳米晶CdS、CdSe。回答下列问题:
(1)Cd与Zn同族,均位于元素周期表中___________ 区;基态N原子电子排布式为___________ 。
(2)O、S、Se的最简单氢化物沸点由高到低的顺序为___________ (填分子式)。
(3) 比
比 更易分解,由此可知键能N-H
更易分解,由此可知键能N-H___________ C-H(填“>”、“=”或“<”)。
(4)已知油酸结构简式为 。油酸中各元素电负性由大到小的顺序为
。油酸中各元素电负性由大到小的顺序为___________ ,其中碳原子的杂化方式为___________ 。
(5)CdS、CdSe的立方晶胞结构相似(如下图,图示不表示原子相对大小)。

①CdSe晶胞中,Cd原子位于由Se原子构成的___________ (填“正四面体”、“正六面体”或“正八面体”)空隙中,Se原子配位数为___________ 。
②CdS的晶胞参数为a pm,阿伏加德罗常数的值为 ,该晶胞的密度为
,该晶胞的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 作保护气,油酸等为溶剂,用氧化镉(CdO)和硒、硫前驱体制得纳米晶CdS、CdSe。回答下列问题:
作保护气,油酸等为溶剂,用氧化镉(CdO)和硒、硫前驱体制得纳米晶CdS、CdSe。回答下列问题:(1)Cd与Zn同族,均位于元素周期表中
(2)O、S、Se的最简单氢化物沸点由高到低的顺序为
(3)
 比
比 更易分解,由此可知键能N-H
更易分解,由此可知键能N-H(4)已知油酸结构简式为
 。油酸中各元素电负性由大到小的顺序为
。油酸中各元素电负性由大到小的顺序为(5)CdS、CdSe的立方晶胞结构相似(如下图,图示不表示原子相对大小)。

①CdSe晶胞中,Cd原子位于由Se原子构成的
②CdS的晶胞参数为a pm,阿伏加德罗常数的值为
 ,该晶胞的密度为
,该晶胞的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



