我国科学家创造了一种用于卫星的世界最纯的砷化镓样品。第IIIA和VA族元素可组成多种半导体材料。回答下列问题:
(1)基态砷原子电子排布简式为[Ar]_______ 。
(2)砷与硒、溴位于同周期,第一电离能由大到小排序为_______ (填元素符号)。
(3)硼、铝、镓位于同主族,电负性由小到大排序为_______ (填元素符号)。 、
、 都是有机合成的重要还原剂,
都是有机合成的重要还原剂, 中B的杂化轨道类型是
中B的杂化轨道类型是_______ , 的空间构型是
的空间构型是_______ 。
(4)1 mol 含
含_______ mol配位键。
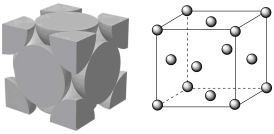
(5)镓的一种氧化物晶胞如图1所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体心)。该氧化物的化学式为
在1、2、3、4、5、6构成的八面体心)。该氧化物的化学式为_______ ;在该晶胞中 的配位数为
的配位数为_______ 。该晶胞中正八面体空隙中阳离子填充率为_______ (用分数表示)。

(6)砷化镓晶胞如图2所示,砷化镓的熔点为1238℃,它的晶体类型是_______ 。已知砷化镓晶体密度为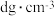 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。x和y原子键长为
。x和y原子键长为_______ nm。

(1)基态砷原子电子排布简式为[Ar]
(2)砷与硒、溴位于同周期,第一电离能由大到小排序为
(3)硼、铝、镓位于同主族,电负性由小到大排序为
 、
、 都是有机合成的重要还原剂,
都是有机合成的重要还原剂, 中B的杂化轨道类型是
中B的杂化轨道类型是 的空间构型是
的空间构型是(4)1 mol
 含
含(5)镓的一种氧化物晶胞如图1所示,
 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体心)。该氧化物的化学式为
在1、2、3、4、5、6构成的八面体心)。该氧化物的化学式为 的配位数为
的配位数为
(6)砷化镓晶胞如图2所示,砷化镓的熔点为1238℃,它的晶体类型是
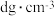 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。x和y原子键长为
。x和y原子键长为
更新时间:2022-07-06 11:48:07
|
相似题推荐
【推荐1】短周期元素W、X、Y和Z的原子序数依次增大。金属元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。
(1)W元素的原子核外共有________ 种不同运动状态的电子、_______ 种不同能量的电子。
(2)元素Z与元素X形成共价化合物XZ2是________ (选填“极性”或“非极性”)分子,其电子式为 ________________ 。
(3)Y原子的最外层电子排布式为________________ ,Y元素最高价氧化物对应的水化物的电离方程式为 ________________________________________________ 。
(4)两种非金属元素中,非金属性较强的元素是_______ (写元素符号),试写出一个能说明这一事实的化学方程式______________________________ 。
(1)W元素的原子核外共有
(2)元素Z与元素X形成共价化合物XZ2是
(3)Y原子的最外层电子排布式为
(4)两种非金属元素中,非金属性较强的元素是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态; B、C的价电子层中未成对电子数都是2;B、C、D同周期; 核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的
核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的  价离子
价离子 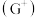 的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出 E的 L层电子排布式___________ 。
(2)B与 C可形成化合物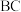 和
和 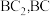 的结构式为
的结构式为___________ ; 属于
属于___________ (填“极性”或非极性”)分子, 晶胞如图所示,已知晶胞参数为
晶胞如图所示,已知晶胞参数为 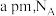 为阿伏加德罗常数,则
为阿伏加德罗常数,则  的密度
的密度  表达式为
表达式为___________  。
。
(3)由元素 A、C、G组成的离子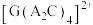 在水溶液中显天蓝色,该离子的空间构型为
在水溶液中显天蓝色,该离子的空间构型为_____ ,加入过量的氨水,溶液变为深蓝色,再加入少量乙醇,用玻璃棒摩擦容器内壁,析出深蓝色晶体。请比较两种配离子的稳定性,并解释原因:______ 。
(4)测定 A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_____ 。
(5)D离子与 离子不共存,生成一种含配位键的阴离子,该离子的化学式为
离子不共存,生成一种含配位键的阴离子,该离子的化学式为___________ 。
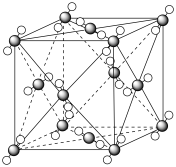
(6)G的晶胞结构如图,G的配位数为______ ,求算该晶体的空间利用率为_______ (用含  的代数式表示)。
的代数式表示)。
 核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的
核外的 s、p能级的电子总数相等; F与E同周期且第一电离能比E小; G的  价离子
价离子 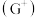 的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
的各层电子全充满。回答下列问题:(相关问题用元素符号表示)(1)写出 E的 L层电子排布式
(2)B与 C可形成化合物
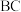 和
和 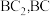 的结构式为
的结构式为 属于
属于 晶胞如图所示,已知晶胞参数为
晶胞如图所示,已知晶胞参数为 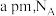 为阿伏加德罗常数,则
为阿伏加德罗常数,则  的密度
的密度  表达式为
表达式为 。
。
(3)由元素 A、C、G组成的离子
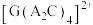 在水溶液中显天蓝色,该离子的空间构型为
在水溶液中显天蓝色,该离子的空间构型为(4)测定 A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是
(5)D离子与
 离子不共存,生成一种含配位键的阴离子,该离子的化学式为
离子不共存,生成一种含配位键的阴离子,该离子的化学式为(6)G的晶胞结构如图,G的配位数为
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐3】Ⅰ.变化观和平衡观视角认识物质
(1)工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.

Ⅱ.

①已知:298K时,相关物质的相对能量如图1,反应Ⅰ的 为
为_________ 。
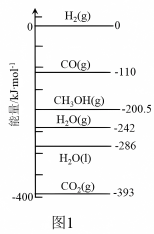
②不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图2所示。压强p1、p2、p3由大到小的顺序是___________ 。压强为p1时,温度高于300℃之后,随着温度升高CO2平衡转化率增大的原因 ___________ 。

(2)能说明反应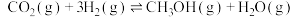 ,已达平衡状态的是 ___________
,已达平衡状态的是 ___________ 填字母
填字母 。
。
Ⅱ.从微粒结构视角认识物质
(3)基态Fe2+的核外电子排布式为_______ ;第四周期元素中,基态原子未成对电子数与Co相等的有 ___________  填元素符号
填元素符号 。
。
(4)利用配合物的特征颜色可检验补铁药片中的Fe3+和Fe2+,部分配合物的结构如下:

①取等量碾碎的药片放入两支试管中,试管1加盐酸溶解,试管2加等体积蒸馏水溶解。分别滴加KSCN溶液,发现试管1溶液变红,试管2溶液不变色。依据图示信息,解释SCN-检验Fe3+须在酸性条件下进行的原因_______ 。
②邻二氮菲中N原子的价层孤电子对占据_______ 。 填标号
填标号 。
。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
(1)工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.


Ⅱ.


①已知:298K时,相关物质的相对能量如图1,反应Ⅰ的
 为
为
②不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如图2所示。压强p1、p2、p3由大到小的顺序是

(2)能说明反应
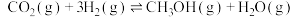 ,已达平衡状态的是 ___________
,已达平衡状态的是 ___________ 填字母
填字母 。
。A.单位时间内生成1mol  的同时消耗了1mol 的同时消耗了1mol  |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |
Ⅱ.从微粒结构视角认识物质
(3)基态Fe2+的核外电子排布式为
 填元素符号
填元素符号 。
。(4)利用配合物的特征颜色可检验补铁药片中的Fe3+和Fe2+,部分配合物的结构如下:

①取等量碾碎的药片放入两支试管中,试管1加盐酸溶解,试管2加等体积蒸馏水溶解。分别滴加KSCN溶液,发现试管1溶液变红,试管2溶液不变色。依据图示信息,解释SCN-检验Fe3+须在酸性条件下进行的原因
②邻二氮菲中N原子的价层孤电子对占据
 填标号
填标号 。
。A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
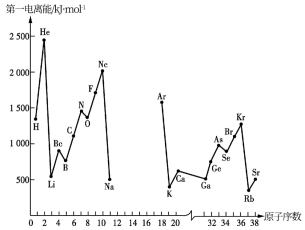
【推荐1】电离能是衡量元素失电子能力的重要依据,随着元素核电荷数的递增,电离能值呈现周期性变化规律。根据 所学知识,回答下列问题。
 第一电离能指的是
第一电离能指的是______ 。
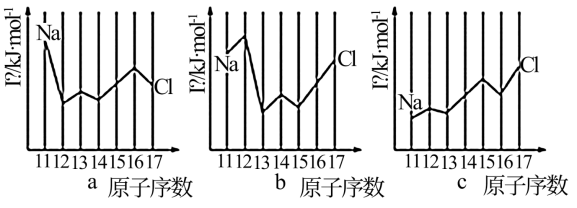
 如图是部分元素原子的第一电离能
如图是部分元素原子的第一电离能  随原子序数变化关系
随原子序数变化关系 其中 12 号至 17 号元素的有关数据缺失
其中 12 号至 17 号元素的有关数据缺失 。
。
 根据图示变化规律,可推测 S 的第一电离能的大小
根据图示变化规律,可推测 S 的第一电离能的大小 最小
最小 范围为
范围为______ 
______  填元素符号
填元素符号 。
。
 据图可知,同主族元素原子第一电离能
据图可知,同主族元素原子第一电离能  变化规律是
变化规律是______ 。
 图中第一电离能最小的元素在周期表中的位置
图中第一电离能最小的元素在周期表中的位置______ 。
 根据对角线规则铍元素最高价氧化物的水化物应该具有
根据对角线规则铍元素最高价氧化物的水化物应该具有______ 。
 用 In 表示元素的第 n 电离能,则图中的 a、b、c 分别代表
用 In 表示元素的第 n 电离能,则图中的 a、b、c 分别代表______ 。
A.a 为 、b 为
、b 为  、c 为
、c 为 
B.a 为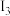 、b 为
、b 为  、c 为
、c 为 
C.a 为 、b 为
、b 为 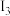 、c 为
、c 为  D.a 为
D.a 为  、b 为
、b 为 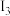 、c 为
、c 为 
 铜、锌两种元素的第一电离能、第二电离能如表所示:
铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第一电离能 小于锌的第一电离能,而铜的第二电离能
小于锌的第一电离能,而铜的第二电离能 却大于锌的第二电离能,其主要原因是
却大于锌的第二电离能,其主要原因是______ 。
 与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能
与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能 ,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能
,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能 ,部分元素或离子的电 子亲和能数据如下表所示:
,部分元素或离子的电 子亲和能数据如下表所示:
 下列说法中错误的是
下列说法中错误的是______ 。
A.元素的电子亲和能越大,越容易得到电子
B.一个基态的气态氧原子得到一个电子成为 时放出 141kJ 的能量
时放出 141kJ 的能量
C.氧元素的第二电子亲和能是
D.基态的气态氧原子得到两个电子成为 需要吸收能量
需要吸收能量
 图中数据显示,同主族元素
图中数据显示,同主族元素 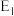 从上到下依次减小,其原因是
从上到下依次减小,其原因是_____ 。
 第一电离能指的是
第一电离能指的是 如图是部分元素原子的第一电离能
如图是部分元素原子的第一电离能  随原子序数变化关系
随原子序数变化关系 其中 12 号至 17 号元素的有关数据缺失
其中 12 号至 17 号元素的有关数据缺失 。
。 根据图示变化规律,可推测 S 的第一电离能的大小
根据图示变化规律,可推测 S 的第一电离能的大小 最小
最小 范围为
范围为
 填元素符号
填元素符号 。
。 据图可知,同主族元素原子第一电离能
据图可知,同主族元素原子第一电离能  变化规律是
变化规律是 图中第一电离能最小的元素在周期表中的位置
图中第一电离能最小的元素在周期表中的位置 根据对角线规则铍元素最高价氧化物的水化物应该具有
根据对角线规则铍元素最高价氧化物的水化物应该具有 用 In 表示元素的第 n 电离能,则图中的 a、b、c 分别代表
用 In 表示元素的第 n 电离能,则图中的 a、b、c 分别代表
A.a 为
 、b 为
、b 为  、c 为
、c 为 
B.a 为
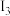 、b 为
、b 为  、c 为
、c 为 
C.a 为
 、b 为
、b 为 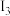 、c 为
、c 为  D.a 为
D.a 为  、b 为
、b 为 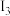 、c 为
、c 为 
 铜、锌两种元素的第一电离能、第二电离能如表所示:
铜、锌两种元素的第一电离能、第二电离能如表所示:电离能 |  |  |
| Cu | 746 | 1958 |
| Zn | 906 | 1733 |
 小于锌的第一电离能,而铜的第二电离能
小于锌的第一电离能,而铜的第二电离能 却大于锌的第二电离能,其主要原因是
却大于锌的第二电离能,其主要原因是 与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能
与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能 ,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能
,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能 ,部分元素或离子的电 子亲和能数据如下表所示:
,部分元素或离子的电 子亲和能数据如下表所示:| 元素 | Cl | Br | I | O |  |
电子亲和能 | 349 | 343 | 295 | 141 |  |
 下列说法中错误的是
下列说法中错误的是A.元素的电子亲和能越大,越容易得到电子
B.一个基态的气态氧原子得到一个电子成为
 时放出 141kJ 的能量
时放出 141kJ 的能量C.氧元素的第二电子亲和能是

D.基态的气态氧原子得到两个电子成为
 需要吸收能量
需要吸收能量 图中数据显示,同主族元素
图中数据显示,同主族元素 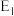 从上到下依次减小,其原因是
从上到下依次减小,其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】主族元素 、
、 、
、 、
、 、
、 等的某些化合物对工农业生产意义重大,回答下列问题:
等的某些化合物对工农业生产意义重大,回答下列问题:
(1) 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为___________ , 的第一电离能比
的第一电离能比 的第一电离能大的原因为
的第一电离能大的原因为___________ 。
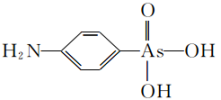
(2)阿散酸(如图)是一种饲料添加剂,能溶于 溶液中,常含有
溶液中,常含有 、
、 等杂质,该结构中
等杂质,该结构中 的杂化方式为
的杂化方式为___________ , 的空间构型为
的空间构型为___________ 。
(3)液氨可作制冷剂,汽化时吸收大量的热的原因是___________ 。
(4) 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为
形成配位数为6的配合物,且相应两种配体的物质的量之比为 ,
, 该配合物溶于水,加入足量的硝酸银溶液可得
该配合物溶于水,加入足量的硝酸银溶液可得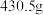 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为___________ 。
(5) 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。

① 中
中 的配位数为
的配位数为___________ 。
②若该晶体的晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度
的密度
___________ (列出表达式) 。
。
 、
、 、
、 、
、 、
、 等的某些化合物对工农业生产意义重大,回答下列问题:
等的某些化合物对工农业生产意义重大,回答下列问题:(1)
 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为 的第一电离能比
的第一电离能比 的第一电离能大的原因为
的第一电离能大的原因为(2)阿散酸(如图)是一种饲料添加剂,能溶于
 溶液中,常含有
溶液中,常含有 、
、 等杂质,该结构中
等杂质,该结构中 的杂化方式为
的杂化方式为 的空间构型为
的空间构型为
(3)液氨可作制冷剂,汽化时吸收大量的热的原因是
(4)
 能与
能与 、
、 形成配位数为6的配合物,且相应两种配体的物质的量之比为
形成配位数为6的配合物,且相应两种配体的物质的量之比为 ,
, 该配合物溶于水,加入足量的硝酸银溶液可得
该配合物溶于水,加入足量的硝酸银溶液可得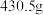 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为(5)
 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。
①
 中
中 的配位数为
的配位数为②若该晶体的晶胞参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度
的密度
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)砷与磷为同一主族元素,砷的原子序数为________________ 。
(2)根据元素周期律,下列说法正确的是__________________ 。
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______ 。
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:

若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为________ (写元素名称),它在周期表中的位置为______ 。
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为________ 。
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为______ 。
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为______ 。

(7)某铁的化合物结构简式如图所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为______ 。
(1)砷与磷为同一主族元素,砷的原子序数为
(2)根据元素周期律,下列说法正确的是
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:

若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为

(7)某铁的化合物结构简式如图所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______ 。
(2)氢负离子H-基态电子排布式为_______ 。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________ 。
(4)几种碱金属氢化物的部分性质如下表所示:
从化学结构的角度回答说明,分解温度LiH>NaH>KH___ 。
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___ ,请画出H5O2+的结构式:______ 。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______ 。

(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___ 个,设阿伏加 德罗常数为NA,则晶体的密度为___ g·cm-3。

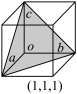
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___ 个。
(1)太阳中的主要化学元素是氢和
(2)氢负离子H-基态电子排布式为
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为
(4)几种碱金属氢化物的部分性质如下表所示:
| 氢化物 | LiH | NaH | KH |
| 密度/g/cm3 | 0.78 | 1.43 | |
| 分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是

(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有

(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】“嫦娥五号”首次实现了我国地外天体采样返回,它的成功发射标志着我国航天向前迈出了一大步。“嫦娥五号”的制作材料中包含了Ti、Fe、Al、Cr、Ni、Mo、S、O等多种元素。回答下列问题:
(1)Al、S、O三种元素的电负性由大到小的顺序为___________ ;基态Fe2+最高能级中成对电子与单电子的数目比为___________ 。
(2)S与O可形成多种氧化物和酸根离子,其中 的空间构型为
的空间构型为___________ ,其键角小于 的原因为
的原因为___________ ,SO3中S原子的杂化轨道类型为___________ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀(如图),该反应可用于检验Ni2+。丁二酮肟镍中存在的化学键___________ 有(填标号)。

a.离子键 b.配位键 c.共价键 d.金属键 e. 氢键
(4)Al2O3是“嫦娥五号”中用到的一种耐火材料,Al2O3熔点高(2054℃),其主要原因为___________ 。
(5)某铬铝合金的晶胞具有体心四方结构(长方体结构),其结构如图所示,则该合金的化学式为___________ 。设Al和Cr原子半径分别为r1和r2,则金属原子空间占有率为___________ ×100%(列出计算表达式)。[已知:r1、r2和a、b的单位均相同;图中黑色小球代表Al原子;白色小球代表Cr原子;金属原子的空间占有率 ]
]

(1)Al、S、O三种元素的电负性由大到小的顺序为
(2)S与O可形成多种氧化物和酸根离子,其中
 的空间构型为
的空间构型为 的原因为
的原因为(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀(如图),该反应可用于检验Ni2+。丁二酮肟镍中存在的化学键

a.离子键 b.配位键 c.共价键 d.金属键 e. 氢键
(4)Al2O3是“嫦娥五号”中用到的一种耐火材料,Al2O3熔点高(2054℃),其主要原因为
(5)某铬铝合金的晶胞具有体心四方结构(长方体结构),其结构如图所示,则该合金的化学式为
 ]
]
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】过渡金属及其配合物在生产、生活中有着广泛的应用。请回答下列问题。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的铁原子,其价电子的自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的铁原子,其价电子的自旋磁量子数的代数和为_______ 。
(2)Fe、Co的第四电离能分别为5290 kJ/mol、4950 kJ/mol,铁的第四电离能大于钴的第四电离能的主要原因是_______ 。
(3)Fe能与CO形成配合物Fe(CO)6,在形成配位键时CO中C提供孤电子对,而不是O提供孤电子对,其主要原因可能是_______ 。
(4)铁常见的两种氧化物为FeO、Fe2O3,FeO的熔点比Fe2O3低的原因是_______ 。
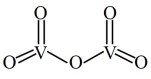
(5)端位原子不影响分子构型,所以我们通常只讨论影响分子构型的原子的杂化类型。V2O5的分子结构如图所示,1个V2O5分子中参与杂化的O原子杂化方式为_______ 。V2O5分子中含有的δ键和π键的数目比为_______ 。
(6)反型钛钙矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
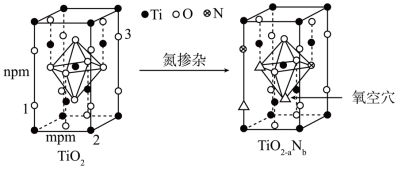
则TiO2-aNb晶体中a=_______ 。已知原子1、2 的分数坐标为(0,0, )和(1,0,0),则原子3的坐标为
)和(1,0,0),则原子3的坐标为_______ ,设阿伏加德罗常数的值为NA,则TiO2的密度为_______ g·cm-3(列出计算式)。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的铁原子,其价电子的自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的铁原子,其价电子的自旋磁量子数的代数和为(2)Fe、Co的第四电离能分别为5290 kJ/mol、4950 kJ/mol,铁的第四电离能大于钴的第四电离能的主要原因是
(3)Fe能与CO形成配合物Fe(CO)6,在形成配位键时CO中C提供孤电子对,而不是O提供孤电子对,其主要原因可能是
(4)铁常见的两种氧化物为FeO、Fe2O3,FeO的熔点比Fe2O3低的原因是
(5)端位原子不影响分子构型,所以我们通常只讨论影响分子构型的原子的杂化类型。V2O5的分子结构如图所示,1个V2O5分子中参与杂化的O原子杂化方式为

(6)反型钛钙矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=
 )和(1,0,0),则原子3的坐标为
)和(1,0,0),则原子3的坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)
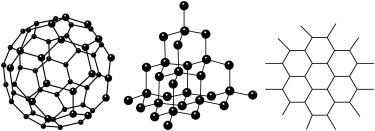
(1)C60、金刚石和石墨三者的关系互为_________
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于__________ 晶体(填“离子”、“原子”或“分子”)。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅的单键的数目约是________ NA个。二氧化硅的结构相当于在硅晶体结构中每个硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅氧原子形成的最小环上氧原子的数目是__________ 。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是__________ 。

(1)C60、金刚石和石墨三者的关系互为
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅的单键的数目约是
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】镁、铜、硼及其化合物在医药、国防、材料领域应用广泛。请回答下列问题:
(1)铜是重要的金属材料铜属于元素周期表中的___________ 区元素,与铜同周期且基态原子最外层未成对电子数与基态铜原子相同的元素有___________ 种。
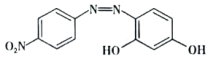
(2)镁元素是人体必需的微量元素,其中起作用的是 。碱性条件下,检验
。碱性条件下,检验 是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为
是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为___________ (用元素符号表示),分子中N原子的杂类型为___________ 。
(3)氨硼烷 是一种安全、高效的储氢材料,可由反应
是一种安全、高效的储氢材料,可由反应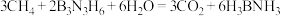 制得。
制得。
①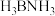 的结构与乙烷相似,
的结构与乙烷相似,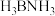 中存在配位键,提供孤电子对形成配位键的原子是
中存在配位键,提供孤电子对形成配位键的原子是___________ (填元素符号)。
② 的空间构型为
的空间构型为___________ , 的键角小于
的键角小于 的键角,原因为
的键角,原因为___________ 。
(4)一种由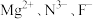 组成的化合物的立方晶胞如图所示:
组成的化合物的立方晶胞如图所示:

①该化合物的化学式为___________ , 的配位数为
的配位数为___________ 。
② 填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为
填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为___________  。
。
③若距离最近的两个 的核间距为
的核间距为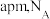 表示阿伏加德罗常数的值,则晶胞密度为
表示阿伏加德罗常数的值,则晶胞密度为___________  。
。
(1)铜是重要的金属材料铜属于元素周期表中的
(2)镁元素是人体必需的微量元素,其中起作用的是
 。碱性条件下,检验
。碱性条件下,检验 是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为
是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为
(3)氨硼烷
 是一种安全、高效的储氢材料,可由反应
是一种安全、高效的储氢材料,可由反应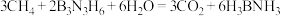 制得。
制得。①
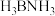 的结构与乙烷相似,
的结构与乙烷相似,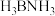 中存在配位键,提供孤电子对形成配位键的原子是
中存在配位键,提供孤电子对形成配位键的原子是②
 的空间构型为
的空间构型为 的键角小于
的键角小于 的键角,原因为
的键角,原因为(4)一种由
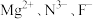 组成的化合物的立方晶胞如图所示:
组成的化合物的立方晶胞如图所示:
①该化合物的化学式为
 的配位数为
的配位数为②
 填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为
填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为 。
。③若距离最近的两个
 的核间距为
的核间距为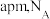 表示阿伏加德罗常数的值,则晶胞密度为
表示阿伏加德罗常数的值,则晶胞密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】Ga与B、Al处于同一主族,氮化镓是制造LED的重要材料,被誉为第三代半导体材料。回答下列问题:
(1)基态Ga原子的价电子排布式为___________ 。
(2)Be、B、C的电负性由小到大的顺序为___________ ,第一电离能由小到大的顺序为___________ 。
(3)①乙硼烷( )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是___________ 。 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子___________ 。 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因___________ 。
③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是___________ 。
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为___________ ,晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Ga原子的价电子排布式为
(2)Be、B、C的电负性由小到大的顺序为
(3)①乙硼烷(
 )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子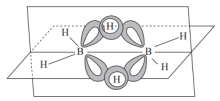
 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为
 (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。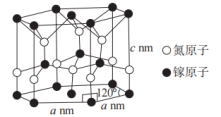
您最近一年使用:0次



