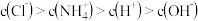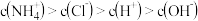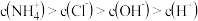下列说法正确的是( )
| A.常温下,将pH=3的醋酸溶液加水稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| D.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-) |
12-13高二下·福建厦门·期中 查看更多[2]
更新时间:2016-12-09 04:29:53
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】相同温度下,关于pH=3的①CH3COOH溶液②HCl溶液③NH4Cl溶液的比较,下列说法正确的是
| A.溶液①和②中:c(CH3COO-)=c(Cl-);溶液①和③中:c(CH3COO-)=c(NH4+) |
| B.水的电离程度:③>①=② |
| C.和足量氢氧化钠溶液恰好完全反应,消耗氢氧化钠的量:②>③ |
| D.将溶液①和②等体积混合后,pH<3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是
A.测得0.1mol/L的一元碱ROH溶液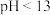 ,则ROH一定为弱电解质 ,则ROH一定为弱电解质 |
B.可溶性正盐BA溶液 ,升温后pH仍为a,则BA可能为强碱弱酸盐 ,升温后pH仍为a,则BA可能为强碱弱酸盐 |
C.中和等体积、等pH的NaOH和 溶液,消耗盐酸的物质的量之比为1∶2 溶液,消耗盐酸的物质的量之比为1∶2 |
D. 的盐酸溶液与 的盐酸溶液与 的醋酸溶液按体积比1∶9混合,所得溶液 的醋酸溶液按体积比1∶9混合,所得溶液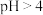 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
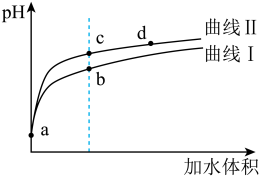
【推荐1】常温下,向10mL0.1mol/L的某酸(HA) 溶液中逐滴加入0.1mol/L的氨水,所得溶液的pH及导电能力与加入氨水的体积关系如图所示。下列说法中不正确的是
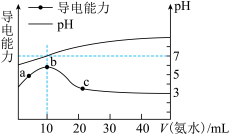

| A.HA为弱酸 |
| B.b点对应溶液pH=7,此时HA溶液与氨水恰好完全反应 |
| C.c点对应的溶液存在c(OH-)=c(H+)+c(HA) |
| D.a、b、c三点中,b点对应的溶液中水的电离程度最大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】以NA表示阿伏加德罗常数的值,下列说法正确的是
A.将53.5g氯化铵固体溶于水,溶液中NH 的数目小于NA 的数目小于NA |
| B.常温下,1L0.1mol.L-1的CH3COOH溶液中,体系中H+的数目为0.1NA |
| C.足量18mol/L浓硫酸与65gZn粉反应,反应中转移电子数小于2NA |
| D.常温下,pH=5的盐酸溶液中水电离出的H+数目为10-9NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】25℃时,用0.1 NaOH溶液分别滴定20.00mL0.1
NaOH溶液分别滴定20.00mL0.1 醋酸和20mL0.1
醋酸和20mL0.1 盐酸,滴定曲线如图所示,下列说法正确的是
盐酸,滴定曲线如图所示,下列说法正确的是
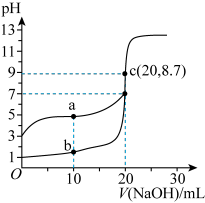
 NaOH溶液分别滴定20.00mL0.1
NaOH溶液分别滴定20.00mL0.1 醋酸和20mL0.1
醋酸和20mL0.1 盐酸,滴定曲线如图所示,下列说法正确的是
盐酸,滴定曲线如图所示,下列说法正确的是
A.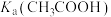 的数量级为 的数量级为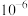 |
| B.溶液中水的电离程度:c>b>a |
C.b点所表示溶液中: |
D.a点所表示溶液中: |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】某兴趣小组探究二氧化硫使品红溶液褪色的原因。实验结论不正确 的是
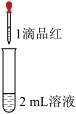

| 试管中的液体 | 现象 |
a.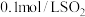 溶液 溶液 | 溶液逐渐变浅,约 后完全褪色 后完全褪色 |
b.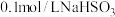 溶液 溶液 | 溶液立即变浅,约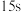 后完全褪色 后完全褪色 |
c.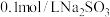 溶液 溶液 | 溶液立即褪色 |
d.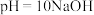 溶液 溶液 | 红色溶液不变色 |
| A.实验b中亚硫酸氢根离子电离程度大于其水解程度使溶液显酸性 |
B.实验c中: |
| C.实验cd证明氢氧根离子对品红溶液褪色不产生干扰 |
D.实验abc说明 使品红溶液褪色时起主要作用的微粒是亚硫酸氢根离子 使品红溶液褪色时起主要作用的微粒是亚硫酸氢根离子 |
您最近一年使用:0次

 ,某盐酸的
,某盐酸的 ,已知
,已知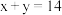 ,且
,且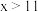 。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是