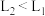已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4,现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是

| A.曲线Ⅱ为氢氟酸稀释时pH变化曲线 |
| B.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小 |
| C.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
D.从b点到d点,溶液中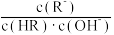 保持不变(HR代表HClO或HF) 保持不变(HR代表HClO或HF) |
2022高三·全国·专题练习 查看更多[8]
(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题(已下线)专项特训5 弱电解质电离常数计算与图像分析江苏省常熟市王淦昌高级中学2022-2023学年高二3月月考化学试题江西省永修县第一中学2023-2024学年高二上学期10月月考化学试题第1讲 弱电解质的电离平衡江西省南昌市第一中学2023-2024学年高二上学期10月月考化学试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
更新时间:2022-09-28 10:57:23
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列说法正确的是
| A.常温下,pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
B.常温下,水电离出的c(H+)=10-13mol/L的溶液可能与含Fe3+、NH 的溶液不共存 的溶液不共存 |
C.加入铝粉能产生H2的溶液中,可能存在大量的 Na+、Ba2+、Fe2+、AlO 、NO 、NO |
| D.pH=4的醋酸溶液,稀释至10倍后pH=5 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,某实验人员在两个相同的容器中分别加入20 mL 0.2 mol/LNa2A溶液和40 mL 0.1 mol/L NaHA溶液,再分别用0.2mol/L盐酸滴定,利用pH计和压力传感器检测,绘制曲线如图所示。(H2A溶液达到某浓度后,会放出一定量气体)下列说法正确的是(溶液体积变化可忽略)

| A.图中曲线乙和丁代表向NaHA溶液中滴加盐酸 |
| B.由图可知,Ka1×Ka2>Kw |
| C.c点pH约为8,且此时溶液中满足:c(Na+)+c(H+)<2c(A2-)+2c(H2A)+c(HA-) |
| D.水的电离程度:b点>d点 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】①c(H+)=0.01mol/L的CH3COOH溶液; ②c(H+)=0.01mol/L的H2SO4溶液;③c(OH—)=0.01mol/L的氨水; ④c(OH—)=0.01mol/L的NaOH溶液。室温条件下,有关上述溶液的比较中,正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.将②、④溶液混合后,pH=7,消耗溶液的体积:②<④ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向10 mL上述四溶液中各加入90 mL水后,溶液的pH:③>④>①>② |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,用0.2 mol/LNaOH溶液分别滴定相同浓度的一元酸HX溶液和HY溶液,滴定过程中溶液的pH变化关系如图所示。下列说法正确的是


| A.等物质的量浓度的NaX、NaY的溶液,NaY溶液碱性较强 |
| B.pH与体积均相等的HX、HY中和NaOH的能力:HX>HY |
| C.常温下K(X)的数量级为10-9 |
| D.将b点溶液加水稀释10倍可得到c点对应的溶液 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】下列说法中正确的是
A.25 ℃时,向水中加入少量固体NH4Cl,水的电离平衡:H2O H++OH-正向移动,c(H+)降低 H++OH-正向移动,c(H+)降低 |
B.室温下向10 mL pH=3的醋酸溶液中加水稀释后,溶液中 不变 不变 |
| C.0.1 mol·L-1的HCN溶液加水稀释后,溶液中所有离子的浓度均减小 |
D.已知0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+,加少量烧碱固体可使溶液 CH3COO-+H+,加少量烧碱固体可使溶液 增大 增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】某温度时,分别调节0. 01 mol· L-1 HCOOH溶液、0.01 mol· L-1氨水的pH,系统中各种粒子浓度的负对数值(-lg c)与pH的关系如图所示。下列说法不正确的是
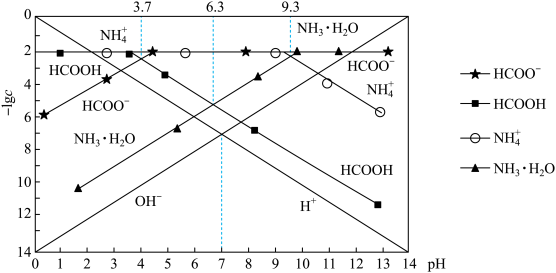
| A.该温度下氨水的电离平衡常数Kb=10-4.7 |
| B.该温度下,0.01 mol· L-1 HCOOH溶液的pH为3.7 |
| C.用标准HCOOH溶液滴定一定浓度的NH3·H2O溶液用甲基橙作指示剂 |
D.向HCOONa溶液中加入KHSO3溶液至溶液呈中性:c(HCOOH) +c(H2SO3)= c(SO ) ) |
您最近一年使用:0次

 的NaOH溶液滴定
的NaOH溶液滴定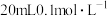 的HA溶液。溶液中,含A微粒a、b的分布系数δ、NaOH溶液的体积V与pH的关系如图所示。已知:HA的分布系数
的HA溶液。溶液中,含A微粒a、b的分布系数δ、NaOH溶液的体积V与pH的关系如图所示。已知:HA的分布系数 。下列叙述错误的是
。下列叙述错误的是

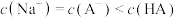
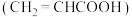 和硫氰酸
和硫氰酸 都是一元酸,已知:
都是一元酸,已知: ,常温下,等体积、
,常温下,等体积、 的两种酸溶液加水稀释,溶液
的两种酸溶液加水稀释,溶液 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
 为
为 稀释的曲线
稀释的曲线 的量:
的量: