苯是重要的化工产品,也是化工原料,在生产中有广泛应用。回答下列问题:
已知: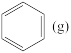 +H2(g)
+H2(g) 
反应I: ++H2(g)
++H2(g) 
 (1,
(1,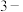 环己二烯;g)
环己二烯;g) 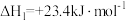
反应II: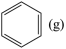 +2H2(g)
+2H2(g) 
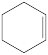 (g)
(g) 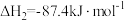
反应III: +3H2(g)
+3H2(g) 
 (g)
(g) 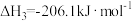
(1)反应: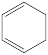 (1,3-环己二烯;g)+H2(g)
(1,3-环己二烯;g)+H2(g) 
 (g)
(g)
_______  ;苯的稳定性比1,
;苯的稳定性比1,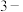 环已二烯
环已二烯_______ (填“强”或“弱”)。
(2)一定温度下,向恒容密闭容器中充入 苯蒸气和
苯蒸气和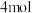 氢气,在催化剂镍的条件下同时发生反应I、II、III,下列叙述正确的是_______(填标号)。
氢气,在催化剂镍的条件下同时发生反应I、II、III,下列叙述正确的是_______(填标号)。
(3)在体积相等、温度相同的甲、乙两个容器中起始都投入 苯蒸气和
苯蒸气和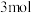 氢气,只发生反应III
氢气,只发生反应III
用“>”、“<”或“=”填空:
①
_______  ;②
;②
_______  ;③
;③
_______  。
。
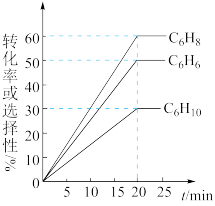
(4)一定温度下,向密闭容器中充入 苯(g)和
苯(g)和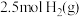 同时发生反应I、II、III,测得苯的转化率和产物选择性如图所示(某一产物的选择性
同时发生反应I、II、III,测得苯的转化率和产物选择性如图所示(某一产物的选择性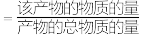 ),已知:平衡时气体总压强为
),已知:平衡时气体总压强为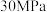 。
。 时1,
时1,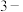 环己二烯的分压为
环己二烯的分压为_______  。上述反应I的平衡常数
。上述反应I的平衡常数
_______ (以分压表示,分压=总压×物质的量分数) 。
。
(5)对苯醌( )是制备口腔消毒剂的原料。以硫酸和硫酸钠的混合溶液为电解质溶液,用惰性电极电解苯可以制备对苯醌。则阳极的电极反应式为
)是制备口腔消毒剂的原料。以硫酸和硫酸钠的混合溶液为电解质溶液,用惰性电极电解苯可以制备对苯醌。则阳极的电极反应式为_______ 。
已知:
 +H2(g)
+H2(g) 
反应I:
 ++H2(g)
++H2(g) 
 (1,
(1,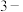 环己二烯;g)
环己二烯;g) 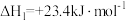
反应II:
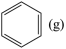 +2H2(g)
+2H2(g) 
 (g)
(g) 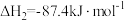
反应III:
 +3H2(g)
+3H2(g) 
 (g)
(g) 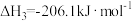
(1)反应:
 (1,3-环己二烯;g)+H2(g)
(1,3-环己二烯;g)+H2(g) 
 (g)
(g)
 ;苯的稳定性比1,
;苯的稳定性比1, 环已二烯
环已二烯(2)一定温度下,向恒容密闭容器中充入
 苯蒸气和
苯蒸气和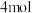 氢气,在催化剂镍的条件下同时发生反应I、II、III,下列叙述正确的是_______(填标号)。
氢气,在催化剂镍的条件下同时发生反应I、II、III,下列叙述正确的是_______(填标号)。| A.气体密度不变时反应达到平衡状态 |
| B.混合气体中环己烷的体积分数可能等于50% |
| C.平衡后再充入少量氢气,平衡向正反应方向移动 |
| D.增大催化剂镍的质量,反应速率和苯的转化率都会增大 |
 苯蒸气和
苯蒸气和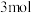 氢气,只发生反应III
氢气,只发生反应III| 容器 | 甲 | 乙 |
| 反应条件 | 恒温恒容 | 绝热恒容 |
| 苯蒸气的平衡转化率 |  |  |
| 平衡时正反应速率 |  |  |
| 平衡常数 |  |  |
①

 ;②
;②
 ;③
;③
 。
。(4)一定温度下,向密闭容器中充入
 苯(g)和
苯(g)和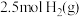 同时发生反应I、II、III,测得苯的转化率和产物选择性如图所示(某一产物的选择性
同时发生反应I、II、III,测得苯的转化率和产物选择性如图所示(某一产物的选择性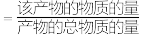 ),已知:平衡时气体总压强为
),已知:平衡时气体总压强为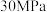 。
。 时1,
时1,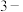 环己二烯的分压为
环己二烯的分压为 。上述反应I的平衡常数
。上述反应I的平衡常数
 。
。
(5)对苯醌(
 )是制备口腔消毒剂的原料。以硫酸和硫酸钠的混合溶液为电解质溶液,用惰性电极电解苯可以制备对苯醌。则阳极的电极反应式为
)是制备口腔消毒剂的原料。以硫酸和硫酸钠的混合溶液为电解质溶液,用惰性电极电解苯可以制备对苯醌。则阳极的电极反应式为
22-23高三上·河北沧州·阶段练习 查看更多[2]
更新时间:2022-10-28 18:16:13
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________ (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
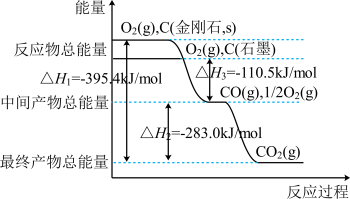
在通常状况下,金刚石和石墨中________ (填“金刚石”或“石墨”)更稳定.
(3)二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
a.CO(g)+2H2(g) CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
b.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
①反应a在__________ (填“低温”或“高温”)下易自发进行。
②写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________ 。
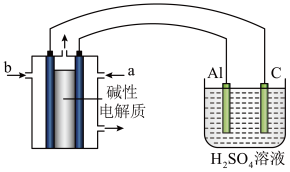
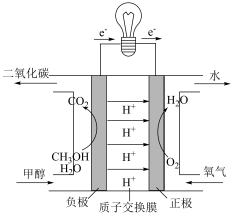
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝 化”处理过程(装置如图所示)。其中物质b是
化”处理过程(装置如图所示)。其中物质b是__________ , 阳极电极反应为__________________________________________________ 。
(1)下列做法有助于能源“开源节流”的是
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

在通常状况下,金刚石和石墨中
(3)二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
a.CO(g)+2H2(g)
 CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1b.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l回答下列问题:
①反应a在
②写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝
 化”处理过程(装置如图所示)。其中物质b是
化”处理过程(装置如图所示)。其中物质b是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】燃煤烟气中含有大量SO2和NO,某科研小组研究SO2和NO的吸收方法。
回答下列问题:
(1)已知SO2(g)+O3(g) SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
NO(g)+O3(g) NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1
则反应SO3(g)+NO(g) SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=________ kJ· mol-1
(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g) NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。
①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=________ ;若其它条件保持不变,在恒压条件下进行,则平衡时NO的转化率α2________ α1(填“>”“<”或“=”)
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向________ (填“正”或“逆”)方向移动
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是________ ,t6时刻改变的条件是________ ,t4时刻改变条件后v(正) ________ v(逆)(填“>”“<”或“=”)

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42- CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
①25℃时,0.1mol·L-1(NH4)2SO3溶液呈________ (填“酸性”“碱性”或“中性”)。
②计算第2步反应的平衡常数K=________ (列出计算式即可)。
回答下列问题:
(1)已知SO2(g)+O3(g)
 SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1NO(g)+O3(g)
 NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1 则反应SO3(g)+NO(g)
 SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g)
 NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-
 CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。①25℃时,0.1mol·L-1(NH4)2SO3溶液呈
②计算第2步反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲烷作为--种清洁能源在化学领域有着广泛的应用,请回答下列问题:
(1)高炉冶铁是利用甲烷在催化反应室中产生的水煤气(CO和H2)来还原氧化铁,甲烷催化过程中发生的反应为CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+260 kJ/mol
已知:2CO(g) +O2(g)=2CO2(g) △H =-566 kJ/mol.
则CH4与O2反应生成CO和H2的热化学方程式为___________________ 。
(2)一定温度下,向2 L的恒容密闭容器中通入等量的CH4和H2O(g),发生反应:CH4 (g)+H2O(g)⇌CO(g)+3H2(g) △H>0,CH4的物质的量浓度与时间的关系如图所示。
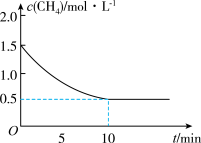
①0~10 min内,CO的平均反应速率v(CO)=_____________ 。
②该温度下反应的平衡常数K的数值为_________________ 。
(3)甲烷燃料电池(电解质溶液为KOH溶液)的装置如图所示:
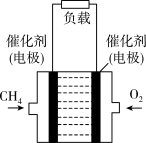
通CH4的电极为______ 极;正极反应式为_________________ 。
(1)高炉冶铁是利用甲烷在催化反应室中产生的水煤气(CO和H2)来还原氧化铁,甲烷催化过程中发生的反应为CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+260 kJ/mol
已知:2CO(g) +O2(g)=2CO2(g) △H =-566 kJ/mol.
则CH4与O2反应生成CO和H2的热化学方程式为
(2)一定温度下,向2 L的恒容密闭容器中通入等量的CH4和H2O(g),发生反应:CH4 (g)+H2O(g)⇌CO(g)+3H2(g) △H>0,CH4的物质的量浓度与时间的关系如图所示。

①0~10 min内,CO的平均反应速率v(CO)=
②该温度下反应的平衡常数K的数值为
(3)甲烷燃料电池(电解质溶液为KOH溶液)的装置如图所示:

通CH4的电极为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】“碳一化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。一定温度下,在容积为2L的密闭容器中充入1mol CO2与3mol H2,发生下列反应:
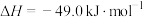
(1)一定温度下,上述反应在恒容密闭容器中达到平衡状态。下列说法正确的是___________。
(2)若反应10min时达到平衡, 的转化率为50%,则用
的转化率为50%,则用 来表示反应从开始到平衡过程中的平均反应速率是
来表示反应从开始到平衡过程中的平均反应速率是___________ 。
(3) 还可与
还可与 制取,其原理为
制取,其原理为 。在密闭容器中通入等物质的量的
。在密闭容器中通入等物质的量的 与
与 ,在一定条件下发生反应,测得
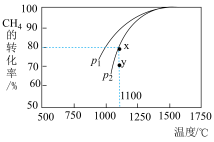
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
___________ (填“>”或“<”) ;
; 时y点:
时y点: (正)
(正)___________ (填“>”、“”或“=”) (逆)。
(逆)。
(4)根据上述信息,在恒温恒容的密闭容器中通入 的混合气体,发生上述反应。下列一定能说明该反应达到平衡状态的是___________。
的混合气体,发生上述反应。下列一定能说明该反应达到平衡状态的是___________。
(5)如图所示,甲醇燃料电池以甲醇为燃料,产生二氧化碳并实现化学能到电能的转化。则该电池中,甲醇发生___________ 反应,负极的电极反应式为___________ 。

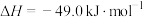
(1)一定温度下,上述反应在恒容密闭容器中达到平衡状态。下列说法正确的是___________。
| A.加入催化剂,活化分子百分数不变 |
B.再额外通入适量 , , 的平衡转化率减小 的平衡转化率减小 |
C.充入少量氦气, 的平衡浓度减小 的平衡浓度减小 |
D.升高温度,正逆反应速率与 的平衡浓度均减小 的平衡浓度均减小 |
(2)若反应10min时达到平衡,
 的转化率为50%,则用
的转化率为50%,则用 来表示反应从开始到平衡过程中的平均反应速率是
来表示反应从开始到平衡过程中的平均反应速率是(3)
 还可与
还可与 制取,其原理为
制取,其原理为 。在密闭容器中通入等物质的量的
。在密闭容器中通入等物质的量的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 ;
; 时y点:
时y点: (正)
(正) (逆)。
(逆)。
(4)根据上述信息,在恒温恒容的密闭容器中通入
 的混合气体,发生上述反应。下列一定能说明该反应达到平衡状态的是___________。
的混合气体,发生上述反应。下列一定能说明该反应达到平衡状态的是___________。| A.混合气体的平均相对分子质量不再变化 | B.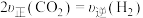 |
| C.混合气体的密度不再变化 | D.物质的总质量不再变化 |
(5)如图所示,甲醇燃料电池以甲醇为燃料,产生二氧化碳并实现化学能到电能的转化。则该电池中,甲醇发生

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】乙二醛又名草酸醛,在医药、石化、轻工等方面有广泛的用途。
I.乙二醛可由乙醛硝酸氧化法制备.研究其他条件不变时,仅改变一个条件对乙二醛制备的影响,获得如下数据。
表格:其他条件相同时, 对反应的影响
对反应的影响
(1)补全乙醛硝酸氧化法制备乙二醛原理的方程式:______________ 。

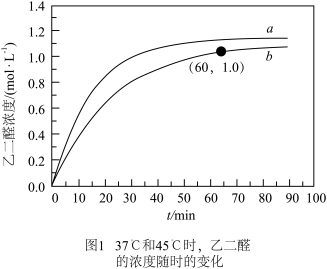
(2)图1中曲线b对应的温度为______ ℃,该温度下, 内的平均反应速率约为
内的平均反应速率约为_____ mol/(L·h)(保留2位有效数字)。
(3)根据表格知,当反应中没有添加 时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:
时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:_________________ 。
II.乙二醛制备乙醛酸(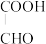 ),装置如图所示:
),装置如图所示:
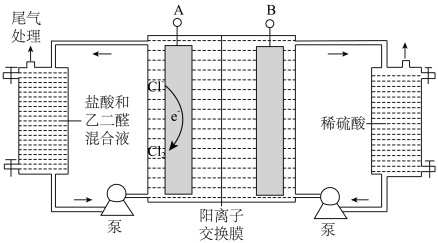
(4)与电源负极相连的是_______ (“A”或“B”)。
(5)结合化学用语解释制备乙醛酸的反应原理:_____ 。
(6)制得的乙醛酸溶液中通常含有乙二酸杂质,写出产生乙二酸的化学方程式:_________ 。
I.乙二醛可由乙醛硝酸氧化法制备.研究其他条件不变时,仅改变一个条件对乙二醛制备的影响,获得如下数据。

表格:其他条件相同时,
 对反应的影响
对反应的影响 用量(g) 用量(g) | 乙醛转化率(%) | 乙二醛 | |
| 选择性(%) | 收率(%) | ||
| 0.5 | 65.2 | 75.9 | 49.5 |
| 0.2 | 72.9 | 65.6 | 47.8 |
| 0.1 | 71.5 | 68.1 | 48.7 |
| 0 | 59.5 | 4.6 | 2.7 |
(1)补全乙醛硝酸氧化法制备乙二醛原理的方程式:

(2)图1中曲线b对应的温度为
 内的平均反应速率约为
内的平均反应速率约为(3)根据表格知,当反应中没有添加
 时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:
时,乙二醛的选择性及收率均极低。请分析乙二醛的选择性及收率均极低的原因:II.乙二醛制备乙醛酸(
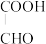 ),装置如图所示:
),装置如图所示:
(4)与电源负极相连的是
(5)结合化学用语解释制备乙醛酸的反应原理:
(6)制得的乙醛酸溶液中通常含有乙二酸杂质,写出产生乙二酸的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】有两个容积相等的密闭容器A和B如图所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时两容器中分别充入等量且体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等。在400 ℃条件下,发生如下反应:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
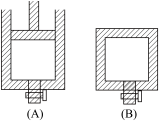
(1)达到平衡时,所需的时间t(A)________ t(B),A容器中SO2的转化率__________ B容器中SO2的转化率(填“大于”、“小于或“相等”)。
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡________ 移动,B容器中化学平衡________ 移动(填“向左”、“向右”或“不”)。
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3)__________ ,B容器中SO3的质量分数________ (填“增大”、“减少”或“不变”)。
 2SO3(g)。
2SO3(g)。
(1)达到平衡时,所需的时间t(A)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为
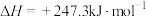 。回答下列问题:
。回答下列问题:
(1)将原料按初始组成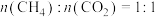 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如下图所示。
体积分数与温度的关系如下图所示。
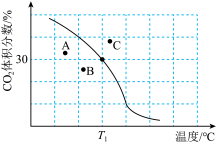
①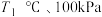 下,
下, (平衡时气体)
(平衡时气体)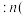 初始气体
初始气体
___________ ;该温度下,此反应的平衡常数
___________ (以分压表示,列出计算式)。
②若A、B、C三点表示不同温度和压强下已达平衡时 的体积分数,
的体积分数,___________ 点对应的平衡常数最小,理由是___________ ;___________ 点对应压强最大,理由是___________ 。
(2) 下,将
下,将 和
和 的混合气体(投料比
的混合气体(投料比 )按一定流速通过盛有炭催化剂的反应器,测得
)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
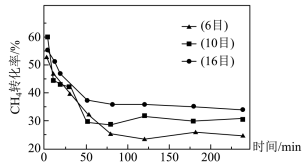
由图可知,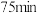 后
后 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为
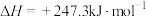 。回答下列问题:
。回答下列问题:(1)将原料按初始组成
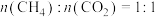 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应,达到平衡时
发生反应,达到平衡时 体积分数与温度的关系如下图所示。
体积分数与温度的关系如下图所示。
①
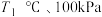 下,
下, (平衡时气体)
(平衡时气体)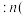 初始气体
初始气体

②若A、B、C三点表示不同温度和压强下已达平衡时
 的体积分数,
的体积分数,(2)
 下,将
下,将 和
和 的混合气体(投料比
的混合气体(投料比 )按一定流速通过盛有炭催化剂的反应器,测得
)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
的转化率受炭催化剂颗粒大小的影响如下图所示。(注:目数越大,表示炭催化剂颗粒越小)
由图可知,
 后
后 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研发二氧化碳利用技术,降低空气中远氧化碳含量是现在的研究热点。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。已知:
①

②
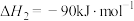
③

回答下列问题:
(1)
_________ 。
(2)在200℃恒容密闭容器中,加入2mol 和6mol
和6mol ,发生上述反应,初始压强10kPa.反应达平衡时,
,发生上述反应,初始压强10kPa.反应达平衡时, 的转化率为75%,容器压强为7.5kPa,则
的转化率为75%,容器压强为7.5kPa,则 的物质的量为
的物质的量为_________ mol,CO的物质的量为_________ mol。反应①的平衡常数
_________ 。
(3)一定条件下,向1L恒容密闭容器充入0.23mol 和0.19mol
和0.19mol ,选择合适催化剂使之只发生反应③,相同时间内
,选择合适催化剂使之只发生反应③,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:
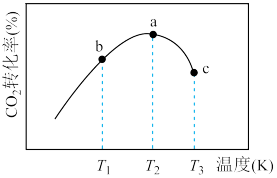
①b点
_________  ,c点
,c点
_________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②不同温度下的平衡常数,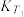
_________ 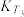 。
。
③a点为图像中最高点,a点的转化率比c点高的原因是_________ 。
④平衡时测得生成甲醇0.03mol,保持温度不变再通入0.1mol 和0.1mol水蒸气,此时平衡将
和0.1mol水蒸气,此时平衡将_________ (填“正向移动”“逆向移动”或“不移动”)。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。已知:
①


②

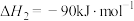
③


回答下列问题:
(1)

(2)在200℃恒容密闭容器中,加入2mol
 和6mol
和6mol ,发生上述反应,初始压强10kPa.反应达平衡时,
,发生上述反应,初始压强10kPa.反应达平衡时, 的转化率为75%,容器压强为7.5kPa,则
的转化率为75%,容器压强为7.5kPa,则 的物质的量为
的物质的量为
(3)一定条件下,向1L恒容密闭容器充入0.23mol
 和0.19mol
和0.19mol ,选择合适催化剂使之只发生反应③,相同时间内
,选择合适催化剂使之只发生反应③,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:
①b点

 ,c点
,c点
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②不同温度下的平衡常数,
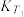
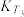 。
。③a点为图像中最高点,a点的转化率比c点高的原因是
④平衡时测得生成甲醇0.03mol,保持温度不变再通入0.1mol
 和0.1mol水蒸气,此时平衡将
和0.1mol水蒸气,此时平衡将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】 是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
(1)已知:①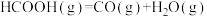
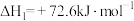
②
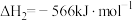
③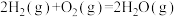
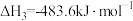
则 的
的
_______  。
。
(2)恒温恒容条件下,向密闭容器中充入1
 和2
和2
 合成
合成 ,下列叙述正确的是_______(填字母)。
,下列叙述正确的是_______(填字母)。
(3)一定温度下,保持总压强为2.0 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性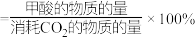 。该温度下,
。该温度下, 的平衡常数
的平衡常数
_______  。
。
(4)常温下,向 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
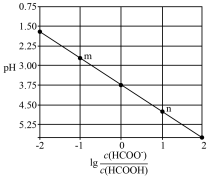
则
_______ ,n点溶液中离子浓度由大到小的排序为_______ 。
(5)常温下,已知 一元酸HCOOH(甲酸)溶液中
一元酸HCOOH(甲酸)溶液中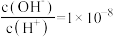 。
。
①
 的
的
_______ 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是_______ (填序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的
C.稀释后甲酸的电离度会增大
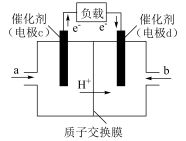
(6)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如图。则d电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。
 是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:(1)已知:①
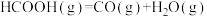
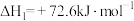
②

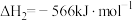
③
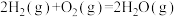
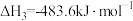
则
 的
的
 。
。(2)恒温恒容条件下,向密闭容器中充入1

 和2
和2
 合成
合成 ,下列叙述正确的是_______(填字母)。
,下列叙述正确的是_______(填字母)。| A.气体压强不随时间变化时达到平衡状态 |
B.平衡时 的最大体积分数为50% 的最大体积分数为50% |
C.平衡后及时移走 ,平衡常数增大 ,平衡常数增大 |
D.平衡后再充入 , , 的平衡转化率增大 的平衡转化率增大 |
(3)一定温度下,保持总压强为2.0
 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性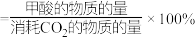 。该温度下,
。该温度下, 的平衡常数
的平衡常数
 。
。(4)常温下,向
 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
则

(5)常温下,已知
 一元酸HCOOH(甲酸)溶液中
一元酸HCOOH(甲酸)溶液中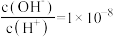 。
。①

 的
的
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的

C.稀释后甲酸的电离度会增大
(6)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如图。则d电极是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化碳的综合利用是环保领域研究的热点课题。
Ⅰ. 经过催化氢化合成低碳烯烃。
经过催化氢化合成低碳烯烃。
合成乙烯的反应为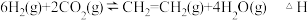
(1)已知几种化学键键能如下表所示:
则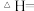
___________ (用含字母的代数式表示)。
(2)反应温度、投料比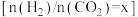 对
对 平衡转化率的影响如图1。
平衡转化率的影响如图1。
①
___________ 3(填“>”“<”或“=”,下同); 、
、 两点反应的平衡常数
两点反应的平衡常数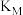
___________  。
。
②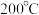 时,往
时,往 刚性密闭容器中加入
刚性密闭容器中加入 、
、 ,反应
,反应 达到平衡,则反应开始和平衡时的总压强比为
达到平衡,则反应开始和平衡时的总压强比为___________ 。
(3)某新型催化剂对 合成低碳烯烃在不同反应温度下的催化性能如图2。
合成低碳烯烃在不同反应温度下的催化性能如图2。
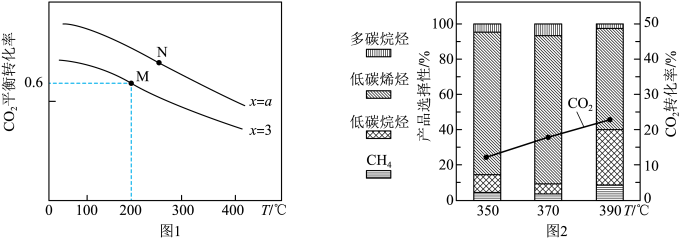
由图2可知,该反应最适宜的温度为___________ ,理由为___________ 。
Ⅱ. 经过电解转化为化工原料
经过电解转化为化工原料 。
。
(4)图3所示固体氧化物电解池利用具有优良催化活性的电极共电解 。
。
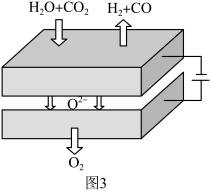
①阴极生成氢气的电极反应式为___________ 。
②电解过程中还伴随着积碳反应 。以下说法正确的是
。以下说法正确的是___________ (填标号)。
a.生成的碳覆盖在电极表面,影响电极的催化活性
b.生成的碳使电解效率降低
c.生成的碳会和电解产生的氧气反应
Ⅰ.
 经过催化氢化合成低碳烯烃。
经过催化氢化合成低碳烯烃。合成乙烯的反应为
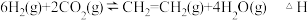
(1)已知几种化学键键能如下表所示:
| 物质 |  |  |  |  |  |
能量 |  |  |  |  |  |
则
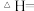
(2)反应温度、投料比
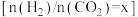 对
对 平衡转化率的影响如图1。
平衡转化率的影响如图1。①

 、
、 两点反应的平衡常数
两点反应的平衡常数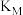
 。
。②
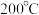 时,往
时,往 刚性密闭容器中加入
刚性密闭容器中加入 、
、 ,反应
,反应 达到平衡,则反应开始和平衡时的总压强比为
达到平衡,则反应开始和平衡时的总压强比为(3)某新型催化剂对
 合成低碳烯烃在不同反应温度下的催化性能如图2。
合成低碳烯烃在不同反应温度下的催化性能如图2。
由图2可知,该反应最适宜的温度为
Ⅱ.
 经过电解转化为化工原料
经过电解转化为化工原料 。
。(4)图3所示固体氧化物电解池利用具有优良催化活性的电极共电解
 。
。
①阴极生成氢气的电极反应式为
②电解过程中还伴随着积碳反应
 。以下说法正确的是
。以下说法正确的是a.生成的碳覆盖在电极表面,影响电极的催化活性
b.生成的碳使电解效率降低
c.生成的碳会和电解产生的氧气反应
您最近一年使用:0次
【推荐2】科学家一直致力于“人工固氮”的研究,现已有多种方法。
【方法一】1918年,德国化学家哈伯因发明工业合成氨【N2(g)+3H2(g) 2NH3(g) H<0】的方法而荣获诺贝尔化学奖。
2NH3(g) H<0】的方法而荣获诺贝尔化学奖。
(1)若将1molN2和3molH2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为_____ mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是____ 。
a. v(N2)正=3v(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________ 。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
【方法二】1998年,两位希腊化学家提出了电解合成氨的新思路:
(4)采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:

钯电极A是电解池的___ 极(填“阳”或“阴”),阳极反应式为________ 。
【方法三】最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
(5)写出上述固氮反应的热化学方程式___________ 。
【方法一】1918年,德国化学家哈伯因发明工业合成氨【N2(g)+3H2(g)
 2NH3(g) H<0】的方法而荣获诺贝尔化学奖。
2NH3(g) H<0】的方法而荣获诺贝尔化学奖。(1)若将1molN2和3molH2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是
a. v(N2)正=3v(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
【方法二】1998年,两位希腊化学家提出了电解合成氨的新思路:
(4)采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:

钯电极A是电解池的
【方法三】最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
(5)写出上述固氮反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮、碳及其化合物与人类生产生活联系密切,根据要求回答问题。
(1)N2的结构式为___________ 。
(2)如图为N2和O2反应生成NO过程中的能量变化图:
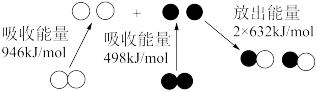
根据图示写出反应的热化学方程式:___________ 。
(3)利用CH4可以将氮的氧化物还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -802 kJ/mol
结合(2)计算反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)的△H=___________ kJ/mol。
(4)工业处理尾气二氧化氮通常用氢氧化钠吸收,吸收液经电解处理后排出,流程如下:

①若要在实验室配制100 mL 0.2 mol·L-1 NaOH溶液,可称取__________ g NaOH固体,用蒸馏水在___________ 中溶解,完全溶解后,全部转移至100 mL的___________ 中,加蒸馏水至___________ 。
②写出一个吸收室中发生反应的离子方程式:___________ 。
③写出生成N2的电极反应式:___________ 。
(1)N2的结构式为
(2)如图为N2和O2反应生成NO过程中的能量变化图:
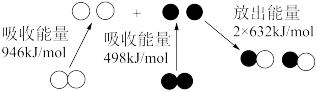
根据图示写出反应的热化学方程式:
(3)利用CH4可以将氮的氧化物还原为N2。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -802 kJ/mol
结合(2)计算反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)的△H=
(4)工业处理尾气二氧化氮通常用氢氧化钠吸收,吸收液经电解处理后排出,流程如下:

①若要在实验室配制100 mL 0.2 mol·L-1 NaOH溶液,可称取
②写出一个吸收室中发生反应的离子方程式:
③写出生成N2的电极反应式:
您最近一年使用:0次



