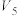甲烷水蒸气催化重整是制备高纯氢的方法之一、反应如下:
反应i.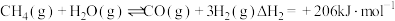 ;
;
反应ii.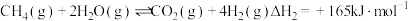
回答下列问题:
(1)反应ⅲ: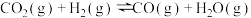 的
的
_______  ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高 平衡转化率的措施有
平衡转化率的措施有_______ (写出一条即可)
(2)对于反应i,向体积为 的恒容密闭容器中,按
的恒容密闭容器中,按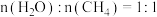 投料。
投料。
①若在恒温条件下,反应达到平衡时 的转化率为50%,则平衡时容器内的压强与起始压强之比为
的转化率为50%,则平衡时容器内的压强与起始压强之比为_______ (最简单整数比)。
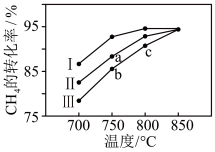
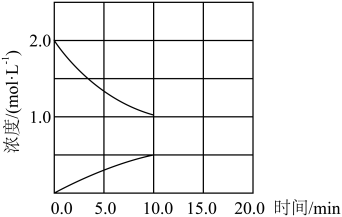
②其他条件相同时,在不同催化剂(I、II、III)作用下,反应相同时间, 的转化率随反应温度的变化如图所示。a点
的转化率随反应温度的变化如图所示。a点_______ (填“是”或“不是”)化学平衡状态, 的转化率:c点>b点,原因可能是
的转化率:c点>b点,原因可能是_______
(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程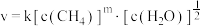 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
 的反应级数
的反应级数
_______ ,当实验2进行到某时刻,测得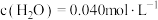 ,则此时的反应速率
,则此时的反应速率
_______  (保留3位有效数字,已知
(保留3位有效数字,已知 )。
)。
反应i.
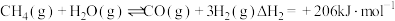 ;
;反应ii.
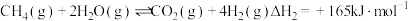
回答下列问题:
(1)反应ⅲ:
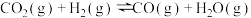 的
的
 ;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高
;若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高 平衡转化率的措施有
平衡转化率的措施有(2)对于反应i,向体积为
 的恒容密闭容器中,按
的恒容密闭容器中,按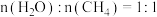 投料。
投料。①若在恒温条件下,反应达到平衡时
 的转化率为50%,则平衡时容器内的压强与起始压强之比为
的转化率为50%,则平衡时容器内的压强与起始压强之比为
②其他条件相同时,在不同催化剂(I、II、III)作用下,反应相同时间,
 的转化率随反应温度的变化如图所示。a点
的转化率随反应温度的变化如图所示。a点 的转化率:c点>b点,原因可能是
的转化率:c点>b点,原因可能是(3)某科研小组研究了反应ⅱ的动力学,获得其速率方程
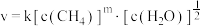 ,k为速率常数(只受温度影响),m为
,k为速率常数(只受温度影响),m为 的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:| 实验序号 | 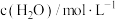 | 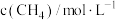 |  |
| 1 | 0.100 | 0.100 |  |
| 2 | 0.100 | 0.200 |  |
 的反应级数
的反应级数
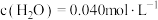 ,则此时的反应速率
,则此时的反应速率
 (保留3位有效数字,已知
(保留3位有效数字,已知 )。
)。
更新时间:2022-11-11 09:41:39
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)已知在一定温度下,下列各反应的焓变和平衡常数如下:
①C(s)+CO2(g) 2CO(g) ΔH1 K1
2CO(g) ΔH1 K1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2 K2
H2(g)+CO2(g) ΔH2 K2
③C(s)+H2O(g) CO(g)+H2(g) ΔH3 K3
CO(g)+H2(g) ΔH3 K3
则ΔH1、ΔH2、ΔH3三者关系为ΔH3=_______ ,K1、K2、K3三者关系为K3=_______ 。
(2)2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成 和
和 的反应为
的反应为
 。
。
①假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是_______ (填序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的容积
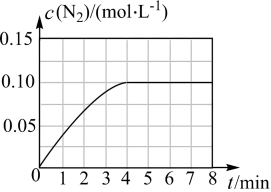
②若将1molNO和2molCO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的 物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_______ 。
(3)某密闭容器中存在反应:CO(g)+2H2(g) CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
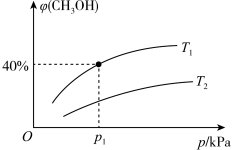
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1_______ (填“>”“<”或“=”)K2;若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1,则T1时该反应的压强平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)。
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_______ (填“>”“<”或“=”)α2。
(1)已知在一定温度下,下列各反应的焓变和平衡常数如下:
①C(s)+CO2(g)
 2CO(g) ΔH1 K1
2CO(g) ΔH1 K1②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2 K2
H2(g)+CO2(g) ΔH2 K2③C(s)+H2O(g)
 CO(g)+H2(g) ΔH3 K3
CO(g)+H2(g) ΔH3 K3则ΔH1、ΔH2、ΔH3三者关系为ΔH3=
(2)2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成
 和
和 的反应为
的反应为
 。
。①假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的容积
②若将1molNO和2molCO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的
 物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=
(3)某密闭容器中存在反应:CO(g)+2H2(g)
 CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g) ΔH<0,起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发CO2和CH4等利用技术,降低空气中二氧化碳含量成为研究热点。
(1)N2H4(肼)常用作火箭推进剂。
已知:①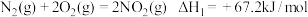
②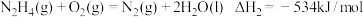 ,
,
请写出气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O反应的热化学方程式___________ 。
(2)TK时,向2L恒容密闭容器中充入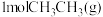 、
、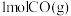 、
、 ,发生反应:
,发生反应: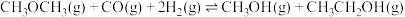 ,10min时反应达到平衡,此时CH3OH(g)的体积分数为
,10min时反应达到平衡,此时CH3OH(g)的体积分数为 ,容器内压强为pMPa。
,容器内压强为pMPa。
①0~10min内,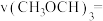
___________  ,平衡后,
,平衡后,
___________  ,
,
___________  (用平衡分压代替平衡浓度计算称为气体分压平衡常数,用Kp为表示,其中分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算称为气体分压平衡常数,用Kp为表示,其中分压=总压×物质的量分数)。
(1)N2H4(肼)常用作火箭推进剂。
已知:①
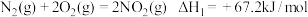
②
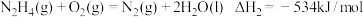 ,
,请写出气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O反应的热化学方程式
(2)TK时,向2L恒容密闭容器中充入
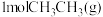 、
、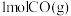 、
、 ,发生反应:
,发生反应: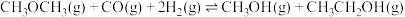 ,10min时反应达到平衡,此时CH3OH(g)的体积分数为
,10min时反应达到平衡,此时CH3OH(g)的体积分数为 ,容器内压强为pMPa。
,容器内压强为pMPa。①0~10min内,
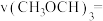
 ,平衡后,
,平衡后,
 ,
,
 (用平衡分压代替平衡浓度计算称为气体分压平衡常数,用Kp为表示,其中分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算称为气体分压平衡常数,用Kp为表示,其中分压=总压×物质的量分数)。
您最近一年使用:0次
【推荐3】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)反应①的化学平衡常数K的表达式为__________ ;
(2)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=______ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=________ kJ·mol-1。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为__________________ 。
(4)利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH_______ (填“变大”或“变小”),阴极的电极反应式为________________ 。
②每转移2mol电子,阴极室溶液质量增加______ g。
①CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2③CO2(g)+H2(g)
 CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3回答下列问题:
(1)反应①的化学平衡常数K的表达式为
(2)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为
(4)利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH
②每转移2mol电子,阴极室溶液质量增加
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】请回答下列问题:
Ⅰ.能源开发和利用是科学研究的热点课题。
(1)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:

①∆H___________ (填“>”“<”或“=”)0;
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(2)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) ∆H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) ∆H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(3)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ∆H=-49.5 kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) ∆H2=-90.4 kJ·mol-1
CH3OH(g) ∆H2=-90.4 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) ∆H3
CO(g)+H2O(g) ∆H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应③的平衡常数为___________ 。
Ⅱ.甲醇作为基础化工原料和环保动力燃料具有广阔的应用前景。由H2和CO2制备甲醇的过程中可能涉及的反应如下:
i.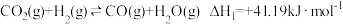
ii.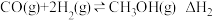
iii.
请回答下列问题。
(4)反应 iii的
___________ (填“<”“=”或“>”)0;反应II的 =
=___________ 。
(5)在某密闭容器中,充入一定量的H2和CO2(假设仅发生反应III),其他条件不变,实验测得在不同温度下,反应体系中CO2的平衡转化率随压强的变化情况如图所示。
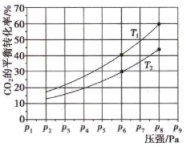
①下列不能说明反应iii已达到平衡状态的是___________ (填序号)。
A.断裂3 mol H—H键的同时断裂2 mol H-O键 B.CH3OH的浓度不再改变
C.容器中混合气体的平均摩尔质量不变 D.恒容容器中混合气体的压强不变
②比较T1与T2的大小关系:T1___________ (填“<”“=”或“>”) T2,理由是___________ 。
Ⅰ.能源开发和利用是科学研究的热点课题。
(1)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
①∆H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(2)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) ∆H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) ∆H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(3)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ∆H=-49.5 kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g) ∆H2=-90.4 kJ·mol-1
CH3OH(g) ∆H2=-90.4 kJ·mol-1 ③CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H3
CO(g)+H2O(g) ∆H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
Ⅱ.甲醇作为基础化工原料和环保动力燃料具有广阔的应用前景。由H2和CO2制备甲醇的过程中可能涉及的反应如下:
i.
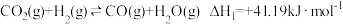
ii.
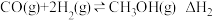
iii.

请回答下列问题。
(4)反应 iii的

 =
=(5)在某密闭容器中,充入一定量的H2和CO2(假设仅发生反应III),其他条件不变,实验测得在不同温度下,反应体系中CO2的平衡转化率随压强的变化情况如图所示。

①下列不能说明反应iii已达到平衡状态的是
A.断裂3 mol H—H键的同时断裂2 mol H-O键 B.CH3OH的浓度不再改变
C.容器中混合气体的平均摩尔质量不变 D.恒容容器中混合气体的压强不变
②比较T1与T2的大小关系:T1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①各时间段反应速率最大的是______________ (填“0~1”“1~2”“2~3”“3~4”或“4~5”)min,原因是______________________ ;
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为__________ (设溶液体积不变)。
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是 (填字母)。
(3)已知硫代硫酸钠与稀硫酸反应生成S单质和 ,反应化学方程式为:
,反应化学方程式为:

某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
①该实验Ⅰ、Ⅱ可探究温度对反应速率的影响,因此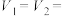
__________ ,
__________ 。
②若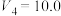 ,
, ,则实验①、③可探究
,则实验①、③可探究__________ 对反应速率的影响。
③可用热的NaOH浓溶液洗掉反应后试管中残余的固体。固体溶解时的离子方程式为______ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是 (填字母)。
| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
 ,反应化学方程式为:
,反应化学方程式为:
某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ |
| 稀 |
| ||
V/mL | c(mol/L) | V/mL | c(mol/L) | V/mL | ||
Ⅰ | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
Ⅱ | 40 |
| 0.10 |
| 0.50 |
|
Ⅲ | 20 |
| 0.10 | 4.0 | 0.50 |
|

②若
 ,
, ,则实验①、③可探究
,则实验①、③可探究③可用热的NaOH浓溶液洗掉反应后试管中残余的固体。固体溶解时的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成关于甲烷(CH4)燃料电池的填空:
(1)已知甲烷燃烧时放出大量的热,这是由于反应物的总能量_______ 生成物的总能量(选填“大于”“小于”或“等于”,下同),从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量_______ 形成产物的化学键释放的总能量。
(2)该燃料电池中负极的电极反应式为:_______ 。随着电池不断放电,当消耗标况下11.2LCH4时,转移电子数为_______ 。
(3)随着电池不断放电,氢氧化钾的物质的量浓度将_______ (增大,减小,不变)。
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
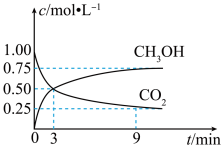
(1)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______ 。
(2)为加快化学反应速率,其他条件不变时,可采取的措施有_______ (填编号)。
A.升高温度 B.增大容器体积 C.再充入CO2气体 D保持体积不变,充入氮气使体系的压强增大
(3)如图是可逆反应X2+3Y2⇌2Z在反应过程中的反应速率(v)与时间(t)的关系曲线。下列叙述正确的是_______ 。
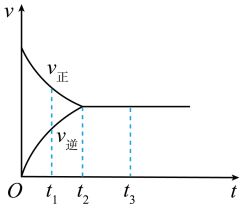
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(1)已知甲烷燃烧时放出大量的热,这是由于反应物的总能量
(2)该燃料电池中负极的电极反应式为:
(3)随着电池不断放电,氢氧化钾的物质的量浓度将
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=

(2)为加快化学反应速率,其他条件不变时,可采取的措施有
A.升高温度 B.增大容器体积 C.再充入CO2气体 D保持体积不变,充入氮气使体系的压强增大
(3)如图是可逆反应X2+3Y2⇌2Z在反应过程中的反应速率(v)与时间(t)的关系曲线。下列叙述正确的是

a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可由NO与Cl2反应制得,回答下列问题:
Ⅰ.(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g)ΔH1;K1
NaNO3(s)+NOCl(g)ΔH1;K1
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NO(g)+Cl2(g) 2NOCl(g)ΔH3;K3
2NOCl(g)ΔH3;K3
则ΔH3=___________ (用ΔH1和ΔH2表示)。
Ⅱ.工业上通常用如下反应制备亚硝酰氯:2NO(g)+Cl2(g) 2NOCl(g)ΔH<0。
2NOCl(g)ΔH<0。
(2)已知上述反应中逆反应速率的表达式为v逆=k·cn(NOCl)。300℃时,测得逆反应速率与NOCl的浓度的关系如表所示:
当c(NOCl)=0.50mol·L-1时,v逆=___________ mol·L-1·s-1。
(3)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
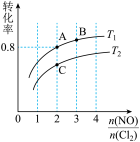
①图中T1、T2的关系为T1___________ T2(填“>”“<”或“=”);图中纵坐标为物质___________ 的转化率。图中A、B、C三点对应的NOCl体积分数最大的是___________ (填“A”“B”或“C”)。
②若容器容积为1L,B点的平衡常数为___________ 。
③若在温度为T1,容积为1L的容器中,充入0.5molNO、1molCl2、2molNOCl,υ(正)___________ υ(逆)(填“<”“>”或“=”)。
Ⅰ.(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)
 NaNO3(s)+NOCl(g)ΔH1;K1
NaNO3(s)+NOCl(g)ΔH1;K14NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K22NO(g)+Cl2(g)
 2NOCl(g)ΔH3;K3
2NOCl(g)ΔH3;K3则ΔH3=
Ⅱ.工业上通常用如下反应制备亚硝酰氯:2NO(g)+Cl2(g)
 2NOCl(g)ΔH<0。
2NOCl(g)ΔH<0。(2)已知上述反应中逆反应速率的表达式为v逆=k·cn(NOCl)。300℃时,测得逆反应速率与NOCl的浓度的关系如表所示:
| c(NOCl)/(mol/L) | v逆/(mol∙L-1∙s-1) |
| 0.20 | 1.6×10-9 |
| 0.40 | 6.4×10-9 |
(3)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为T1
②若容器容积为1L,B点的平衡常数为
③若在温度为T1,容积为1L的容器中,充入0.5molNO、1molCl2、2molNOCl,υ(正)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮氧化物是形成酸雨、水体富营养化、光化学烟雾等环境问题的主要原因。
已知:反应Ⅰ.2NO(g)+O2(g) 2NO2(g) ΔH1=-112 kJ/mol;
2NO2(g) ΔH1=-112 kJ/mol;
反应Ⅱ.2NO2(g) N2O4(g) ΔH2=-24.2 kJ/mol;
N2O4(g) ΔH2=-24.2 kJ/mol;
反应Ⅲ.3O2(g) 2O3(g) ΔH3=+144.6 kJ/mol;
2O3(g) ΔH3=+144.6 kJ/mol;
(1)大气层中O3氧化NO的热化学方程式为3NO(g)+O3(g) 3NO2(g) ΔH4=
3NO2(g) ΔH4=________ 。
(2)某温度下,向1L刚性容器中投入1mol O2发生反应Ⅲ,5min时压强变为原来的0.9倍后不再变化。
①5min内O3的生成速率v(O3)=______________________ 。
②平衡时O2的转化率α(O2)________ 30%(填“>”“=”或“<”)。
(3)常温下,向压强为pkPa的恒压容器中充入2molNO和1molO2,发生反应Ⅰ和反应Ⅱ。平衡时NO和NO2的物质的量分别为0.2mol和1mol,则常温下反应Ⅱ的平衡常数Kp=____________ kPa-1(已知气体中某成分的分压p(分)=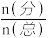 ×p(总),用含p的式子表示)。
×p(总),用含p的式子表示)。
(4)工业上常用氨气去除一氧化氮的污染,反应原理为:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+
5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+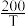 (T为开氏温度)。
(T为开氏温度)。
①该反应ΔH_______________ 0(填“>”“=”或“<”)。
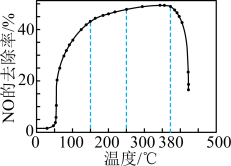
②一定温度下,按进料比n(NH3)∶n(NO)=1∶1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是______________________ ;当反应温度高于380 ℃时,NO的去除率迅速下降的原因可能是____________________ 。
已知:反应Ⅰ.2NO(g)+O2(g)
 2NO2(g) ΔH1=-112 kJ/mol;
2NO2(g) ΔH1=-112 kJ/mol;反应Ⅱ.2NO2(g)
 N2O4(g) ΔH2=-24.2 kJ/mol;
N2O4(g) ΔH2=-24.2 kJ/mol;反应Ⅲ.3O2(g)
 2O3(g) ΔH3=+144.6 kJ/mol;
2O3(g) ΔH3=+144.6 kJ/mol;(1)大气层中O3氧化NO的热化学方程式为3NO(g)+O3(g)
 3NO2(g) ΔH4=
3NO2(g) ΔH4=(2)某温度下,向1L刚性容器中投入1mol O2发生反应Ⅲ,5min时压强变为原来的0.9倍后不再变化。
①5min内O3的生成速率v(O3)=
②平衡时O2的转化率α(O2)
(3)常温下,向压强为pkPa的恒压容器中充入2molNO和1molO2,发生反应Ⅰ和反应Ⅱ。平衡时NO和NO2的物质的量分别为0.2mol和1mol,则常温下反应Ⅱ的平衡常数Kp=
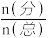 ×p(总),用含p的式子表示)。
×p(总),用含p的式子表示)。(4)工业上常用氨气去除一氧化氮的污染,反应原理为:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+
5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+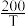 (T为开氏温度)。
(T为开氏温度)。①该反应ΔH

②一定温度下,按进料比n(NH3)∶n(NO)=1∶1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H= −574 kJ·mol−l
4NO(g)+CO2(g)+2H2O(g) △H= −574 kJ·mol−l
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H= −1160 kJ·mol−l
2N2(g)+CO2(g)+2H2O(g) △H= −1160 kJ·mol−l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________ 。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式______________________________________ 。
②10 min内该反应的速率v(CO)=__________________ ;T℃时,该化学反应的平衡常数K=_______ 。
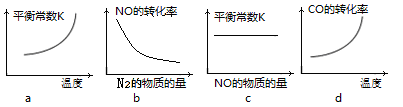
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________ 。(填序号)
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________ 。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) △H= −574 kJ·mol−l
4NO(g)+CO2(g)+2H2O(g) △H= −574 kJ·mol−l②CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) △H= −1160 kJ·mol−l
2N2(g)+CO2(g)+2H2O(g) △H= −1160 kJ·mol−l写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式
②10 min内该反应的速率v(CO)=
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)由金红石(TiO2)制取单质Ti涉及的步骤为:TiO2→TiCl4 Ti。
Ti。
已知:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的 ΔH=
TiCl4(s)+2CO(g)的 ΔH=________ 。
(2)在一定温度下,5L密闭容器中进行TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)反应,若容器中加入足量的TiO2和C后,充入0.2mol的Cl2,经过5s达到平衡时Cl2转化率为80%。
TiCl4(s)+2CO(g)反应,若容器中加入足量的TiO2和C后,充入0.2mol的Cl2,经过5s达到平衡时Cl2转化率为80%。
①计算v(CO)=_____ mol/(L·s) ,此温度下的平衡常数K=_______ 。
②用Cl2的物质的量浓度的改变来表示反应速率v正、v逆与时间的关系图,则图中阴影部分的面积为______________ 。

③以下各项不能说明该反应达到平衡状态的是____ 。
E. TiCl4与CO物质的量之比不随时间变化
④若继续充入0.2molCl2,重新达到平衡后Cl2的浓度为_________ mol/L。
(3)反应③经过10 min达到平衡,得到物质的量浓度与时间的关系如下图。若将容器的容积压缩为原来的一半,再经过5 min后重新达到平衡时的平衡常数为_______ ,若升高温度该反应的平衡常数将_______ (填:增大、减小或不变)。
 Ti。
Ti。已知:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)
 TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1则TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(s)+2CO(g)的 ΔH=
TiCl4(s)+2CO(g)的 ΔH=(2)在一定温度下,5L密闭容器中进行TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(s)+2CO(g)反应,若容器中加入足量的TiO2和C后,充入0.2mol的Cl2,经过5s达到平衡时Cl2转化率为80%。
TiCl4(s)+2CO(g)反应,若容器中加入足量的TiO2和C后,充入0.2mol的Cl2,经过5s达到平衡时Cl2转化率为80%。①计算v(CO)=
②用Cl2的物质的量浓度的改变来表示反应速率v正、v逆与时间的关系图,则图中阴影部分的面积为

③以下各项不能说明该反应达到平衡状态的是
| A.气体的密度不随时间改变 |
| B.容器中的压强不随时间变化 |
| C.CO的浓度不随时间变化 |
| D.TiCl4物质的量不随时间变化 |
④若继续充入0.2molCl2,重新达到平衡后Cl2的浓度为
(3)反应③经过10 min达到平衡,得到物质的量浓度与时间的关系如下图。若将容器的容积压缩为原来的一半,再经过5 min后重新达到平衡时的平衡常数为

您最近一年使用:0次
【推荐2】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理NO尾气通常是将NO与O2混合通入碱液中吸收。已知,一定条件下有下列反应:
Ⅰ: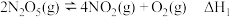
Ⅱ: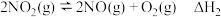
Ⅲ: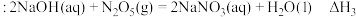
写出NO和O2的混合物溶于NaOH溶液生成硝酸盐的热化学方程式_______ 。
(2)常温下,NO极易被O2氧化为NO2温度高于423K时,NO2发生分解: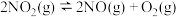
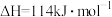 。实验测得:
。实验测得: ,
,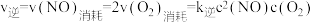 ,k正、k逆为速率常数,受温度影响。不同温度下,将NO2置于体积为VL的密闭容器中,NO2的物质的量浓度与反应时间的关系如图所示:
,k正、k逆为速率常数,受温度影响。不同温度下,将NO2置于体积为VL的密闭容器中,NO2的物质的量浓度与反应时间的关系如图所示:

①T1温度下,0~10s内,O2的反应速率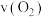 =
=_____ ,平衡常数
______ 。
②T1温度下,要减少NO2的分解,并缩短达到平衡的时间,可采取的单一措施有_______ 。
③平衡常数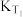
____ 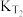 (填“大于”“小于”或“等于”,下同);反应速率
(填“大于”“小于”或“等于”,下同);反应速率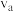
_____ 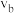 ,理由是
,理由是_____ 。
④计算c处 =
=_______ 。
(3)NO也可通过如下反应处理: ;一定条件下,平衡时N2的体积分数与压强的关系如图所示。N2的体积分数先减小后增大的原因是:
;一定条件下,平衡时N2的体积分数与压强的关系如图所示。N2的体积分数先减小后增大的原因是: _________ 。

(1)处理NO尾气通常是将NO与O2混合通入碱液中吸收。已知,一定条件下有下列反应:
Ⅰ:
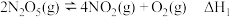
Ⅱ:
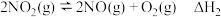
Ⅲ:
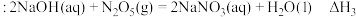
写出NO和O2的混合物溶于NaOH溶液生成硝酸盐的热化学方程式
(2)常温下,NO极易被O2氧化为NO2温度高于423K时,NO2发生分解:
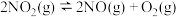
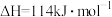 。实验测得:
。实验测得: ,
,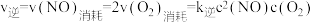 ,k正、k逆为速率常数,受温度影响。不同温度下,将NO2置于体积为VL的密闭容器中,NO2的物质的量浓度与反应时间的关系如图所示:
,k正、k逆为速率常数,受温度影响。不同温度下,将NO2置于体积为VL的密闭容器中,NO2的物质的量浓度与反应时间的关系如图所示:
①T1温度下,0~10s内,O2的反应速率
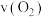 =
=
②T1温度下,要减少NO2的分解,并缩短达到平衡的时间,可采取的单一措施有
③平衡常数
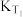
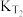 (填“大于”“小于”或“等于”,下同);反应速率
(填“大于”“小于”或“等于”,下同);反应速率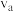
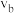 ,理由是
,理由是④计算c处
 =
=(3)NO也可通过如下反应处理:
 ;一定条件下,平衡时N2的体积分数与压强的关系如图所示。N2的体积分数先减小后增大的原因是:
;一定条件下,平衡时N2的体积分数与压强的关系如图所示。N2的体积分数先减小后增大的原因是: 
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长,因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题。
(1)氯化氢的直接氧化法为 。下图为刚性容器中,进料浓度比
。下图为刚性容器中,进料浓度比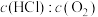 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
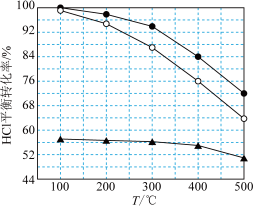
可知反应平衡常数K(200℃)______ K(300℃)(填“>”或“<”)。设HCl初始浓度为c,根据进料浓度比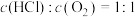 的数据计算K(400℃)=
的数据计算K(400℃)=______ (列出计算式)。按化学计量数之比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比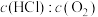 过低、过高的不利影响分别是
过低、过高的不利影响分别是_______ 、_______ 。
(2)直接氧化法可按下列催化过程进行:




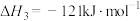
则 的
的
_______  。
。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________ (写出2种)。
(1)氯化氢的直接氧化法为
 。下图为刚性容器中,进料浓度比
。下图为刚性容器中,进料浓度比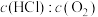 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
可知反应平衡常数K(200℃)
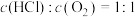 的数据计算K(400℃)=
的数据计算K(400℃)=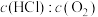 过低、过高的不利影响分别是
过低、过高的不利影响分别是(2)直接氧化法可按下列催化过程进行:





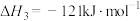
则
 的
的
 。
。(3)在一定温度的条件下,进一步提高HCl的转化率的方法是
您最近一年使用:0次

 溶液
溶液