请你查找相关数据,回答下列问题。
(1) 、
、 、
、 三种一元酸的酸性由强到弱的顺序是
三种一元酸的酸性由强到弱的顺序是_______ 。
(2)相同物质的量浓度的 溶液、
溶液、 溶液、
溶液、 溶液的
溶液的 由大到小的顺序是
由大到小的顺序是_______ 。
(3) 溶液中含有
溶液中含有_____ 微粒?请将溶液中各种离子的浓度按由大到小的顺序排列_____ 。
(4)向 溶液中加入少量盐酸,溶液中各种微粒的浓度将如何变化
溶液中加入少量盐酸,溶液中各种微粒的浓度将如何变化_____ ?
(5)加热 溶液,溶液中各种微粒的浓度将如何变化?
溶液,溶液中各种微粒的浓度将如何变化?_____
(1)
 、
、 、
、 三种一元酸的酸性由强到弱的顺序是
三种一元酸的酸性由强到弱的顺序是(2)相同物质的量浓度的
 溶液、
溶液、 溶液、
溶液、 溶液的
溶液的 由大到小的顺序是
由大到小的顺序是(3)
 溶液中含有
溶液中含有(4)向
 溶液中加入少量盐酸,溶液中各种微粒的浓度将如何变化
溶液中加入少量盐酸,溶液中各种微粒的浓度将如何变化(5)加热
 溶液,溶液中各种微粒的浓度将如何变化?
溶液,溶液中各种微粒的浓度将如何变化?
更新时间:2022-11-26 18:13:42
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。如表是某温度下几种常见弱酸的电离平衡常数:
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO 、H3PO4、H2PO
、H3PO4、H2PO 、HPO
、HPO 都看作是酸,则它们酸性最强的是
都看作是酸,则它们酸性最强的是___________ (填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为___________ 。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是___________。
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1___________ V2(填“>”、“<”或“=”)。
(5)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___________。
(6)已知100℃时,水的离子积常数Kw=1.0×10﹣12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈___________ 性。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO﹣+H+ CH3COO﹣+H+ | 2×10﹣5 |
| HClO | HClO ClO﹣+H+ ClO﹣+H+ | 3.0×10﹣8 |
| H2CO3 | H2CO3 H++HCO H++HCO HCO   H++CO H++CO | K1=4.4×10﹣7 K2=5.6×10﹣11 |
| H3PO4 | H3PO4 H++H2PO H++H2PO H2PO   H++HPO H++HPO HPO   H++PO H++PO | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO
 、H3PO4、H2PO
、H3PO4、H2PO 、HPO
、HPO 都看作是酸,则它们酸性最强的是
都看作是酸,则它们酸性最强的是(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是___________。
| A.c(H+) | B.c(H+)•c(CH3COO﹣) |
| C.c(H+)•c(OH﹣) | D. |
(5)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___________。
| A.Va>10Vb | B.Va<10Vb | C.Vb<10Va | D.Vb>10Va |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①写出H2S的Ka1的表达式:___ 。
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是___ 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是___ 。
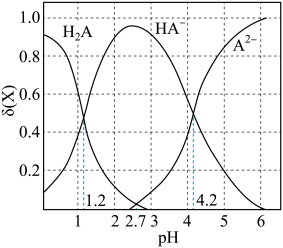
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=__ 。
(1)已知部分弱酸的电离常数如下表:
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数K(25℃) | 7.2×10-4 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
①写出H2S的Ka1的表达式:
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是
③将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
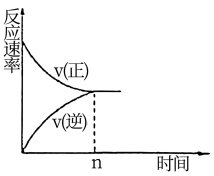
【推荐3】(1)在恒温恒压密闭容器中充入1mol N2和3 mol H2在tl时刻达到平衡状态后,继续充入2 mol NH3,在t2时刻达到平衡状态。画出v(正)和v(逆)随时间t的变化关系__________________
(2)恒温恒容时,下列不能说明合成氨反应达到平衡状态的是__________________
a.容器内N2、H2、NH3的浓度之比为1 : 3 : 2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.单位时间内断裂6mol N-H键的同时,有3mol H-H形成
(3)将上述制得的的氨气溶于水配成溶液,25℃时,将amol/L的氨水与bmol/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数Kb__________________ (写出详细计算过程)

(2)恒温恒容时,下列不能说明合成氨反应达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1 : 3 : 2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.单位时间内断裂6mol N-H键的同时,有3mol H-H形成
(3)将上述制得的的氨气溶于水配成溶液,25℃时,将amol/L的氨水与bmol/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数Kb
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__ 性,溶液中c(Na+)__ c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__ 性,溶液中c(Na+)___ c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为______________ 。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____ ;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___ (填“促进”、“抑制”)其水解。
(4)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____ 。
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):
(4)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某研究小组为探究饱和 溶液中是否还能溶解少量
溶液中是否还能溶解少量 固体,设计并完成了下列实验:测饱和
固体,设计并完成了下列实验:测饱和 溶液的pH,pH为8.3,用化学用语解释饱和
溶液的pH,pH为8.3,用化学用语解释饱和 溶液
溶液 为8.3的原因:
为8.3的原因:_______ 。
 溶液中是否还能溶解少量
溶液中是否还能溶解少量 固体,设计并完成了下列实验:测饱和
固体,设计并完成了下列实验:测饱和 溶液的pH,pH为8.3,用化学用语解释饱和
溶液的pH,pH为8.3,用化学用语解释饱和 溶液
溶液 为8.3的原因:
为8.3的原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)普通泡沫灭火器是利用 溶液跟
溶液跟 溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是_______ 。
(2)常温下,取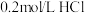 溶液与
溶液与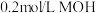 溶液等体积混合,测得混合后溶液的
溶液等体积混合,测得混合后溶液的 。写出MOH的电离方程式:
。写出MOH的电离方程式:_______ 。
(3)往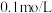 的
的 溶液中滴入紫色石蕊试液,溶液变红。则:
溶液中滴入紫色石蕊试液,溶液变红。则:
①该溶液中
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②得出上述判断的依据是_______ (用文字解释)。
(4)含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含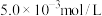 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:

①绿矾为 。反应(Ⅰ)中
。反应(Ⅰ)中 与
与 的物质的量之比为
的物质的量之比为_______ 。
②常温下若处理后的废水中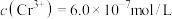 ,则处理后的废水的pH=
,则处理后的废水的pH=_______ 。{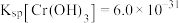 }
}
(1)普通泡沫灭火器是利用
 溶液跟
溶液跟 溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是(2)常温下,取
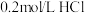 溶液与
溶液与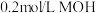 溶液等体积混合,测得混合后溶液的
溶液等体积混合,测得混合后溶液的 。写出MOH的电离方程式:
。写出MOH的电离方程式:(3)往
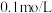 的
的 溶液中滴入紫色石蕊试液,溶液变红。则:
溶液中滴入紫色石蕊试液,溶液变红。则:①该溶液中

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②得出上述判断的依据是
(4)含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含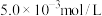 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为
 。反应(Ⅰ)中
。反应(Ⅰ)中 与
与 的物质的量之比为
的物质的量之比为②常温下若处理后的废水中
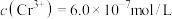 ,则处理后的废水的pH=
,则处理后的废水的pH=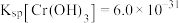 }
}
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?____________________________________________ 。
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是________ ,BaSO4的溶解度的大小顺序为______________
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为______________ ,溶液②中c(Ba2+)为 __________________ 。
(4)取溶液③和溶液④直接混合,则混合溶液的pH为__________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为
(4)取溶液③和溶液④直接混合,则混合溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在25 ℃时,对于0.10 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,溶液的pH将___________ (填“增大”“减小”或“不变”),这是因为___________ 。
(2)若向氨水中加入等体积pH=1的硫酸,此时溶液的pH___________ 7(填“>”“<”或“=”);用离子方程式表示其原因___________ ;此时溶液中各离子浓度由大到小的顺序为___________ 。
(3)向氨水中加入0.05 mol·L-1稀硫酸至溶液正好呈中性,则c(NH )
)___________ 2c(SO )(填“>”“<”或“=”),此时混合溶液中c(NH
)(填“>”“<”或“=”),此时混合溶液中c(NH )=176c(NH3·H2O),则NH3·H2O的电离常数Kb为
)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为___________ 。
(4)向10 mL 0.10 mol·L-1的氨水中加入10 mL 0.02 mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀___________ 。[已知Ca(OH)2的Ksp=5.5×10-6,氨水中c(OH-)≈ ]
]
(1)若向氨水中加入少量硫酸铵固体,溶液的pH将
(2)若向氨水中加入等体积pH=1的硫酸,此时溶液的pH
(3)向氨水中加入0.05 mol·L-1稀硫酸至溶液正好呈中性,则c(NH
 )
) )(填“>”“<”或“=”),此时混合溶液中c(NH
)(填“>”“<”或“=”),此时混合溶液中c(NH )=176c(NH3·H2O),则NH3·H2O的电离常数Kb为
)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为(4)向10 mL 0.10 mol·L-1的氨水中加入10 mL 0.02 mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀
 ]
]
您最近一年使用:0次

 NaOH溶液、
NaOH溶液、 HX溶液,两溶液等体积混合后,测得溶液中:
HX溶液,两溶液等体积混合后,测得溶液中: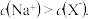 则:
则: 上述混合液中各离子浓度由大到小的顺序为
上述混合液中各离子浓度由大到小的顺序为 的NaOH溶液与
的NaOH溶液与 的HX等体积混合,混合后溶液显
的HX等体积混合,混合后溶液显 填“酸”、“碱”或“中”
填“酸”、“碱”或“中” .
.


