A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是________ ,E是________ ;
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是________ (填写序号)。
a. b.
b. c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是________ (填写序号)。
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中___ 曲线(填写序号)。
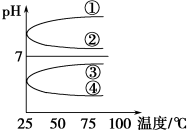
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为____________________ 。
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是
(2)用水稀释0.1 mol·L-1B溶液时,溶液中随着水量的增加而减小的是
a.
 b.
b. c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中

(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
22-23高二上·全国·课时练习 查看更多[1]
(已下线)3.3.1 盐类的水解-同步学习必备知识
更新时间:2022-12-16 20:32:04
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】填空。
(1)某温度时,测得0.01mol·L-1NaOH溶液的pH=11,该温度下水的离子积Kw=_______ 。该温度下,将pH=12的NaOH溶液VamL与pH=2的H2SO4溶液VbmL混合,混合后溶液的pH=11,则Va:Vb=_______ 。
(2)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+)_______ (填“>”“<”或“=”)c(OH-),c(HCN)+c(CN-)=_______ mol·L-1。
(3)室温下将amol·L-1的HCN与0.1mol·L-1的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示HCN的电离常数Ka=_______ 。
(1)某温度时,测得0.01mol·L-1NaOH溶液的pH=11,该温度下水的离子积Kw=
(2)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+)
(3)室温下将amol·L-1的HCN与0.1mol·L-1的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式:_____________ 。
(2)明矾净水的原理为(用离子方程式表示)____________________________ 。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________ 。
(4)现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______ 。
(1)写出醋酸(CH3COOH) 的电离方程式:
(2)明矾净水的原理为(用离子方程式表示)
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为
(4)现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是
(5)常温下,下列事实能证明HA是弱电解质的是
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】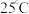 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
______  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。
(2)下列四种离子结合质子能力由大到小的顺序是______  填序号
填序号 ;
;
a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是______  填序号
填序号
a.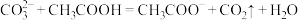
b.
c.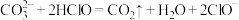
d.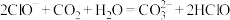
(4)用蒸馏水稀释 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是______  填序号
填序号 ;
;
a. b.
b.  c.
c. d.
d.
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
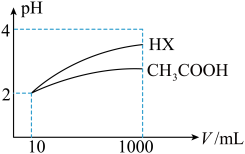
则HX的电离平衡常数______  填“大于”、“等于”或“小于”,下同
填“大于”、“等于”或“小于”,下同 醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)
醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)______ 醋酸溶液中水电离出来的c(H+),理由是___________ 。
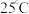 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 |  |  | HClO |
| 电离平衡常数 | 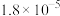 | 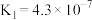 , , |  |
回答下列问题:
(1)一般情况下,当温度升高时,

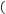 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。(2)下列四种离子结合质子能力由大到小的顺序是
 填序号
填序号 ;
;a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是
 填序号
填序号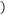
a.
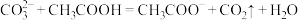
b.

c.
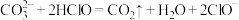
d.
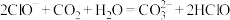
(4)用蒸馏水稀释
 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是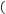 填序号
填序号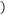 ;
;a.
 b.
b.  c.
c. d.
d.
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数
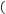 填“大于”、“等于”或“小于”,下同
填“大于”、“等于”或“小于”,下同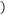 醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)
醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)工业上常用甲醇来制备甲酸(一元酸)。已知25℃时,0.1mol·L–1甲酸(HCOOH)溶液和0.1mol·L–1盐酸溶液的pH分别为2.3和1。写出甲酸电离的方程式__ 。
(2)向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,都会引起的变化是______
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
(2)向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,都会引起的变化是
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】人们日常生产生活与化学有着紧密的联系。① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧盐酸、⑨氨水都是生活中常见的化学物质。请回答下列相关的问题:
、⑧盐酸、⑨氨水都是生活中常见的化学物质。请回答下列相关的问题:
(1)上述9种物质中属于弱电解质的是___________ (填序号),写出 在水中的电离方程式:
在水中的电离方程式:___________ 。
(2)现有常温下 的盐酸(甲)和
的盐酸(甲)和 的醋酸溶液(乙),请根据下列操作回答:
的醋酸溶液(乙),请根据下列操作回答:
①常温下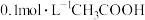 溶液加水稀释过程,下列表达式的数值一定变小的是
溶液加水稀释过程,下列表达式的数值一定变小的是________ (填字母)。
A. B.
B.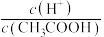 C.
C.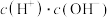 D.
D.
②取 乙溶液,加入少量无水
乙溶液,加入少量无水 固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中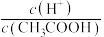 的值将
的值将________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别与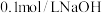 溶液反应,消耗
溶液反应,消耗 溶液的体积(甲)
溶液的体积(甲) ________ (乙)(填“>”“<”或“=”)。
(3) 时,水的离子级积常数
时,水的离子级积常数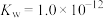 。此温度下,
。此温度下, 的盐酸
的盐酸 和
和 的
的 溶液
溶液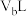 混合后溶液的
混合后溶液的 ,则
,则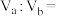
________ 。
(4)已知:在 ,有关弱电解质的电离平衡常数如下表有下表:
,有关弱电解质的电离平衡常数如下表有下表:
①将 通入该氨水中,当
通入该氨水中,当 降至
降至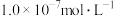 时,溶液中的
时,溶液中的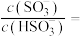
________ 。
②下列微粒在溶液中不能大量共存的是________ 。
A. B.
B. C.
C.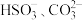 D.
D.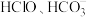
 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧盐酸、⑨氨水都是生活中常见的化学物质。请回答下列相关的问题:
、⑧盐酸、⑨氨水都是生活中常见的化学物质。请回答下列相关的问题:(1)上述9种物质中属于弱电解质的是
 在水中的电离方程式:
在水中的电离方程式:(2)现有常温下
 的盐酸(甲)和
的盐酸(甲)和 的醋酸溶液(乙),请根据下列操作回答:
的醋酸溶液(乙),请根据下列操作回答:①常温下
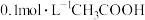 溶液加水稀释过程,下列表达式的数值一定变小的是
溶液加水稀释过程,下列表达式的数值一定变小的是A.
 B.
B.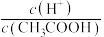 C.
C.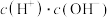 D.
D.
②取
 乙溶液,加入少量无水
乙溶液,加入少量无水 固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中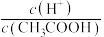 的值将
的值将③相同条件下,取等体积的甲、乙两溶液,分别与
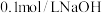 溶液反应,消耗
溶液反应,消耗 溶液的体积(甲)
溶液的体积(甲) (3)
 时,水的离子级积常数
时,水的离子级积常数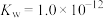 。此温度下,
。此温度下, 的盐酸
的盐酸 和
和 的
的 溶液
溶液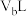 混合后溶液的
混合后溶液的 ,则
,则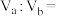
(4)已知:在
 ,有关弱电解质的电离平衡常数如下表有下表:
,有关弱电解质的电离平衡常数如下表有下表:| 弱电解质 | 电离常数( ) ) | |
 | 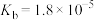 | |
 | 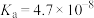 | |
 | 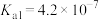 |  |
 | 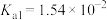 |  |
 通入该氨水中,当
通入该氨水中,当 降至
降至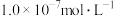 时,溶液中的
时,溶液中的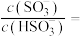
②下列微粒在溶液中不能大量共存的是
A.
 B.
B. C.
C.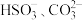 D.
D.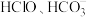
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】I.常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)________
(2)溶液中共有________ 种不同的微粒。
(3)这些微粒中浓度为0.01 mol·L-1的是_____ ,浓度为0.002 mol·L-1的是___ 。
(4)______ 和_______ 两种微粒的物质的量之和比OH-的物质的量多0.008 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________ 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的______ 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________ ,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为________ 。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)
(2)溶液中共有
(3)这些微粒中浓度为0.01 mol·L-1的是
(4)
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
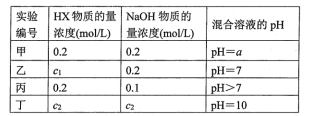
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a___ 7(填“>""<”或“=”),则HX为强酸;若a_________ 7(填“>“‘<”或“=”),则HX为弱酸.
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____ .
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是________ .
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_________ mol/L.

请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】弱电解质在水溶液中会部分电离产生阴、阳离子,部分盐在水溶液中会发生水解,难溶电解质能与水溶液中的离子建立沉淀溶解平衡。利用以,上化学反应原理解释生活生产中的相关问题:
(1)盐碱地(含较多NaCl、 )不利于作物生长,通过施加适量
)不利于作物生长,通过施加适量 可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因
可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因_______ 。
(2)酸碱中和滴定法在工农业生产和医药卫生等方面都有非常重要的作用。室温下用0.1 mol/L NaOH溶液滴定体积均为20.00 mL、浓度均为0.1 mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①滴定前的上述三种溶液中,由水电离出的 最大的是
最大的是_______ 溶液(填化学式)。
②上述滴定曲线图为滴定醋酸溶液的是_______ (填“Ⅰ”或“Ⅱ”);用酚酞作指示剂,判断到达滴定终点的操作及现象_______ 。
③图中M点溶液的离子浓度由大到小顺序:_______ 。
(3)三氯化铁是一种重要的化合物,可用来腐蚀电路板。某温度下,腐蚀废液含有0.5 mol/L 和0.26 mol/L
和0.26 mol/L  ,使
,使 完全沉淀(
完全沉淀(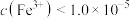 mol/L认为沉淀完全),而
mol/L认为沉淀完全),而 不沉淀,则需控制溶液pH的范围为
不沉淀,则需控制溶液pH的范围为_______ 。(某温度时,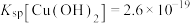 ;
;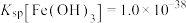 )
)
(1)盐碱地(含较多NaCl、
 )不利于作物生长,通过施加适量
)不利于作物生长,通过施加适量 可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因
可以降低土壤的碱性。用离子方程式表示降低土壤碱性的原因(2)酸碱中和滴定法在工农业生产和医药卫生等方面都有非常重要的作用。室温下用0.1 mol/L NaOH溶液滴定体积均为20.00 mL、浓度均为0.1 mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①滴定前的上述三种溶液中,由水电离出的
 最大的是
最大的是②上述滴定曲线图为滴定醋酸溶液的是
③图中M点溶液的离子浓度由大到小顺序:
(3)三氯化铁是一种重要的化合物,可用来腐蚀电路板。某温度下,腐蚀废液含有0.5 mol/L
 和0.26 mol/L
和0.26 mol/L  ,使
,使 完全沉淀(
完全沉淀(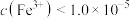 mol/L认为沉淀完全),而
mol/L认为沉淀完全),而 不沉淀,则需控制溶液pH的范围为
不沉淀,则需控制溶液pH的范围为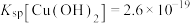 ;
;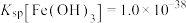 )
)
您最近一年使用:0次



