常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
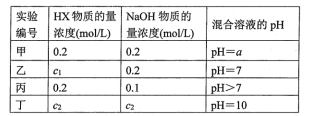
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a___ 7(填“>""<”或“=”),则HX为强酸;若a_________ 7(填“>“‘<”或“=”),则HX为弱酸.
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____ .
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是________ .
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_________ mol/L.

请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=
更新时间:2018-11-28 17:59:38
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】现有下列物质①熔化的NaCl②盐酸③氯气④冰醋酸⑤铜⑥酒精⑦硫酸氢钠⑧液氨⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是___________ (填序号)
(2)属于弱电解质的是___________ (填序号)
(3)属于非电解质,但溶于水后的水溶液能导电的是___________ (填序号)
(4)可以证明④是弱酸的事实是___________ (填序号)
A.乙酸和水能以任意比例混溶
B.用醋酸溶液做导电实验,灯泡很暗
C.常温下,测得0.1mol/L醋酸溶液的pH=4
D.乙酸与Na2CO3溶液反应放出CO2气体
E.常温下,将pH=1的醋酸溶液稀释1000倍测得pH<4
F.等pH、等体积的盐酸和醋酸溶液中和碱时,醋酸中和碱的能力强
(5)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为___________ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为___________ 。
(6)常温下,有 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___________ (填字母)。(①表示盐酸,②表示醋酸)
a. b.
b.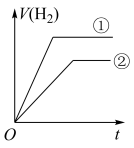 c.
c.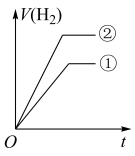 d.
d.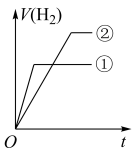
(7)H2C2O4(乙二酸),俗名草酸,存在于自然界的植物中。已知常温下草酸电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5,碳酸的电离平衡常数Ka1=4.5×10-7,Ka2=4.7×10-11。回答下列问题:
①25℃,物质的量浓度均为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH____ (填“大”“小”或“相等”)。
②写出NaHC2O4溶液中水解反应的离子方程式___________ 。
(1)属于强电解质的是
(2)属于弱电解质的是
(3)属于非电解质,但溶于水后的水溶液能导电的是
(4)可以证明④是弱酸的事实是
A.乙酸和水能以任意比例混溶
B.用醋酸溶液做导电实验,灯泡很暗
C.常温下,测得0.1mol/L醋酸溶液的pH=4
D.乙酸与Na2CO3溶液反应放出CO2气体
E.常温下,将pH=1的醋酸溶液稀释1000倍测得pH<4
F.等pH、等体积的盐酸和醋酸溶液中和碱时,醋酸中和碱的能力强
(5)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为
(6)常温下,有
 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b. c.
c. d.
d.
(7)H2C2O4(乙二酸),俗名草酸,存在于自然界的植物中。已知常温下草酸电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5,碳酸的电离平衡常数Ka1=4.5×10-7,Ka2=4.7×10-11。回答下列问题:
①25℃,物质的量浓度均为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH
②写出NaHC2O4溶液中水解反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】I.按要求回答下列问题:
(1)下列物质中属于强电解质的是___________ (填标号,下同),属于弱电解质的是___________ 。
①HI ②盐酸 ③BaSO4 ④H2O ⑤SO2 ⑥HF
Ⅱ.已知电离平衡常数:
(2)下列离子结合H+能力由强到弱的顺序是___________ (用离子符号表示)。
A.NO B.CN- C.H2PO
B.CN- C.H2PO D.HPO
D.HPO E.PO
E.PO
(3)25℃时,向10mL0.1mol•L-1的HNO2溶液中加入蒸馏水,将其稀释到1L后,下列说法正确的是___________。
(4)取c(H+)相同的盐酸和HNO2溶液各10mL,分别加水稀释到1000mL,稀释过程中c(H+)变化如图所示。表示盐酸c(H+)变化的曲线是___________ ,理由是___________ 。

(5)①HCN能否与NaNO2溶液反应___________ ,原因是___________ 。
②Na3PO4溶液与足量的HNO2溶液反应的离子方程式为___________ 。
(1)下列物质中属于强电解质的是
①HI ②盐酸 ③BaSO4 ④H2O ⑤SO2 ⑥HF
Ⅱ.已知电离平衡常数:
| 弱酸 | HNO2 | HCN | H3PO4 |
| 电离常数(25℃) | 5.6×10-4 | 6.2×10-10 | Ka1=6.9×10-3 Ka2=6.2×10-8 Ka3=4.8×10-13 |
(2)下列离子结合H+能力由强到弱的顺序是
A.NO
 B.CN- C.H2PO
B.CN- C.H2PO D.HPO
D.HPO E.PO
E.PO
(3)25℃时,向10mL0.1mol•L-1的HNO2溶液中加入蒸馏水,将其稀释到1L后,下列说法正确的是___________。
| A.HNO2的电离程度增大 | B.Ka(HNO2)增大 |
| C.H+的数目增多 | D. 减小 减小 |
(4)取c(H+)相同的盐酸和HNO2溶液各10mL,分别加水稀释到1000mL,稀释过程中c(H+)变化如图所示。表示盐酸c(H+)变化的曲线是

(5)①HCN能否与NaNO2溶液反应
②Na3PO4溶液与足量的HNO2溶液反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1) 25℃时,电离平衡常数:
回答下列问题:
①当三种酸的物质的量浓度相同时,c(H+)由大到小的顺序是_______ (用化学式表示,下同)。
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是_______ 。
③在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3COO- + H+△H>0,下列方法中,可以使0.10mol/LCH3COOH溶液中CH3COOH电离程度增大的是_______ 。
a.加入少量0.10mol/L的稀盐酸 b.加热c.加水稀释至0.010mol/L d.加入少量冰醋酸 e.加入少量氯化钠固体
④常温下,0.1mol/L的CH3COOH液加水稀释过程中,下列表达式的数据一定变小的是_______ 。
a.c(H+) b. c.c(H+)c(OH-) d.
c.c(H+)c(OH-) d.
⑤体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。溶液稀释后,HX溶液中水电离出来的c(H+)____ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。

(2)已知纯水中存在如下平衡:H2O ⇌ H++OH-。现欲使平衡逆向移动,且所得溶液显酸性,可选择的方法是_______ (填字母序号)。
a.向水中加入NaOH固体 b.向水中加入NaHSO4固体c.加热至100℃ d.向水中通入CO2气体
(3)常温下,将pH=11 的NaOH 溶液与pH=4 的硫酸混合,所得溶液的PH=9,则酸、碱溶液的体积比是_______ 。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 4.0×10-8 |
①当三种酸的物质的量浓度相同时,c(H+)由大到小的顺序是
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
③在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3COO- + H+△H>0,下列方法中,可以使0.10mol/LCH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol/L的稀盐酸 b.加热c.加水稀释至0.010mol/L d.加入少量冰醋酸 e.加入少量氯化钠固体
④常温下,0.1mol/L的CH3COOH液加水稀释过程中,下列表达式的数据一定变小的是
a.c(H+) b.
 c.c(H+)c(OH-) d.
c.c(H+)c(OH-) d.
⑤体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。溶液稀释后,HX溶液中水电离出来的c(H+)

(2)已知纯水中存在如下平衡:H2O ⇌ H++OH-。现欲使平衡逆向移动,且所得溶液显酸性,可选择的方法是
a.向水中加入NaOH固体 b.向水中加入NaHSO4固体c.加热至100℃ d.向水中通入CO2气体
(3)常温下,将pH=11 的NaOH 溶液与pH=4 的硫酸混合,所得溶液的PH=9,则酸、碱溶液的体积比是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】电解质的水溶液中存在电离平衡。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_____ (填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是___________ 。
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_________ (填“偏大”、“偏小”或“不变”)。
(4)实验C中判断滴定终点的现象是_______ 。
(5)实验数据如下表,则该白醋样品中醋酸总酸度为_________ mol· L-1。
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L−1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。
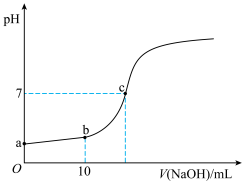
(6)a点溶液pH > 1,用电离方程式解释原因:_____________ 。
(7)下列有关b点溶液的说法正确的是_______ (填字母序号)。
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH−)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:__________ 。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值
(4)实验C中判断滴定终点的现象是
(5)实验数据如下表,则该白醋样品中醋酸总酸度为
| 待测液体积/mL | 标准NaOH溶液 | ||
| 滴定前读数/mL | 滴定终点读数/mL | ||
| 第1次 | 20.00 | 0 | 21.98 |
| 第2次 | 20.00 | 0 | 22.00 |
| 第3次 | 20.00 | 0 | 22.02 |
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L−1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。

(6)a点溶液pH > 1,用电离方程式解释原因:
(7)下列有关b点溶液的说法正确的是
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH−)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】常温下,现有下列6种溶液:
①0.1mol/L NaOH溶液 ② 的
的 溶液 ③0.1mol/L
溶液 ③0.1mol/L  溶液 ④0.1mol/L
溶液 ④0.1mol/L  溶液 ⑤0.1mol/L
溶液 ⑤0.1mol/L  溶液 ⑥
溶液 ⑥ 的
的 溶液
溶液
(1)①的pH=___________ 。
(2)六种溶液中水的电离程度最大的是___________ (填序号)。
(3)①②等体积混合后溶液的pH约为___________ (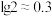 ,忽略混合引起的体积变化)。
,忽略混合引起的体积变化)。
(4)②⑥等体积混合后溶液中的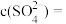
___________ (已知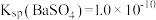 )。
)。
(5)⑤中离子浓度关系:
___________ 2 ,(填“>”“<”或“=”)。
,(填“>”“<”或“=”)。
①0.1mol/L NaOH溶液 ②
 的
的 溶液 ③0.1mol/L
溶液 ③0.1mol/L  溶液 ④0.1mol/L
溶液 ④0.1mol/L  溶液 ⑤0.1mol/L
溶液 ⑤0.1mol/L  溶液 ⑥
溶液 ⑥ 的
的 溶液
溶液(1)①的pH=
(2)六种溶液中水的电离程度最大的是
(3)①②等体积混合后溶液的pH约为
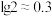 ,忽略混合引起的体积变化)。
,忽略混合引起的体积变化)。(4)②⑥等体积混合后溶液中的
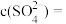
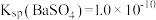 )。
)。(5)⑤中离子浓度关系:

 ,(填“>”“<”或“=”)。
,(填“>”“<”或“=”)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】亚硝酸是一种弱酸,Ka(HNO2)=5.6×10-4,NaNO2可用于滴定分析。
(1)常温下,0.1 mol/L的NaNO2溶液呈__________ (填“酸性”、“中性”或“碱性”);原因是__________ (用离子方程式表示)。
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是_______ (填写微粒化学式)。c(NO2-)+c(HNO2)=__________ mol/L。

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是_______ 。
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显_______ 色。
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
则该样品中对氨基苯磺酸的纯度是__________ 。
第二次实验数据出现异常,造成这种异常的原因可能是________ (填代号)。
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为_______ 。
(1)常温下,0.1 mol/L的NaNO2溶液呈
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗NaNO2溶液体积/mL | 20.12 | 20.90 | 20.00 | 19.88 |
第二次实验数据出现异常,造成这种异常的原因可能是
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3C.NH4HSO4D.(NH4)2SO4
① pH值由大到小的顺序是___________________ (用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________ (用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。已知该温度下AgCl的Ksp=l.0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=_____________ 。
②完全沉淀后,溶液的pH=____________ 。
(3)弱酸及其盐在水中存在多种平衡关系。已知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________ 。
②向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________ 。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1Fe3+和0.26 mol·L-1Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5mol·L-1]而Cu2+不沉淀,则需控制溶液pH的范围为_________ 。[KspCu(OH)2= 2.6×l0-19;KspFe(OH)3= 4×l0-38]
① pH值由大到小的顺序是
② NH4+离子浓度由大到小的顺序是
(2)25℃向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。已知该温度下AgCl的Ksp=l.0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
(3)弱酸及其盐在水中存在多种平衡关系。已知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为
②向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1Fe3+和0.26 mol·L-1Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5mol·L-1]而Cu2+不沉淀,则需控制溶液pH的范围为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】25 ℃时部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为_______ 。
(2)室温下①0.1 mol·L-1HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,
④0.1 mol·L-1NaHCO3,溶液的pH由大到小的关系为_______ 。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中, 、
、 、
、 、
、 浓度由大到小的顺序为
浓度由大到小的顺序为_______ 。
(4)下列离子方程式书写正确的是_______ (填字母)。
a.2ClO-+H2O+CO2=2HClO+
b.2HCOOH+ =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+
d.Cl2+H2O+2 =2
=2 +Cl-+ClO-
+Cl-+ClO-
(5)在25 ℃时,将a mol·L-1 的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a_______ (填“>”“<”或“=”)0.01。
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 | Ka=1.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为
(2)室温下①0.1 mol·L-1HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,
④0.1 mol·L-1NaHCO3,溶液的pH由大到小的关系为
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,
 、
、 、
、 、
、 浓度由大到小的顺序为
浓度由大到小的顺序为(4)下列离子方程式书写正确的是
a.2ClO-+H2O+CO2=2HClO+

b.2HCOOH+
 =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑c.H2SO3+2HCOO-=2HCOOH+

d.Cl2+H2O+2
 =2
=2 +Cl-+ClO-
+Cl-+ClO-(5)在25 ℃时,将a mol·L-1 的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】电离平衡常数是衡量弱电解质电离程度的量。已知如表数据(25℃):
(1)25℃时,等浓度的三种溶液( 溶液、
溶液、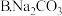 溶液、
溶液、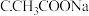 溶液)的
溶液)的 由大到小的顺序为
由大到小的顺序为 _______ 。(填写序号)
(2)25℃时,向 溶液中通入少量
溶液中通入少量 ,所发生反应的化学方程式为
,所发生反应的化学方程式为_______
(3)现有浓度为 的
的 与
与
 等体积混合后,测得
等体积混合后,测得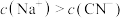 ,下列关系正确的是 _______
,下列关系正确的是 _______
(4)已知 水溶液显酸性,请写出该溶液中各离子浓度的大小
水溶液显酸性,请写出该溶液中各离子浓度的大小 _______ ;
(5)H2C2O4溶液和 酸性溶液可发生反应:
酸性溶液可发生反应: ,反应中每生成标况下
,反应中每生成标况下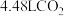 气体,转移的电子的物质的量为
气体,转移的电子的物质的量为 _______ 
| 化学式 | 电离平衡常数 |
 | 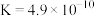 |
 |  |
 | 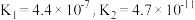 |
(1)25℃时,等浓度的三种溶液(
 溶液、
溶液、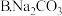 溶液、
溶液、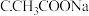 溶液)的
溶液)的 由大到小的顺序为
由大到小的顺序为 (2)25℃时,向
 溶液中通入少量
溶液中通入少量 ,所发生反应的化学方程式为
,所发生反应的化学方程式为(3)现有浓度为
 的
的 与
与
 等体积混合后,测得
等体积混合后,测得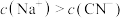 ,下列关系正确的是 _______
,下列关系正确的是 _______A.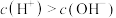 | B.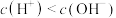 |
C. | D.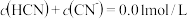 |
 水溶液显酸性,请写出该溶液中各离子浓度的大小
水溶液显酸性,请写出该溶液中各离子浓度的大小 (5)H2C2O4溶液和
 酸性溶液可发生反应:
酸性溶液可发生反应: ,反应中每生成标况下
,反应中每生成标况下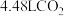 气体,转移的电子的物质的量为
气体,转移的电子的物质的量为 
您最近一年使用:0次



