(1)现有可逆反应A(气)+B(气)
 3C(气),图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系: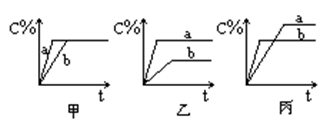
①若乙图中的a曲线表示200℃时的情况,b曲线表示100℃时的情况,则此可逆反应的正反应是
②若丙图中两条曲线分别表示不同压强下的情况,则
(2)图中Z表示在密闭容器中反应:2SO2+O2
 2SO3 ΔH<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,t3至t4过程中改变的条件可能是
2SO3 ΔH<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,t3至t4过程中改变的条件可能是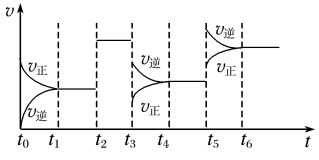
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
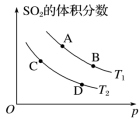
①温度关系:T1
②平衡常数关系:K(A)
相似题推荐
 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
| A.升高温度 |
| B.降低温度 |
| C.增大压强 |
| D.减小压强 |
E.加入催化剂
G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态:
 )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):①

 kJ⋅mol
kJ⋅mol
②
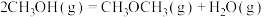
 kJ·mol
kJ·mol
③

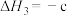 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式:
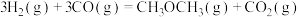

(2)以下说法能说明反应
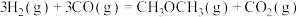 达到化学平衡状态的有
达到化学平衡状态的有a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应:
 ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。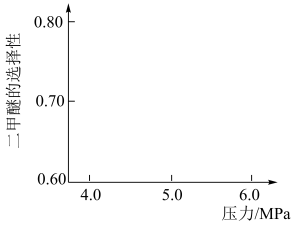
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是
反应I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
反应Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25.0kJ·mol-1
反应Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3=+41.2kJ·mol-1
回答下列问题:
(1)反应Ⅳ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH4=
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的历程如图所示。

在反应气中加入少量水能够提升甲醇产率的原因是
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、甲醚含量的影响如图所示。
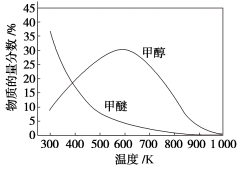
600K以下,甲醇百分含量变化的可能原因是
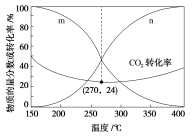
(4)在5MPa下,CO2和H2按物质的量之比为1∶3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。图中n代表的物质是
 尿素、碳铵等
尿素、碳铵等 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为
(2)已知①N2(g)+3H2(g)⇌2NH3(g) ∆H=-92.4kJ/mol,②N2H4(l)+O2(g)⇌N2(g)+2H2O(l) ∆H=-624kJ/mol,则反应2NH3(g) +2H2O(l)⇌N2H4(l)+O2(g) +3H2(g)的∆H=
A.增加H2O(l)的量 B.增大压强 C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入
 ,为防止其污染空气,常用还原法对其进行处理。其中之一为
,为防止其污染空气,常用还原法对其进行处理。其中之一为 还原法,反应原理为
还原法,反应原理为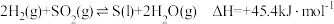 。
。(1)已知:
 的燃烧热
的燃烧热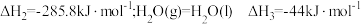 。则表示液态硫
。则表示液态硫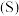 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)不同催化剂下的反应机理不尽相同,如图为以氧化铝为载体催化下的反应机理示意图,已知第一步反应在
 下进行,第二步反应在
下进行,第二步反应在 下进行。
下进行。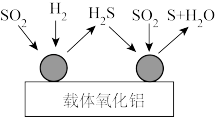
①根据图示写出第一步反应的化学方程式:
②
 是非常活泼的还原剂,以
是非常活泼的还原剂,以 为还原剂最大的优点是在低温下有较高的吸收率,缺点是
为还原剂最大的优点是在低温下有较高的吸收率,缺点是(3)一定温度下,向
 恒容密闭容器内充入
恒容密闭容器内充入 和
和 发生
发生 ,体系中
,体系中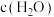 与反应时间
与反应时间 的关系如图所示。
的关系如图所示。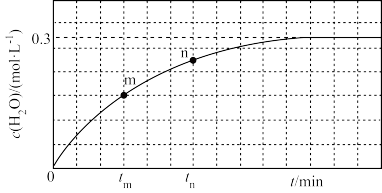
①指定温度下,该反应的平衡常数的计算式为
②下列判断正确的是
a.
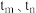 时反应均未达平衡,且
时反应均未达平衡,且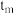 时v逆大于
时v逆大于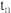 时v逆
时v逆b.混合气体密度不再变化时,说明该反应达平衡
c.其他条件不变,平衡后将容器容积压缩至
 ,达到新平衡,
,达到新平衡,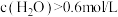
d.其他条件不变,平衡后再向容器中加入
 和
和 ,达到新平衡时,
,达到新平衡时, 转化率不变
转化率不变(4)某温度下,向
 恒容密闭容器中按照物质的量之比为
恒容密闭容器中按照物质的量之比为 充入
充入 和
和 混合气发生
混合气发生 ,反应进行到不同时间测得各物质的浓度如图所示。
,反应进行到不同时间测得各物质的浓度如图所示。
①对比平衡常数的大小,
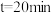 时
时
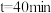 时
时 (填“大于”“小于”或“等于”),说明原因
(填“大于”“小于”或“等于”),说明原因②
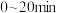 时,反应速率表示为
时,反应速率表示为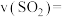
(1)已知,5.6LCH4(标况下数据)与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式
(2)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的物质的量浓度变化表示该反应速率v(H2)=
②该反应的平衡常数表达式K=
③下列选项中能表示该反应已达到平衡状态的是
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.c(CH4)=c(CO)
④平衡时容器中CH4的体积分数
【推荐1】绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国有重要意义。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)═2NO2(g)  H1=﹣112.4kJ•mol﹣1
H1=﹣112.4kJ•mol﹣1
②NO2(g)+CO(g)═NO(g)+CO2(g) H 2=﹣234kJ•mol﹣1
H 2=﹣234kJ•mol﹣1
③N2(g)+O2(g)═2NO(g) H 3=+179.2kJ•mol﹣1
H 3=+179.2kJ•mol﹣1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)⇌N2(g)+2CO2(g) H=﹣759.8kJ•mol﹣1,反应达到平衡时,N2的体积分数随
H=﹣759.8kJ•mol﹣1,反应达到平衡时,N2的体积分数随 的变化曲线如图1。
的变化曲线如图1。
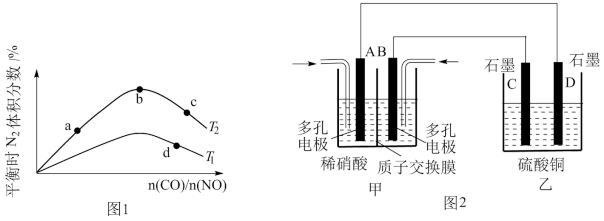
①b点时,平衡体系中C、N原子个数之比接近
②a、c、d三点的平衡常数从大到小的顺序为
③若 =0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10﹣2,Ka2=6.4×10﹣5,25℃时,0.1 mol•L﹣1NaHC2O4溶液中各离子浓度由大到小的顺序为 )=c(C2O
)=c(C2O ),则此时溶液
),则此时溶液
(1)图1是反应A(g)+2B(g)⇌C(g)在不同温度下A的转化率随时间变化的曲线。
①该反应的H
②在T1温度下,向体积为1 L的密闭容器中,充入1 mol A(g)和2 mol B(g),测得A(g)和C(g)的浓度随时间变化如图2所示。则10 min内C的生成速率为
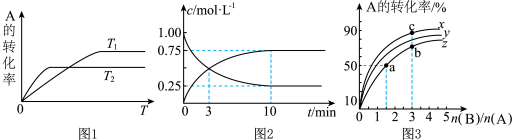
③若容器容积不变,下列措施可增加A转化率的是
a.升高温度 b.将C(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容密闭容器中,分别研究在230°C、250°C和270°C条件下的上述反应。三种温度下B与A的物质的量之比与A平衡转化率的关系如图3所示。曲线z对应的温度是
 PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 56 | 0. 75 | 0. 80 | 0. 80 |
回答下列问题:
(1)反应在前50 s 的平均速率v(PCl3)=
(2)T℃时,起始时向容器中充入1. 2 mol PCl5、0. 40 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正)
(3)T℃时,若起始时向容器中充入6. 0 mol PCl3 和6. 0 mol Cl2,达到平衡时,平衡混合气体中PCl5的体积分数为多少?(写出解题过程)。



