 与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。(1)人体血液中存在平衡
 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:(2)利用
 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题: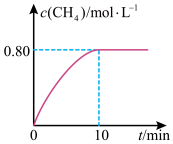
①下列说法正确的是
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol
 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L②从反应开始到10min,
 的平均反应速率
的平均反应速率
③300℃时,反应的平衡常数K=
④500℃该反应达到平衡时,上述容器中有1.6mol
 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。则

(3)化工废水中常常含有以二甲胺(
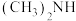 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。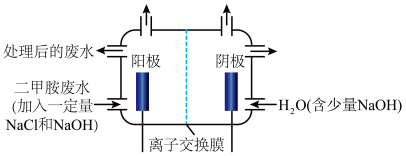
反应原理是:(i)
 在阳极转化为
在阳极转化为 ;
;(ii)
 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;(iii)
 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。①写出电解池中阴极发生反应的方程式
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到6.72L(标况下)
 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是
更新时间:2023-03-08 19:07:12
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________ (填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________ kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________ mol/(L·s);
②若将该容器置于冰水中,气体颜色将________ (填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________ 。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________ (填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______ c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
①几分钟后,可观察到导管中的水柱________ ;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________ ;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________ 。
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:
②CO(g)+1/2O2(g)=CO2(g) ΔH=
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)
 N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:①5秒内,v(NO2)=
②若将该容器置于冰水中,气体颜色将
③该反应的平衡常数表达式K=
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈
②溶液中c(Na+)
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
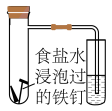
①几分钟后,可观察到导管中的水柱
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为
您最近一年使用:0次
【推荐2】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下图所示。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程如图所示。
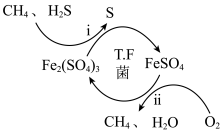
(1)过程i的氧化剂是_____________ 。
(2)过程ii的离子方程式是________________ 。
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
请结合以上信息,判断工业脱硫应选择的最合适的pH范围是____ <pH<____ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(4)①该过程的热化学方程式是____________________ 。
②比较压强p1和p2的大小关系:p1____ p2(选填“>”、“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得起始时混合气体的密度是平衡时混合气体密度的1.4倍,则CH4的转化率为________ 。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程如图所示。

(1)过程i的氧化剂是
(2)过程ii的离子方程式是
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
| pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
| Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。

(4)①该过程的热化学方程式是
②比较压强p1和p2的大小关系:p1
③在一定温度和一定压强下的体积可变的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得起始时混合气体的密度是平衡时混合气体密度的1.4倍,则CH4的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
I.已知反应:①CH4(g)+H2O (g) CO(g)+3H2(g) ΔH=+206 kJ·mol-1,②C(s)+H2O (g)
CO(g)+3H2(g) ΔH=+206 kJ·mol-1,②C(s)+H2O (g)  CO(g)+ H2(g) ΔH=+131 kJ·mol-1。
CO(g)+ H2(g) ΔH=+131 kJ·mol-1。
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白:CH4(g) C(s)+2H2(g)ΔH=
C(s)+2H2(g)ΔH=____ kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______ (填序号)。
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
II.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(3)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
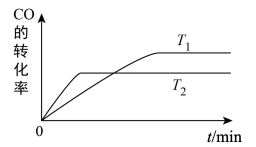
(4)如图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____ T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____ K2(填“>”、“<”或“=”)。
(5)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,写出铜电极的电极反应式__________ 。
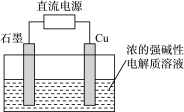
I.已知反应:①CH4(g)+H2O (g)
 CO(g)+3H2(g) ΔH=+206 kJ·mol-1,②C(s)+H2O (g)
CO(g)+3H2(g) ΔH=+206 kJ·mol-1,②C(s)+H2O (g)  CO(g)+ H2(g) ΔH=+131 kJ·mol-1。
CO(g)+ H2(g) ΔH=+131 kJ·mol-1。(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白:CH4(g)
 C(s)+2H2(g)ΔH=
C(s)+2H2(g)ΔH=(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
II.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g)
 CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:(3)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
| A.v(H2)正=v(CH3OH)逆 |
| B.2v(CO)=v(H2) |
| C.CO与H2转化率相等 |
| D.CO与H2的物质的量之比不再改变 |

(5)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,写出铜电极的电极反应式
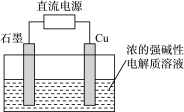
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】绿矾(FeSO4·7H2O)可用作净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,其流程如下:
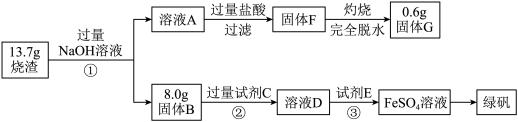
(1)溶液A中含有的主要阴离子除OH-外还有____________________ 。
(2)试剂C是__________ 。
(3)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是________________ 。
(4)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。绿矾还原沉淀法是常用的一种方法:
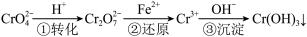
①已知2CrO42-(黄色)+2H+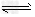 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______ 。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
②还原一步的离子方程式是___________________________ ;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______ mol。

(1)溶液A中含有的主要阴离子除OH-外还有
(2)试剂C是
(3)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是
(4)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。绿矾还原沉淀法是常用的一种方法:
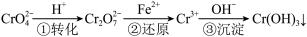
①已知2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
②还原一步的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2+ H2O HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为_______________________________ 。
(2)使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:_____________________________________________ 。
(3)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为_______________________________________________ 。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为_________________________________________ 。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。

①下列溶液能吸收Cl2的是_______ (填字母序号)。
②能说明Cl2的氧化性强于I2的实验现象是_____________________________ 。
③请用原子结构知识解释Cl2的氧化性强于I2的原因:____________________________
Cl2+ H2O
 HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为
(2)使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
(3)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。

①下列溶液能吸收Cl2的是
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
②能说明Cl2的氧化性强于I2的实验现象是
③请用原子结构知识解释Cl2的氧化性强于I2的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】I.以“水煤气”为原料合成氨)需在变换塔中将CO变换成H2,变换塔中主要发生的反应有:
主反应CO(g)+H2O(g) CO2(g)+H2(g) △H1<0
CO2(g)+H2(g) △H1<0
副反应CO(g)+2H2(g) CH3OH(g) △H2<0
CH3OH(g) △H2<0
(1)关于合成氨工艺的下列说法中,正确的是____。
(2)已知:相对压力平衡常数Kp的表达式是指在浓度平衡常数表达式中,用相对分压代替浓度。气体B的相对分压等于其分压p(B) (单位:kPa)除以标准压强pθ(pθ=100kPa),其分压p(B)=p·x(B),p为平衡总压强,x(B)为平衡体系中B的物质的量分数。变换塔中恒容条件下,充入1.0molCO、1.4 molH2O、1.0molH2、0.5 molN2,T℃下,反应达到平衡后,测得CO20.7 mol、CH3OH 0.1 mol。计算T℃时,主反应的相对压力平衡常数Kp=________ 。
II.丙烯是重要的工业品,可用于制取卤代烃、丙醇及塑料等。工业中以丙烷催化脱氢来制取
丙烯:主反应:C3H8(g)=C3H6(g)+H2(g) △H1=+123.0 kJ/mol
副反应:C3H8(g) =CH4(g)+C2H4(g) △H2=+81.30 kJ/mol
(3)不同温度下,丙烷以相同的流速经过装有催化剂的管道,测得丙烷转化率、丙烯选择性和温度的关系如图所示。下列有关丙烷催化脱氢反应说法正确的是________ 。
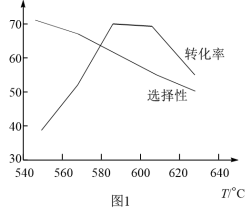
A.主、副反应的△S相等
B.温度升高,丙烯的产率增大
C.单位时间内生成1 mol H-H键,同时消耗1 molC=C键,反应未达到平衡
D.低温有利于C-H键断键,高温有利于C-C键断键
E.高于600℃,温度升高,主、副反应平衡逆移,导致丙烷转化率下降
(4)T℃时,在10 L密闭反应器中加入1 mol丙烷进行催化脱氢实验,测得C3H6和C2H4的产率随时间的变化关系,如图2所示。
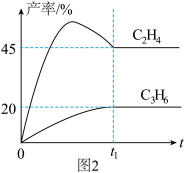
①t1前,相同时间内,C2H4的产率高于C3H6的原因是_____________ 。
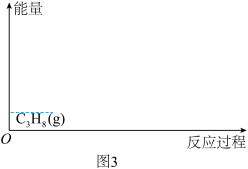
②在图3中绘制主、副反应的“能量~反应过程"示意图__________ 。
主反应CO(g)+H2O(g)
 CO2(g)+H2(g) △H1<0
CO2(g)+H2(g) △H1<0副反应CO(g)+2H2(g)
 CH3OH(g) △H2<0
CH3OH(g) △H2<0(1)关于合成氨工艺的下列说法中,正确的是____。
| A.在合成氨时,控制温度远高于室温是为了保证尽可能高平衡转化率和反应速率 |
| B.在一定压强下, 随着温度的升高,变换塔中CO与CO2的物质的量之比增大 |
| C.为提高原料中H2转化率,应向反应器中加入适当过量的空气 |
| D.体系温度升高,可能导致催化剂失活,用热交换器可将原料气预热并使反应体系冷却 |
II.丙烯是重要的工业品,可用于制取卤代烃、丙醇及塑料等。工业中以丙烷催化脱氢来制取
丙烯:主反应:C3H8(g)=C3H6(g)+H2(g) △H1=+123.0 kJ/mol
副反应:C3H8(g) =CH4(g)+C2H4(g) △H2=+81.30 kJ/mol
(3)不同温度下,丙烷以相同的流速经过装有催化剂的管道,测得丙烷转化率、丙烯选择性和温度的关系如图所示。下列有关丙烷催化脱氢反应说法正确的是

A.主、副反应的△S相等
B.温度升高,丙烯的产率增大
C.单位时间内生成1 mol H-H键,同时消耗1 molC=C键,反应未达到平衡
D.低温有利于C-H键断键,高温有利于C-C键断键
E.高于600℃,温度升高,主、副反应平衡逆移,导致丙烷转化率下降
(4)T℃时,在10 L密闭反应器中加入1 mol丙烷进行催化脱氢实验,测得C3H6和C2H4的产率随时间的变化关系,如图2所示。

①t1前,相同时间内,C2H4的产率高于C3H6的原因是
②在图3中绘制主、副反应的“能量~反应过程"示意图

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是__________ (填标号)。
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为
分别为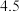 和
和
D. 氢硫酸的还原性强于亚硫酸
(2) 与
与 在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610K时,将0.1mol
在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610K时,将0.1mol 与
与
 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①上述反应平衡常数的表达式为K=________
② 的平衡转化率
的平衡转化率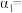
________ %,反应平衡常数K=_________ 。
③在620K重复实验,平衡后水的物质的量分数为0.03, 的转化率
的转化率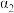
______ 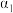 ,该反应的
,该反应的
______ 0。(填“>”“<”或“=”)
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C.
 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为
分别为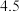 和
和
D. 氢硫酸的还原性强于亚硫酸
(2)
 与
与 在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610K时,将0.1mol
在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610K时,将0.1mol 与
与
 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①上述反应平衡常数的表达式为K=
②
 的平衡转化率
的平衡转化率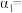
③在620K重复实验,平衡后水的物质的量分数为0.03,
 的转化率
的转化率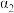
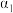 ,该反应的
,该反应的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氯气是重要的化工原料,而高纯氯气也是电子工业干刻、光导纤维、晶体生长和热氧化的主要用品。在工业上,生产氯气的主要途径是电解饱和食盐水。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式______ 。
(2)向饱和食盐水中通入氯化氢气体时,有白色晶体出现。用化学平衡原理说明析出白色晶体的原因___ 。
(3)利用下图装置电解CuCl2溶液,得到氯气。
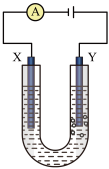
检验氯气的实验方法是______ 。质量增加的电极是_______ (填“X”或“Y”)。若用该装置电解氯化铵溶液,则有氨气逸出,其原因是_______ 。
(4)已知电离常数:H2CO3>HClO> ,向NaClO溶液中通少量CO2,所发生化学反应的离子方程式为
,向NaClO溶液中通少量CO2,所发生化学反应的离子方程式为__ 。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式
(2)向饱和食盐水中通入氯化氢气体时,有白色晶体出现。用化学平衡原理说明析出白色晶体的原因
(3)利用下图装置电解CuCl2溶液,得到氯气。

检验氯气的实验方法是
(4)已知电离常数:H2CO3>HClO>
 ,向NaClO溶液中通少量CO2,所发生化学反应的离子方程式为
,向NaClO溶液中通少量CO2,所发生化学反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收 SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素)。

请回答下列问题:
(1)装置 I 中生成 HSO3-的离子方程式为_______ 。
(2)含硫各微粒(H2SO3、HSO3-和 SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图所示:
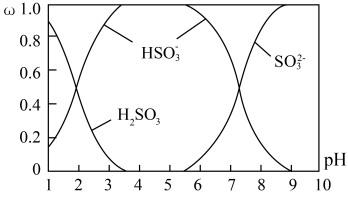
①下列说法正确的是_______ (填标号)。
A. pH=7 时,溶液中 c( Na+)<c(HSO3-)+c(SO32-)
B. 由图中数据,可以估算出 H2SO3 的第二级电离平衡常数 K2≈10-7
C. 为获得尽可能纯的 NaHSO3,应将溶液的 pH 控制在 4~5 为宜
D. pH=9时溶液中 c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3)
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为 2,用化学平衡移动原理解释溶液pH降低的原因_______ 。
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-离子方程式_______ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。
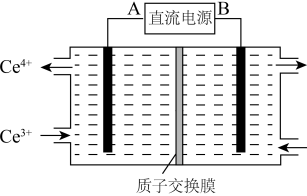
图中A为电源的_______ (填“正”或“负”)极。右侧反应室中发生的主要电极反应为_______ 。
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为0.75 mol/L,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为_______ L

请回答下列问题:
(1)装置 I 中生成 HSO3-的离子方程式为
(2)含硫各微粒(H2SO3、HSO3-和 SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图所示:

①下列说法正确的是
A. pH=7 时,溶液中 c( Na+)<c(HSO3-)+c(SO32-)
B. 由图中数据,可以估算出 H2SO3 的第二级电离平衡常数 K2≈10-7
C. 为获得尽可能纯的 NaHSO3,应将溶液的 pH 控制在 4~5 为宜
D. pH=9时溶液中 c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3)
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为 2,用化学平衡移动原理解释溶液pH降低的原因
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-离子方程式
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

图中A为电源的
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为0.75 mol/L,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是____________ ;盐酸溶解MnCO3的化学方程式是____________ ;
(2)向溶液1中加入双氧水时,反应的离子方程式是____________ ;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是____________ ;
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+_______ =_______ +_______ +_______ ;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是____________ ;
②若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是____________ ;

已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(2)向溶液1中加入双氧水时,反应的离子方程式是
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是
②若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
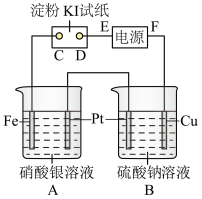
(1)A中发生反应的化学方程式为________ 。
(2)在B中观察到的现象是_______ 。

(1)A中发生反应的化学方程式为
(2)在B中观察到的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用肼
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。
①已知各共价键键能如下表:
 的结构为
的结构为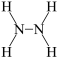 。
。
 ;
;
________  。
。
② 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因___________ 。
(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
① 的电离平衡常数的表达式
的电离平衡常数的表达式
___________ ;
②常温下,等浓度的下列溶液a. ;b.
;b. ;c.
;c. ,其
,其 由大到小的顺序是
由大到小的顺序是___________ (用字母表示)。
(3)某同学设计一个肼
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
 为阳离子交换膜。
为阳离子交换膜。
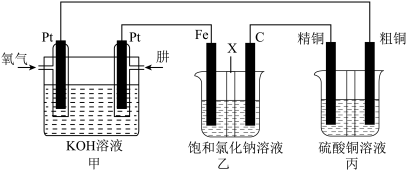
①通入肼的电极为___________ (填“正极”或“负极”),正极的电极反应式为___________ 。
②若甲中有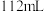 氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为___________ ,丙中硫酸铜溶液的浓度___________ (填“变大”、“变小”或“不变”)。
(1)航天领域中常用肼
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。①已知各共价键键能如下表:
 |  |  |  |  | |
键能 | 946 | 497 | 193 | 391 | 463 |
 的结构为
的结构为 。
。 ;
;
 。
。②
 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
| 弱电解质 |  |  |  |
电离平衡常数 |  | 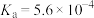 | 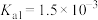 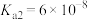 |
 的电离平衡常数的表达式
的电离平衡常数的表达式
②常温下,等浓度的下列溶液a.
 ;b.
;b. ;c.
;c. ,其
,其 由大到小的顺序是
由大到小的顺序是(3)某同学设计一个肼
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中 为阳离子交换膜。
为阳离子交换膜。
①通入肼的电极为
②若甲中有
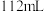 氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
您最近一年使用:0次



