NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,Ksp(CaSO4)=9.1×10-6,Ksp(CaSO3)=3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ•mol-1
NO(g)+ O2(g)=NO2(g) △H=-58.2kJ•mol-1
O2(g)=NO2(g) △H=-58.2kJ•mol-1
则3NO(g)+O3(g)=3NO2(g) △H=______ 。
(2)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为______ 。
(3)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:______ 。
Ⅱ.有人提出用活性炭对NOx进行吸附,比如吸收NO2的反应如下:2C(s)+2NO2(g) N2(g)+2CO2(g) △H=-62.4kJ•mol-1。在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应经过相同时间NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) △H=-62.4kJ•mol-1。在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应经过相同时间NO2的转化率随着压强变化的示意图。
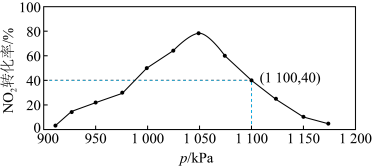
(4)请分析,1050kPa前,NO2转化率随着压强增大而增大的原因:______ 。
(5)在1100kPa时,NO2的体积分数为______ 。用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp),在T2℃、1100kPa时,该反应的化学平衡常数Kp=______ (只需列出计算式 )。已知:气体分压(p分)=气体总压(p总)×体积分数。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,Ksp(CaSO4)=9.1×10-6,Ksp(CaSO3)=3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ•mol-1
NO(g)+
 O2(g)=NO2(g) △H=-58.2kJ•mol-1
O2(g)=NO2(g) △H=-58.2kJ•mol-1则3NO(g)+O3(g)=3NO2(g) △H=
(2)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为
(3)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:
Ⅱ.有人提出用活性炭对NOx进行吸附,比如吸收NO2的反应如下:2C(s)+2NO2(g)
 N2(g)+2CO2(g) △H=-62.4kJ•mol-1。在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应经过相同时间NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) △H=-62.4kJ•mol-1。在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应经过相同时间NO2的转化率随着压强变化的示意图。
(4)请分析,1050kPa前,NO2转化率随着压强增大而增大的原因:
(5)在1100kPa时,NO2的体积分数为
更新时间:2023-05-25 19:58:08
|
相似题推荐
【推荐1】工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用。
Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_______
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质)。写出该电池的负极反应式:_______ 。
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g) CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为
CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________ 。该温度下CO的平衡转化率为_________ 。
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g).
CH3OH(g)+H2O(g).
①下列叙述能说明此反应达到平衡状态的是___________ 。
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为_________ (填序号)
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正__________ v逆。(填“>”、“<”或“=”)
Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质)。写出该电池的负极反应式:
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为
CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g).
CH3OH(g)+H2O(g).①下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】二氧化碳资源化利用是目前研究的热点之一。
(1)二氧化碳可用于重整天然气制合成气( 和
和 )。
)。
①已知下列热化学方程式:


则反应 的
的
___________  。
。
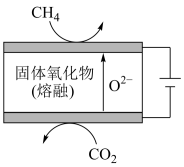
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为___________ 。
(2)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知 核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
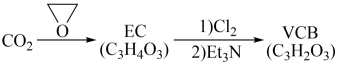
VCB的结构简式为___________ 。
(3)乙烷直接热解脱氢和CO2氧化乙烷脱的相关化学方程式及平衡转化率与温度的关系如下:
(I)乙烷直接热解脱氢: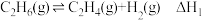
(II)CO2氧化乙烷脱氢:
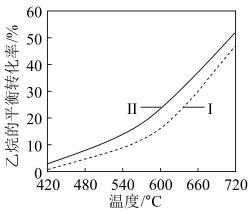
①反应(Ⅰ)的
___________  (填数值,相关键能数据如下表)。
(填数值,相关键能数据如下表)。
②反应(II)乙烷平衡转化率比反应(I)的大,其原因是___________ (从平衡移动角度说明)。
③有学者研究纳米 催化
催化 氧化乙烷脱氡,通过
氧化乙烷脱氡,通过 测定催化剂表面仅存在
测定催化剂表面仅存在 和
和 ,从而说明催化反应历程为:
,从而说明催化反应历程为: 和
和___________ (用方程式表示,不必注明反应条件)。
④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应: 。温度及投料方式(如下表所示),测得反应的相关数据如下:
。温度及投料方式(如下表所示),测得反应的相关数据如下:
下列说法正确的是___________ (填标号)。
A. B.
B. C.
C. D.
D.
(1)二氧化碳可用于重整天然气制合成气(
 和
和 )。
)。①已知下列热化学方程式:


则反应
 的
的
 。
。②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为

(2)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知
 核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。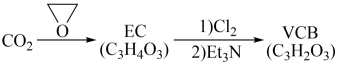
VCB的结构简式为
(3)乙烷直接热解脱氢和CO2氧化乙烷脱的相关化学方程式及平衡转化率与温度的关系如下:
(I)乙烷直接热解脱氢:
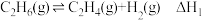
(II)CO2氧化乙烷脱氢:


①反应(Ⅰ)的

 (填数值,相关键能数据如下表)。
(填数值,相关键能数据如下表)。| 化学键 | C-C | C=C | C-H | H-H |
键能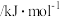 | 347.7 | 615 | 413.4 | 436.0 |
③有学者研究纳米
 催化
催化 氧化乙烷脱氡,通过
氧化乙烷脱氡,通过 测定催化剂表面仅存在
测定催化剂表面仅存在 和
和 ,从而说明催化反应历程为:
,从而说明催化反应历程为: 和
和④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应:
 。温度及投料方式(如下表所示),测得反应的相关数据如下:
。温度及投料方式(如下表所示),测得反应的相关数据如下:| 容器1 | 容器2 | 容器3 | |
| 反应温度T/K | 600 | 600 | 500 |
| 反应物投入量 | 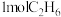 |  | 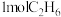 |
平衡时 | 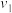 |  |  |
平衡时 |  |  | 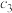 |
| 平衡常数K | K1 | K2 | K3 |
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。已知2I2(s)+5O2(g)=2I2O5(s)△H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________ 。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①b点CO的平衡转化率α为____________ ,c点的平衡常数K为________________ 。
②下列措施能提高该反应CO转化率的是________ (填字母)
a.升高温度b.增大压强c.加入催化剂d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________ (填“酸性”或“碱性”),向上述溶液中通入___________ (填“NH3”或“SO2”)可使溶液呈中性。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
(1)在合成氨工业中I2O5常用于定量测定CO的含量。已知2I2(s)+5O2(g)=2I2O5(s)△H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g)△H=-566kJ·mol-1。则该测定反应的热化学方程式为
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①b点CO的平衡转化率α为
②下列措施能提高该反应CO转化率的是
a.升高温度b.增大压强c.加入催化剂d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】工业上可利用甲烷水蒸气重整制备氢气,体系中发生反应:
ⅰ. CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
ⅱ. CO(g)+H2O(g) CO2(g)+H2(g) ∆H2
CO2(g)+H2(g) ∆H2
(1)①在_______ (填“高温”、“低温”或“任意温度”)条件下有利于反应ⅰ自发进行。
②已知:25℃、101kPa时,部分化学键的键能数据如下表:
请根据提供的键能数据,计算∆H2=_______ kJ∙mol-1。
(2)在恒温恒压下,向密闭容器中充入1molCH4(g)和2molH2O(g)发生甲烷水蒸气重整反应,5min时反应达到平衡,此时n(H2O)=0.8mol,n(CO2)=0.4mol。
①下列可以说明甲烷水蒸气重整反应达到平衡的是_______ (填标号)。
A.H2的体积不变 B.容器内压强不变
C.容器内c(CO) : c(H2O)=1:1 D.混合气体的平均摩尔质量不变
②平衡时,CH4(g)的质量为_______ g,H2(g)的体积分数为_______ (保留三位有效数字)。
③该条件下,反应ⅱ的平衡常数Kp=_______ (分压=总压×物质的量分数)。
(3)为提高H2(g)的平衡产率,可采取的措施为_______(填标号)。
ⅰ. CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1
CO(g)+3H2(g) ∆H1=+206.2kJ∙mol-1 ⅱ. CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2
CO2(g)+H2(g) ∆H2 (1)①在
②已知:25℃、101kPa时,部分化学键的键能数据如下表:
| 化学键 | C≡O (CO) | C=O | H-O | H-H |
| 键能/( kJ∙mol-1) | 1072 | 803 | 464 | 436 |
请根据提供的键能数据,计算∆H2=
(2)在恒温恒压下,向密闭容器中充入1molCH4(g)和2molH2O(g)发生甲烷水蒸气重整反应,5min时反应达到平衡,此时n(H2O)=0.8mol,n(CO2)=0.4mol。
①下列可以说明甲烷水蒸气重整反应达到平衡的是
A.H2的体积不变 B.容器内压强不变
C.容器内c(CO) : c(H2O)=1:1 D.混合气体的平均摩尔质量不变
②平衡时,CH4(g)的质量为
③该条件下,反应ⅱ的平衡常数Kp=
(3)为提高H2(g)的平衡产率,可采取的措施为_______(填标号)。
| A.扩大容器容积 | B.及时移除CO2(g) |
| C.加入催化剂 | D.恒容条件下充入一定量的He |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】碳中和是目前全球关注的热点。将 加氢转化为甲醇是一种有效利用
加氢转化为甲醇是一种有效利用 的方式之一,回答下列问题:
的方式之一,回答下列问题:
(1)已知:
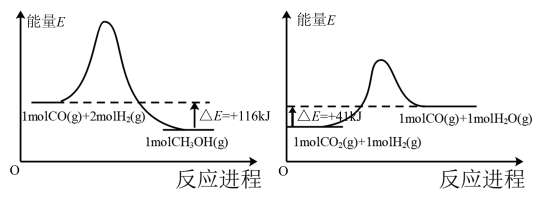
反应 的
的
_______  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
反应Ⅰ: (主反应)
(主反应)
反应Ⅱ:
①反应开始10min内, 的平均反应速率为
的平均反应速率为_______ 。
②该温度下,反应 的平衡常数
的平衡常数
_______ 
③500℃时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是_______ (填标号)。
A. 减小
减小
B.反应Ⅰ正反应速率加快,逆反应速率减慢
C. 的物质的量增加
的物质的量增加
D.重新平衡时,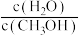 比值增大
比值增大
(3)在上述模拟合成实验中,测得不同温度下的 平衡转化率如下表所示:
平衡转化率如下表所示:
 平衡转化率先减小后增大的原因是
平衡转化率先减小后增大的原因是_______ 。
 加氢转化为甲醇是一种有效利用
加氢转化为甲醇是一种有效利用 的方式之一,回答下列问题:
的方式之一,回答下列问题:(1)已知:

反应
 的
的
 。
。(2)实验室在1L密闭容器中进行模拟合成实验。将
 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L) | 物质/时间 | 10min | 20min | 30min | 40min | 50min | 60min |
 | 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 |
 | 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
反应Ⅰ:
 (主反应)
(主反应)反应Ⅱ:

①反应开始10min内,
 的平均反应速率为
的平均反应速率为②该温度下,反应
 的平衡常数
的平衡常数

③500℃时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是
A.
 减小
减小B.反应Ⅰ正反应速率加快,逆反应速率减慢
C.
 的物质的量增加
的物质的量增加D.重新平衡时,
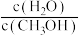 比值增大
比值增大(3)在上述模拟合成实验中,测得不同温度下的
 平衡转化率如下表所示:
平衡转化率如下表所示:| T/℃ | 300 | 500 | 700 |
 平衡转化率/% 平衡转化率/% | 93 | 90 | 92 |
 平衡转化率先减小后增大的原因是
平衡转化率先减小后增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2是一种丰富的碳资源,将其清洁转化为高附加值化学品以实现资源利用是研究热点。
Ⅰ.合成甲醇(CH3OH)
在200~250℃的CO2加氢反应器中,主要反应有:
反应i
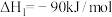
反应ii
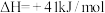
反应iii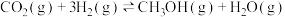

(1)△H3=___________ kJ/mol。
(2)同时也存在副反应iv: ,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因
,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因___________ 。(已知CH3OH的沸点为65℃,CH3OCH3的沸点为-25℃)
Ⅱ.甲醇的综合利用:以CO2和甲醇为原料直接合成碳酸二甲酯(CH3OCOOCH3),反应v.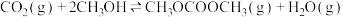

(3)在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。
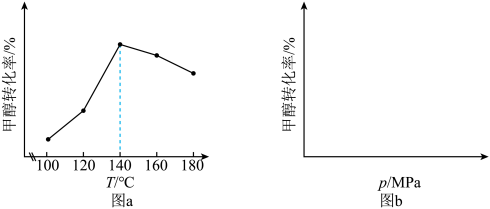
①反应v的△H___________ 0(填“>”或“<”)。
②在100~140℃之间,随着温度升高,甲醇转化率增大的原因是___________ 。
③在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)_____
Ⅰ.合成甲醇(CH3OH)
在200~250℃的CO2加氢反应器中,主要反应有:
反应i

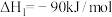
反应ii

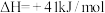
反应iii
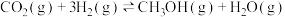

(1)△H3=
(2)同时也存在副反应iv:
 ,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因
,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因Ⅱ.甲醇的综合利用:以CO2和甲醇为原料直接合成碳酸二甲酯(CH3OCOOCH3),反应v.
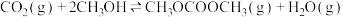

(3)在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。

①反应v的△H
②在100~140℃之间,随着温度升高,甲醇转化率增大的原因是
③在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)
您最近一年使用:0次
【推荐1】丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①
②
(1)反应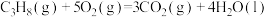 的
的
______ 。
(2)现有1 在不足量的氧气里燃烧,生成1
在不足量的氧气里燃烧,生成1 和2
和2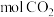 以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是______ 。
A.体系中的压强不发生变化
B.
C.混合气体的平均相对分子质量不发生变化
D. 的浓度不再发生变化
的浓度不再发生变化
②5 后体系达到平衡,经测定,
后体系达到平衡,经测定, 为0.8
为0.8 ,则平衡常数K=
,则平衡常数K=______ 。
③其他条件不变,向平衡体系中充入少量 则平衡常数
则平衡常数______ (填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇( )的氧化锆(
)的氧化锆( )晶体,在其内部可以传导
)晶体,在其内部可以传导 。在电池内部
。在电池内部 由
由______ 极移向______ 极(填“正”或“负”);电池的负极电极反应式:_____________________ 。
①

②

(1)反应
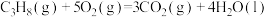 的
的
(2)现有1
 在不足量的氧气里燃烧,生成1
在不足量的氧气里燃烧,生成1 和2
和2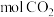 以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
A.体系中的压强不发生变化
B.

C.混合气体的平均相对分子质量不发生变化
D.
 的浓度不再发生变化
的浓度不再发生变化②5
 后体系达到平衡,经测定,
后体系达到平衡,经测定, 为0.8
为0.8 ,则平衡常数K=
,则平衡常数K=③其他条件不变,向平衡体系中充入少量
 则平衡常数
则平衡常数(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(
 )的氧化锆(
)的氧化锆( )晶体,在其内部可以传导
)晶体,在其内部可以传导 。在电池内部
。在电池内部 由
由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可由NO与Cl2反应制得,回答下列问题:
Ⅰ.(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g)ΔH1;K1
NaNO3(s)+NOCl(g)ΔH1;K1
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NO(g)+Cl2(g) 2NOCl(g)ΔH3;K3
2NOCl(g)ΔH3;K3
则ΔH3=___________ (用ΔH1和ΔH2表示)。
Ⅱ.工业上通常用如下反应制备亚硝酰氯:2NO(g)+Cl2(g) 2NOCl(g)ΔH<0。
2NOCl(g)ΔH<0。
(2)已知上述反应中逆反应速率的表达式为v逆=k·cn(NOCl)。300℃时,测得逆反应速率与NOCl的浓度的关系如表所示:
当c(NOCl)=0.50mol·L-1时,v逆=___________ mol·L-1·s-1。
(3)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
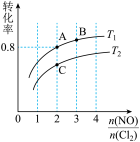
①图中T1、T2的关系为T1___________ T2(填“>”“<”或“=”);图中纵坐标为物质___________ 的转化率。图中A、B、C三点对应的NOCl体积分数最大的是___________ (填“A”“B”或“C”)。
②若容器容积为1L,B点的平衡常数为___________ 。
③若在温度为T1,容积为1L的容器中,充入0.5molNO、1molCl2、2molNOCl,υ(正)___________ υ(逆)(填“<”“>”或“=”)。
Ⅰ.(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)
 NaNO3(s)+NOCl(g)ΔH1;K1
NaNO3(s)+NOCl(g)ΔH1;K14NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K22NO(g)+Cl2(g)
 2NOCl(g)ΔH3;K3
2NOCl(g)ΔH3;K3则ΔH3=
Ⅱ.工业上通常用如下反应制备亚硝酰氯:2NO(g)+Cl2(g)
 2NOCl(g)ΔH<0。
2NOCl(g)ΔH<0。(2)已知上述反应中逆反应速率的表达式为v逆=k·cn(NOCl)。300℃时,测得逆反应速率与NOCl的浓度的关系如表所示:
| c(NOCl)/(mol/L) | v逆/(mol∙L-1∙s-1) |
| 0.20 | 1.6×10-9 |
| 0.40 | 6.4×10-9 |
(3)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为T1
②若容器容积为1L,B点的平衡常数为
③若在温度为T1,容积为1L的容器中,充入0.5molNO、1molCl2、2molNOCl,υ(正)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在10L的恒容密闭容器中发生反应: ,已知反应中化学键数据如表:
,已知反应中化学键数据如表:
回答下列问题:
(1)
_______  。
。
(2)某温度示:向该容器中充入 和
和 ,发生上述反应,
,发生上述反应, 末,反应达到平衡,此时测得
末,反应达到平衡,此时测得 。
。
① 内,
内, 平均反应速率
平均反应速率
_______  。
。
② 的平衡转化率为
的平衡转化率为_______ ,平衡常数K=_______ 。
③反应前后的总压强之比为_______ 。
④下列说法正确的是_______ (填标号)。
A.混合气体的平均相对分子质量不再变化,则反应达到平衡
B.无论反应进行到何种程度,碳、氢、氧三种元素的物质的量之比 一定为10∶20∶59
一定为10∶20∶59
C.加入合适的催化剂,反应速率发生改变的同时,平衡常数的值也发生改变
D.反应达到平衡后,保持其他条件不变,再充入 和
和 ,此时
,此时
 ,已知反应中化学键数据如表:
,已知反应中化学键数据如表:| 化学键 |  |  |  |  |  |
 | 436 | 351 | 745 | 463 | 413 |
回答下列问题:
(1)

 。
。(2)某温度示:向该容器中充入
 和
和 ,发生上述反应,
,发生上述反应, 末,反应达到平衡,此时测得
末,反应达到平衡,此时测得 。
。①
 内,
内, 平均反应速率
平均反应速率
 。
。②
 的平衡转化率为
的平衡转化率为③反应前后的总压强之比为
④下列说法正确的是
A.混合气体的平均相对分子质量不再变化,则反应达到平衡
B.无论反应进行到何种程度,碳、氢、氧三种元素的物质的量之比
 一定为10∶20∶59
一定为10∶20∶59C.加入合适的催化剂,反应速率发生改变的同时,平衡常数的值也发生改变
D.反应达到平衡后,保持其他条件不变,再充入
 和
和 ,此时
,此时
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】硒是典型的半导体材料,在光照射下导电性可提高近千倍。如图是从某工厂的硒化银半导体废料(含Ag2SeO、Cu 单质)中提取硒、银的工艺流程图:
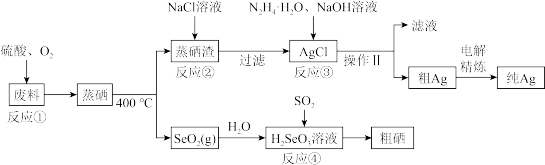
回答下列问题:
(1)写出 Se 的原子结构示意图_______ 。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式_______ 。
(3)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为_______ (写离子方程式);该反应的化学平衡常数的数量级为_______ 。

(4)写出反应④的化学方程式________ 。
(5)室温下,H2SeO3水溶液中的H2SeO3、HSeO3-、SeO32-摩尔分数随 pH 的变化如图 所示,则室温下 SeO32-的 Kh_______ 。

(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生_______ (写电极反应式),若用 10A的电流电解60min后,得到32.4g Ag,则该电解池的电解效率为_______ (保留小数点后一位)。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率,法拉第常数为96500C·mol-1。

回答下列问题:
(1)写出 Se 的原子结构示意图
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子程式
(3)已知:常温下Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示,反应②为

(4)写出反应④的化学方程式
(5)室温下,H2SeO3水溶液中的H2SeO3、HSeO3-、SeO32-摩尔分数随 pH 的变化如图 所示,则室温下 SeO32-的 Kh

(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某工厂采用如下工艺处理镍钴矿硫酸浸取液含(Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+)。实现镍、钴、镁元素的回收。

已知:
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 mol H2SO5中过氧键的数目为___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ (H2SO5的电离第一步完全,第二步微弱);滤渣的成分为MnO2、CaSO4和___________ (填化学式)。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为___________ 时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。

(5)25℃时,“沉镁”中为使Mg2+沉淀完全(Mg2+浓度小于10-5mol/L),需控制pH不低于___________ (精确至0.1)。

已知:
| 物质 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 | Mg(OH)2 |
| Ksp | 10-37.4 | 10-14.7 | 10-14.7 | 10-10.8 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 mol H2SO5中过氧键的数目为
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为

(5)25℃时,“沉镁”中为使Mg2+沉淀完全(Mg2+浓度小于10-5mol/L),需控制pH不低于
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
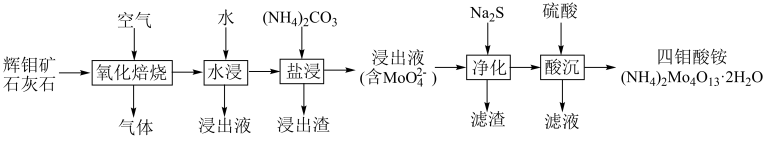
【推荐3】一种以辉钼矿(主要成分为MoS2,含少量Ca、Fe、Cu等元素)为原料制备多钼酸盐的生产工艺如图所示。
ii.K稳[Cu(NH3) ]=
]= =2.0×1013
=2.0×1013
(1)“氧化焙烧”过程:
①MoS2主要转化为CaSO4、____ (填化学式)。
②加入石灰石,有利于降低焙烧温度、____ (从环保角度答题)。
(2)“盐浸”过程,生成MoO 的离子方程式为
的离子方程式为____ 。
(3)“盐浸”过程,少量CuO转化为Cu(NH3) ,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3)
,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3) (aq)+S2-(aq)
(aq)+S2-(aq) CuS(s)+4NH3(aq)的K=
CuS(s)+4NH3(aq)的K=____ 。
(4)“酸沉”过程MoO 会发生聚合生成多钼酸根。
会发生聚合生成多钼酸根。
①生成(NH4)2Mo4O13·2H2O的离子方程式为____ 。
②可以从“滤液”中回收副产品____ (填化学式)。
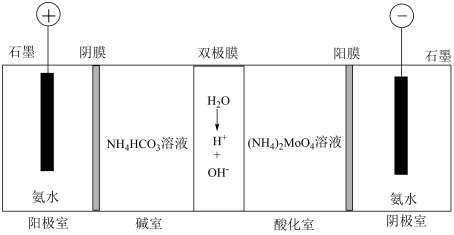
(5)可通过电渗析法制备八钼酸铵[(NH4)4Mo8O26],工作原理如图。其中,阳膜和阴膜分别只允许阳离子、阴离子通过;双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移。____ 。
②分析酸化室可得到Mo8O 的原因:
的原因:____ 。
| 难溶物 | CaMoO4 | CaCO3 | CaSO4 | FeS | CuS |
| Ksp | 4.1×10-3 | 2.8×10-9 | 5.1×10-5 | 6.3×10-18 | 1.0×10-36 |
 ]=
]= =2.0×1013
=2.0×1013(1)“氧化焙烧”过程:
①MoS2主要转化为CaSO4、
②加入石灰石,有利于降低焙烧温度、
(2)“盐浸”过程,生成MoO
 的离子方程式为
的离子方程式为(3)“盐浸”过程,少量CuO转化为Cu(NH3)
 ,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3)
,“净化”过程进一步转化为CuS除去。计算反应Cu(NH3) (aq)+S2-(aq)
(aq)+S2-(aq) CuS(s)+4NH3(aq)的K=
CuS(s)+4NH3(aq)的K=(4)“酸沉”过程MoO
 会发生聚合生成多钼酸根。
会发生聚合生成多钼酸根。①生成(NH4)2Mo4O13·2H2O的离子方程式为
②可以从“滤液”中回收副产品
(5)可通过电渗析法制备八钼酸铵[(NH4)4Mo8O26],工作原理如图。其中,阳膜和阴膜分别只允许阳离子、阴离子通过;双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移。
②分析酸化室可得到Mo8O
 的原因:
的原因:
您最近一年使用:0次



