回答下列问题:
(1)常温下,盐酸和氨水混合,所得溶液pH=7,则此时溶液中c(NH )
)_____ c(Cl-)(填“>”、“<”或“=”)。将0.01mol•L-1的盐酸稀释100倍后的pH=_____ ;向水中加入少量NH4Cl固体,水的电离平衡_____ 移动(填“正向”或“逆向”);用离子方程式解释NH4Cl溶液呈酸性的原因:_____ 。
(2)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
I.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO +5H2O2+6H+=2Mn2++5O2↑+8H2O。
+5H2O2+6H+=2Mn2++5O2↑+8H2O。
①滴定时,将高锰酸钾标准溶液注入______ (填“A”或“B”)滴定管中。
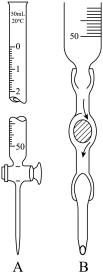
②滴定到达终点的现象是_____ 。
Ⅱ.酸碱中和滴定:常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到如图滴定曲线:
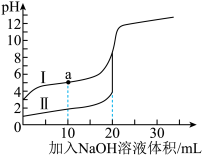
①表示滴定盐酸的曲线是______ (填“I”或“Ⅱ”)。
②当用NaOH标准溶液滴定醋酸溶液,到达滴定终点时,溶液中离子浓度的大小顺序为______ 。
(1)常温下,盐酸和氨水混合,所得溶液pH=7,则此时溶液中c(NH
 )
)(2)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
I.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO
 +5H2O2+6H+=2Mn2++5O2↑+8H2O。
+5H2O2+6H+=2Mn2++5O2↑+8H2O。①滴定时,将高锰酸钾标准溶液注入

②滴定到达终点的现象是
Ⅱ.酸碱中和滴定:常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到如图滴定曲线:

①表示滴定盐酸的曲线是
②当用NaOH标准溶液滴定醋酸溶液,到达滴定终点时,溶液中离子浓度的大小顺序为
更新时间:2023-05-04 23:31:32
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】如图是用0.1000mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。

请回答下列问题:
(1)仪器A的名称是____ 。
(2)盐酸的体积:滴定前读数为____ mL,滴定后读数为____ mL。
(3)某实验小组同学三次实验的实验数据如表所示。根据表中数据计算出待测NaOH溶液的浓度是____ mol·L-1(保留四位有效数字)。
(4)对下列几种情况进行讨论:
①盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,会使测定结果____ (填“偏高”“偏低”或“不变”,下同)。
②若锥形瓶中有少量蒸馏水,会使测定结果____ 。
③标准液读数时,若滴定前俯视,滴定后仰视,会使测定结果____ 。

请回答下列问题:
(1)仪器A的名称是
(2)盐酸的体积:滴定前读数为
(3)某实验小组同学三次实验的实验数据如表所示。根据表中数据计算出待测NaOH溶液的浓度是
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
①盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,会使测定结果
②若锥形瓶中有少量蒸馏水,会使测定结果
③标准液读数时,若滴定前俯视,滴定后仰视,会使测定结果
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有下列物质:Ⅰ.苛性钾溶液 Ⅱ. Ⅲ.
Ⅲ. Ⅳ.
Ⅳ.

(1)若在大试管的水中加入含有适量Ⅱ的溶液,则铁钉发生的腐蚀为_______ 腐蚀,正极的电极反应式为_______ 。
(2)若在大试管的水中加入含有适量Ⅲ的饱和溶液,则铁钉发生的腐蚀为_______ 腐蚀,U形管的液面:a_______ (填“高于”、“低于”或“等于”)b。
(3)用 的Ⅰ滴定未知浓度的Ⅳ溶液。
的Ⅰ滴定未知浓度的Ⅳ溶液。
①盛装IV溶液的滴定管为_______ (填“a”或“b”)。

②若用酚酞作指示剂,则到达滴定终点时的现象为_______
③平行滴定三次所得的实验数据如下表:
Ⅳ溶液的浓度为_______  。
。
④下列操作使测定结果偏大的是_______ (填标号)。
A.锥形瓶用待测液润洗
B.滴定前滴定管无气泡,滴定后有气泡
C.到达滴定终点时仰视读数
 Ⅲ.
Ⅲ. Ⅳ.
Ⅳ.

(1)若在大试管的水中加入含有适量Ⅱ的溶液,则铁钉发生的腐蚀为
(2)若在大试管的水中加入含有适量Ⅲ的饱和溶液,则铁钉发生的腐蚀为
(3)用
 的Ⅰ滴定未知浓度的Ⅳ溶液。
的Ⅰ滴定未知浓度的Ⅳ溶液。①盛装IV溶液的滴定管为

②若用酚酞作指示剂,则到达滴定终点时的现象为
③平行滴定三次所得的实验数据如下表:
| 实验次数 | Ⅰ的体积 | Ⅳ溶液的体积 |
| 1 | 20.02 | 25.00 |
| 2 | 19.98 | 25.00 |
| 3 | 20.00 | 25.00 |
 。
。④下列操作使测定结果偏大的是
A.锥形瓶用待测液润洗
B.滴定前滴定管无气泡,滴定后有气泡
C.到达滴定终点时仰视读数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】晶体碘酸钾 是二种常用的食品添加剂,加热至560℃开始分解,不溶于乙醇。可通过以下转化得到(部分产物未列出)。
是二种常用的食品添加剂,加热至560℃开始分解,不溶于乙醇。可通过以下转化得到(部分产物未列出)。
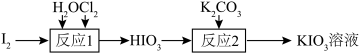
请回答下列问题:
(1)写出反应1的化学方程式:___________ 。
(2)判断反应2中 已完全反应的实验现象是
已完全反应的实验现象是___________ 。
(3)提纯 溶液得到较大
溶液得到较大 晶体颗粒的实验方法是
晶体颗粒的实验方法是___________ 。(实验须使用乙醇试剂与低温条件)
(4)产品碘酸钾纯度测定:准确称取 产品转移至
产品转移至 容量瓶中定容,精确量取
容量瓶中定容,精确量取 该溶液置于锥形瓶中,加入足量碘化钾,用
该溶液置于锥形瓶中,加入足量碘化钾,用 盐酸酸化,盖紧塞子,置于避光处
盐酸酸化,盖紧塞子,置于避光处 ,用
,用 硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点
硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点 。平行滴定三次,平均消耗
。平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。
。
①滴定终点的现象是___________ 。
②计算产品的纯度___________ (请写出计算过程,结果保留三位有效数字)。
 是二种常用的食品添加剂,加热至560℃开始分解,不溶于乙醇。可通过以下转化得到(部分产物未列出)。
是二种常用的食品添加剂,加热至560℃开始分解,不溶于乙醇。可通过以下转化得到(部分产物未列出)。
请回答下列问题:
(1)写出反应1的化学方程式:
(2)判断反应2中
 已完全反应的实验现象是
已完全反应的实验现象是(3)提纯
 溶液得到较大
溶液得到较大 晶体颗粒的实验方法是
晶体颗粒的实验方法是(4)产品碘酸钾纯度测定:准确称取
 产品转移至
产品转移至 容量瓶中定容,精确量取
容量瓶中定容,精确量取 该溶液置于锥形瓶中,加入足量碘化钾,用
该溶液置于锥形瓶中,加入足量碘化钾,用 盐酸酸化,盖紧塞子,置于避光处
盐酸酸化,盖紧塞子,置于避光处 ,用
,用 硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点
硫代硫酸钠溶液滴定,当溶液呈淡黄色时,加入少许淀粉溶液,继续滴定至终点 。平行滴定三次,平均消耗
。平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。
。①滴定终点的现象是
②计算产品的纯度
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】常温时,向体积均为V0、浓度均为1mol/L的HClO2和HBF4两种酸溶液中分别加水,稀释至体积为V,稀释过程中溶液pH随( )的变化如下图所示。
)的变化如下图所示。

回答下列问题:
(1)HBF4为___________ 酸(填“强”或“弱”)。
(2)HClO2的电离方程式为___________ 。
(3)b→c过程中,HBF4溶液被稀释了___________ 倍。
(4)中和等体积、pH均为3的这两种酸溶液,消耗NaOH的物质的量较多的是___________ (写出化学式)。
(5)依据a点,Ka(HClO2)=___________ (结果保留两位有效数字)。
 )的变化如下图所示。
)的变化如下图所示。
回答下列问题:
(1)HBF4为
(2)HClO2的电离方程式为
(3)b→c过程中,HBF4溶液被稀释了
(4)中和等体积、pH均为3的这两种酸溶液,消耗NaOH的物质的量较多的是
(5)依据a点,Ka(HClO2)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是_________ ,pH由大到小的顺序是__________ 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是___________ 。
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为____________ 。
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为________ 。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】用实验确定某酸HA是弱电解质。甲、乙两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________ 1(填“>”“<”或“=”),乙方案中,说明HA是弱电解质的现象是________ (填序号)。
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处________ 。
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:________ 。
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知电导率越大溶液导电能力越强。常温下用0.20mol/LNaOH溶液分别滴定10.00mL浓度均为0.20mol/L的盐酸和醋酸溶液,测得滴定过程中溶液的导电率如图所示(忽略滴定过程中溶液混合后的体积变化)。回答下列问题:

(1)表示滴定醋酸的曲线是___________ (填①或②),滴定醋酸的过程选择的指示剂最好为___________ 。
(2)a、b两点溶液中水的电离程度大小关系是a___________ b(填“>”、“<”或“=”)。
(3)常温下,向上述醋酸溶液中滴加10.00mL浓度为0.20mol/L的NaOH溶液,恰好中和,溶液pH=9,则醋酸的电离常数Ka=___________ 。
(4)b点溶液中:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)几种弱酸的电离平衡常数如下表所示:
①向次氯酸钠溶液中通入少量的 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
②向次氯酸钠溶液中通入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
③向碳酸钠溶液中加入足量的亚硫酸氢钠,发生反应的离子方程式为___________ 。

(1)表示滴定醋酸的曲线是
(2)a、b两点溶液中水的电离程度大小关系是a
(3)常温下,向上述醋酸溶液中滴加10.00mL浓度为0.20mol/L的NaOH溶液,恰好中和,溶液pH=9,则醋酸的电离常数Ka=
(4)b点溶液中:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)几种弱酸的电离平衡常数如下表所示:
| 弱酸 |  |  | HClO |
| 电离平衡常数(25℃) | 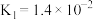 |  |  |
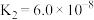 |  |
 ,发生反应的离子方程式为
,发生反应的离子方程式为②向次氯酸钠溶液中通入足量的
 ,发生反应的离子方程式为
,发生反应的离子方程式为③向碳酸钠溶液中加入足量的亚硫酸氢钠,发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】根据表中所列四种物质的溶液(均为0.1000mol/L)在25℃时的相关数据,按要求填空:
(1)用离子方程式表示(Ⅰ)溶液酸性最强的主要原因______ 。
(2)25℃时,(Ⅱ)溶液和(Ⅳ)溶液中由水电离出的c(H+)之比是______ 。
(3)比较(Ⅰ)、(Ⅱ)、(Ⅲ)溶液中c(NH )由大到小的顺序是
)由大到小的顺序是______ (填标号)。
(4)向10mL的(Ⅳ)溶液中加入蒸馏水,将其稀释到1L后,下列说法正确的是______ (填标号)。
(5)某温度下,用0.1000mol/LNaOH溶液滴定20.00mL(Ⅳ)溶液所得到滴定曲线如图:

①该温度下,CH3COOH的电离平衡常数Ka=_____ 。
②当NaOH溶液的体积为10.00mL时,溶液中:c(A-)+c(OH-)______ c(H+)+c(HA)(填“>”、“<”或“=”)
③滴定时若选择酚酞做指示剂,判断滴定终点的方法是:______ 。
| 溶液编号 | (Ⅰ) | (Ⅱ) | (Ⅲ) | (Ⅳ) |
| 溶质 | NH4Fe(SO4)2 | NH4Cl | (NH4)2SO4 | CH3COOH |
| pH | 2.5 | 6 | 5.5 | 3 |
(1)用离子方程式表示(Ⅰ)溶液酸性最强的主要原因
(2)25℃时,(Ⅱ)溶液和(Ⅳ)溶液中由水电离出的c(H+)之比是
(3)比较(Ⅰ)、(Ⅱ)、(Ⅲ)溶液中c(NH
 )由大到小的顺序是
)由大到小的顺序是(4)向10mL的(Ⅳ)溶液中加入蒸馏水,将其稀释到1L后,下列说法正确的是
| A.CH3COOH的电离程度增大 | B.c(CH3COO-)减小 |
C. 增大 增大 | D. 的数目增多 的数目增多 |

①该温度下,CH3COOH的电离平衡常数Ka=
②当NaOH溶液的体积为10.00mL时,溶液中:c(A-)+c(OH-)
③滴定时若选择酚酞做指示剂,判断滴定终点的方法是:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)常温下, 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是___________ 。
A. B.
B. C.
C.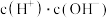 D.
D. E.
E.
(2)25℃时,在一定体积pH=13的 溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则
溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则 为
为___________ 。
(3)常温下,向 的CH3COOH溶液中滴加等体积的
的CH3COOH溶液中滴加等体积的 的NaOH溶液,充分反应后溶液中
的NaOH溶液,充分反应后溶液中 ,则CH3COOH的电离常数
,则CH3COOH的电离常数
___________ 。
(1)常温下,
 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是A.
 B.
B. C.
C.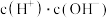 D.
D. E.
E.
(2)25℃时,在一定体积pH=13的
 溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则
溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则 为
为(3)常温下,向
 的CH3COOH溶液中滴加等体积的
的CH3COOH溶液中滴加等体积的 的NaOH溶液,充分反应后溶液中
的NaOH溶液,充分反应后溶液中 ,则CH3COOH的电离常数
,则CH3COOH的电离常数
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中水电离出的c(H+)______ 0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=______ mol·L-1;c(H+)-c(MOH) =______ mol·L-1
(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度______ MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为______ 。
(1)①混合溶液中水电离出的c(H+)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=
(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为__________________ ;
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为___________________ ;
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为____________________ ;
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因____________________ ;
(5) NaHCO3溶液中粒子浓度由大到小的顺序是______________________________ 。
(6)常温下,NaHSO3溶液中粒子浓度由大到小的顺序是______________________________ 。
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因
(5) NaHCO3溶液中粒子浓度由大到小的顺序是
(6)常温下,NaHSO3溶液中粒子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)______  填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
(2)如图是0.1mol/L电解质溶液的pH随温度变化的图像:

①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是______ (填写字母);
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______ mol/L
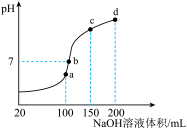
(3)室温时,向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是______ ;在b点,溶液中各离子浓度由大到小的排列顺序是 ______
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+______  填“能”或“不能”
填“能”或“不能” 完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+)
 填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。 (2)如图是0.1mol/L电解质溶液的pH随温度变化的图像:

①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=
(3)室温时,向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+
 填“能”或“不能”
填“能”或“不能” 完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L 时,沉淀完全)
您最近一年使用:0次



