回答下列问题:
(1)常温下, 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是___________ 。
A. B.
B. C.
C.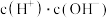 D.
D. E.
E.
(2)25℃时,在一定体积pH=13的 溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则
溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则 为
为___________ 。
(3)常温下,向 的CH3COOH溶液中滴加等体积的
的CH3COOH溶液中滴加等体积的 的NaOH溶液,充分反应后溶液中
的NaOH溶液,充分反应后溶液中 ,则CH3COOH的电离常数
,则CH3COOH的电离常数
___________ 。
(1)常温下,
 溶液加水稀释过程中,下列表达式数据变大的是
溶液加水稀释过程中,下列表达式数据变大的是A.
 B.
B. C.
C.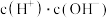 D.
D. E.
E.
(2)25℃时,在一定体积pH=13的
 溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则
溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,忽略溶液体积变化,则 为
为(3)常温下,向
 的CH3COOH溶液中滴加等体积的
的CH3COOH溶液中滴加等体积的 的NaOH溶液,充分反应后溶液中
的NaOH溶液,充分反应后溶液中 ,则CH3COOH的电离常数
,则CH3COOH的电离常数
更新时间:2023-10-26 19:57:29
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】醋酸在自然界分布广泛,具有重要用途。
(1)室温下,冰醋酸稀释过程中溶液的导电能力变化如图所示。

①A、B、C三点对应的溶液中,c(H+)最大的是____ (填字母,下同)。
②A、B、C三点对应的溶液中,CH3COOH电离程度最大的是____ 。
③若使B点对应的溶液中,c(CH3COO-)增大、c(H+)减小,可采用的方法是____ 。
a.加H2O b.加NaOH固体 c.加入浓硫酸
(2)室温下,电离常数如下:
①HCN的电离方程式是___________ 。
②物质的量浓度相同的NaF和CH3COONa溶液的pH大小:NaF____ CH3COONa(填“<”“>”或“=”)。
③结合电离常数判断,NaCN + HF = HCN + NaF进行的比较完全,其理由是_________ 。
(1)室温下,冰醋酸稀释过程中溶液的导电能力变化如图所示。

①A、B、C三点对应的溶液中,c(H+)最大的是
②A、B、C三点对应的溶液中,CH3COOH电离程度最大的是
③若使B点对应的溶液中,c(CH3COO-)增大、c(H+)减小,可采用的方法是
a.加H2O b.加NaOH固体 c.加入浓硫酸
(2)室温下,电离常数如下:
| 酸 | HF | CH3COOH | HCN |
| 电离常数(Ka) | 6.3×10-4 | 1.75×10-5 | 6.2×10-10 |
②物质的量浓度相同的NaF和CH3COONa溶液的pH大小:NaF
③结合电离常数判断,NaCN + HF = HCN + NaF进行的比较完全,其理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___ ;B__ ;C__ 。
(2)溶液中共有__ 种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是___ ,浓度为0.002mol/L的是___ 。
(4)___ 和___ 两种粒子物质的量之和等于0.01mol。
(5)写出该溶液中的电荷守恒关系___ 。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A
(2)溶液中共有
(3)在这些粒子中,浓度为0.01mol/L的是
(4)
(5)写出该溶液中的电荷守恒关系
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】现有常温下的六份溶液:①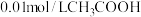 溶液;②
溶液;②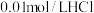 溶液;③
溶液;③ 的氨水;④
的氨水;④ 的
的 溶液;⑤
溶液;⑤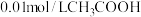 溶液与
溶液与 的氨水等体积混合后所得溶液;⑥
的氨水等体积混合后所得溶液;⑥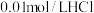 溶液与
溶液与 的
的 溶液等体积混合所得溶液。
溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_______ (选填序号,下同)
(2)若将②、③混合后所得溶液 ,则消耗溶液的体积:②
,则消耗溶液的体积:②_______ ③(选填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)若将①、④溶液按体积比为 ∶
∶ 混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:
混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:_______ 。
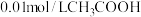 溶液;②
溶液;②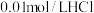 溶液;③
溶液;③ 的氨水;④
的氨水;④ 的
的 溶液;⑤
溶液;⑤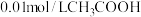 溶液与
溶液与 的氨水等体积混合后所得溶液;⑥
的氨水等体积混合后所得溶液;⑥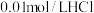 溶液与
溶液与 的
的 溶液等体积混合所得溶液。
溶液等体积混合所得溶液。(1)其中水的电离程度最大的是
(2)若将②、③混合后所得溶液
 ,则消耗溶液的体积:②
,则消耗溶液的体积:② ”、“
”、“ ”或“
”或“ ”)。
”)。(3)若将①、④溶液按体积比为
 ∶
∶ 混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:
混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】弱电解质的电离平衡、盐类的水解平衡均属于溶液中的离子平衡。根据要求回答问题。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是______ (填“强电解质”或“弱电解质”),其电离方程式____________________________________ 。
(2)已知:常温下0.1mol·L-1BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈____ 性,请用离子方程式解释原因________________ 。
②当混合溶液pH=7时,溶液中离子浓度大小关系是_____________________ 。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是
(2)已知:常温下0.1mol·L-1BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈
②当混合溶液pH=7时,溶液中离子浓度大小关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】认识和运用水溶液中的离子反应及其平衡原理,有助于指导工农业生产和科学研究。
(1)已知室温下
①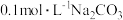 溶液的
溶液的
_______ (填“>”“<”或“=”) 溶液的
溶液的 。
。
②等浓度 溶液和
溶液和 溶液中,氢离子浓度较大的是
溶液中,氢离子浓度较大的是_______ 。
③若将等浓度的 溶液和
溶液和 溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是
溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是_______ 。
A.
B.
C.
D.
(2)向 溶液中滴加少量
溶液中滴加少量 溶液,写出发生反应的离子方程式:
溶液,写出发生反应的离子方程式:_______ 。
(3) 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放。
的排放。
方法1(双碱法):用 溶液吸收
溶液吸收 ,并用
,并用 使
使 再生
再生

①写出过程i的离子方程式:_______
② 在水中存在如下转化:
在水中存在如下转化:

从平衡移动的角度,简述过程ⅱ中 再生的原理:
再生的原理:_______ 。
(4)方法2:用亚硫酸盐 吸收烟气中的
吸收烟气中的 ,会生成酸式盐
,会生成酸式盐
①已知 溶液呈酸性,比较
溶液呈酸性,比较 以及溶液中各种含硫元素微粒的浓度大小关系
以及溶液中各种含硫元素微粒的浓度大小关系_______ 。
②已知用亚硫酸盐 吸收
吸收 的过程中含硫组分物质的量分数
的过程中含硫组分物质的量分数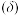 与溶液
与溶液 的变化关系如图所示。下列说法错误是的
的变化关系如图所示。下列说法错误是的_______ 。(填编号)

a.若X为 ,当吸收液呈中性时,
,当吸收液呈中性时,
b.若X为 ,当吸收液
,当吸收液 时,
时,
c.若X为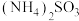 ,
,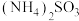 溶液呈碱性,说明水解程度:
溶液呈碱性,说明水解程度:
d.若X为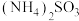 ,图中b点溶液中
,图中b点溶液中
(1)已知室温下
| 化学式 |  |  |
| 电离常数 |  |  |
①
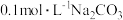 溶液的
溶液的
 溶液的
溶液的 。
。②等浓度
 溶液和
溶液和 溶液中,氢离子浓度较大的是
溶液中,氢离子浓度较大的是③若将等浓度的
 溶液和
溶液和 溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是
溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是A.

B.

C.

D.

(2)向
 溶液中滴加少量
溶液中滴加少量 溶液,写出发生反应的离子方程式:
溶液,写出发生反应的离子方程式:(3)
 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放。
的排放。方法1(双碱法):用
 溶液吸收
溶液吸收 ,并用
,并用 使
使 再生
再生
①写出过程i的离子方程式:
②
 在水中存在如下转化:
在水中存在如下转化:
从平衡移动的角度,简述过程ⅱ中
 再生的原理:
再生的原理:(4)方法2:用亚硫酸盐
 吸收烟气中的
吸收烟气中的 ,会生成酸式盐
,会生成酸式盐
①已知
 溶液呈酸性,比较
溶液呈酸性,比较 以及溶液中各种含硫元素微粒的浓度大小关系
以及溶液中各种含硫元素微粒的浓度大小关系②已知用亚硫酸盐
 吸收
吸收 的过程中含硫组分物质的量分数
的过程中含硫组分物质的量分数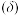 与溶液
与溶液 的变化关系如图所示。下列说法错误是的
的变化关系如图所示。下列说法错误是的
a.若X为
 ,当吸收液呈中性时,
,当吸收液呈中性时,
b.若X为
 ,当吸收液
,当吸收液 时,
时,
c.若X为
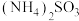 ,
,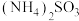 溶液呈碱性,说明水解程度:
溶液呈碱性,说明水解程度:
d.若X为
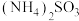 ,图中b点溶液中
,图中b点溶液中
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】在室温下,下列五种溶液,请根据要求填写下列空白:
①0.1mol•L-1NH4Cl溶液;②0.1mol•L-1CH3COONH4溶液;③0.1mol•L-1NH4HSO4溶液;④0.1mol•L-1NH3·H2O和0.1mol•L-1NH4Cl混合液;⑤0.1mol•L-1氨水
(1)溶液①呈___ (填“酸”、“碱”或“中”)性,其原因是___ (用离子方程式表示)。
(2)溶液①至⑤中,c(NH )从大到小的顺序是
)从大到小的顺序是___ 。
(3)在溶液④中___ (填离子符号)的浓度为0.1mol/L;NH3·H2O和___ (填离子符号)的浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___ (填“>”、“<”或“=”,下同)NH 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-)___ c(NH )。
)。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:___ 。
②若溶液M由10mL2mol•L-1NaHA溶液与10mL2mol•L-1NaOH溶液混合而得,则溶液M的pH___ (填“>”、“<”或“=”)7。
①0.1mol•L-1NH4Cl溶液;②0.1mol•L-1CH3COONH4溶液;③0.1mol•L-1NH4HSO4溶液;④0.1mol•L-1NH3·H2O和0.1mol•L-1NH4Cl混合液;⑤0.1mol•L-1氨水
(1)溶液①呈
(2)溶液①至⑤中,c(NH
 )从大到小的顺序是
)从大到小的顺序是(3)在溶液④中
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度
 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-) )。
)。(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:
②若溶液M由10mL2mol•L-1NaHA溶液与10mL2mol•L-1NaOH溶液混合而得,则溶液M的pH
您最近一年使用:0次



