乙二酸(H2C2O4 )俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。25°C时,向10mL、0.1mol/LH2C2O4溶液中逐滴加入0.1mol/L的NaOH溶液,溶液中含碳微粒的物 质的量分数随溶液pH 的变化如图所示。下列叙述错误的是
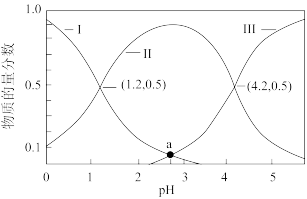

A.曲线Ⅱ表示溶液中 的物质的量分数随溶液 pH 的变化 的物质的量分数随溶液 pH 的变化 |
B.25°C 时,H2C2O4的电离平衡常数分别是Ka1、Ka2,则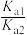 =1000 =1000 |
C.pH为2.5~5.5过程中主要发生反应的离子方程式是OH-+ = = +H2O +H2O |
D.当加入20mlNaOH 溶液时,溶液中阴离子浓度由大到小的顺序为:c( )>c( )>c( )> c(OH-) )> c(OH-) |
更新时间:2023-06-02 20:25:01
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】某温度下,向一定体积0.1mol/L 氨水溶液中逐滴加入等浓度的HCl溶液,溶液中pOH [pOH=-lgc(OH)]与pH 的变化关系如图所示,则下列说法错误的是
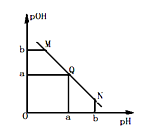

| A.M 点和N 点所示溶液中水的电离程度相同 |
| B.M点所示溶液导电能力弱于Q点 |
| C.Q点消耗盐酸溶液的体积等于氨水溶液的体积 |
| D.M 点所示溶液中c(NH4+) > c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】已知:Ka1(H2SO3)=1.0×10-1.85、Ka2(H2SO3)=1.0×10-7。通过0.1mol·L−1NaOH溶液滴定20 mL0.1mol·L−1H2SO3溶液实验探究H2SO3、Na2SO3、NaHSO3溶液的性质。
实验1:滴入10 mL 0.1mol·L−1NaOH溶液时测得溶液的pH=1.85。
实验2:向实验1所得溶液中继续滴入10 mL 0.1mol·L−1NaOH溶液时无明显现象。
实验3:向实验2所得溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略)。
实验4:向实验2所得溶液中滴加HNO3酸化的Ba(NO3)2溶液,产生白色沉淀。
下列说法正确的是
实验1:滴入10 mL 0.1mol·L−1NaOH溶液时测得溶液的pH=1.85。
实验2:向实验1所得溶液中继续滴入10 mL 0.1mol·L−1NaOH溶液时无明显现象。
实验3:向实验2所得溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略)。
实验4:向实验2所得溶液中滴加HNO3酸化的Ba(NO3)2溶液,产生白色沉淀。
下列说法正确的是
A.实验1溶液中存在:2c(H2SO3)+ c(SO )=0.1 mol·L−1 )=0.1 mol·L−1 |
B.实验2溶液中存在:c(Na+)>c(HSO )>c(SO )>c(SO )>c(H2SO3) )>c(H2SO3) |
C.实验3溶液中存在:c(Na+)>c(NH )>c(SO )>c(SO ) ) |
D.实验4反应后静置所得上层清液中一定有:c(Ba2+)×c(SO )=Ksp(BaSO3) )=Ksp(BaSO3) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】改变0.1mol•L—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA—)+c(A2—)])。下列叙述正确的是
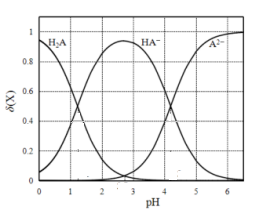

| A.Ka2(H2A)的数量级为10-4 |
| B.NaHA溶液中,HA-的水解能力小于HA-的电离能力 |
| C.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,δ(HA-)一定增大 |
| D.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中δ(HA-)=δ(A2-) |
您最近一年使用:0次
【推荐1】已知Ka1(H2CO3)=4.5×10−7,Ka2(H2CO3)=4.7×10−11,Ka(HClO)=4.0×10−8。下列离子方程式对事实的表述不正确的是
| A.电解饱和食盐水的阴极反应:2H2O+2e−=H2↑+2OH− |
B.向NaClO溶液中通入少量CO2:CO2+H2O+2ClO-= +2HClO +2HClO |
| C.向氯化银悬浊液中加入适量KI溶液,产生黄色沉淀,证明AgI比AgCl更难溶:AgCl(s)+I-(aq)⇌AgI(s)+Cl-(aq) |
D.泡沫灭火器反应原理:Al3++3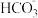 =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,用NaOH溶液滴定 溶液,混合溶液的pH与离子浓度变化的关系如图所示,图中pX代表
溶液,混合溶液的pH与离子浓度变化的关系如图所示,图中pX代表 或
或 。下列叙述错误的是
。下列叙述错误的是
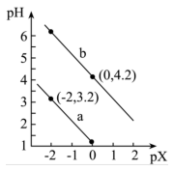
 溶液,混合溶液的pH与离子浓度变化的关系如图所示,图中pX代表
溶液,混合溶液的pH与离子浓度变化的关系如图所示,图中pX代表 或
或 。下列叙述错误的是
。下列叙述错误的是
A.曲线a表示pH与 的变化关系 的变化关系 |
B.当 被完全中和时, 被完全中和时,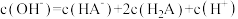 |
C. 的第一步电离常数为0.1 的第一步电离常数为0.1 |
D.当NaOH与 等量反应后,溶液呈酸性 等量反应后,溶液呈酸性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】25℃时,①浓度为0.1mol/L的氨水和②浓度为0.01mol/L的氨水,下列判断不正确的是
| A.存在的粒子种类相同 |
B. 的电离程度① 的电离程度① ② ② |
| C.中和等体积等浓度的盐酸,需要②的体积是①的10倍 |
D. 的值:① 的值:① ② ② |
您最近一年使用:0次



