绿柱石(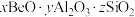 )获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
)获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
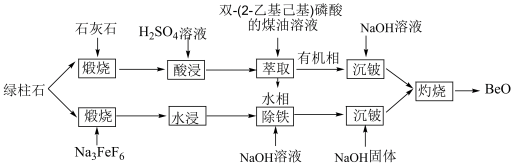
(1)为了提高“煅烧”反应的转化率,可采用的措施有___________ (写一条)。
(2)“萃取”后,水相中主要含的金属离子为___________ (填离子符号);已知Be在有机相和水相中分配比(即萃取的浓度比)约为2∶1,为了使 的萃取率达到99%以上,可采用的有效措施有
的萃取率达到99%以上,可采用的有效措施有___________ (写一条)。
(3)加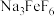 “煅烧”时,有
“煅烧”时,有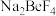 生成,则煅烧时发生的化学方程式为
生成,则煅烧时发生的化学方程式为___________ ;产物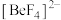 的VSEPR模型为
的VSEPR模型为___________ 。
(4)加入NaOH“除铁”时,是为了除去过量的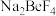 ,则发生的离子方程式为
,则发生的离子方程式为___________ 。
(5)加入NaOH“沉铍”时,为使得沉铍率达到99.9%,应调节溶液的pH值为___________ (计算结果保留至小数点后一位)。已知:沉铍前,溶液中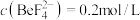 ,
,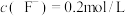 ;
; ,
,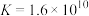 ;
;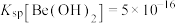 ;
; 。
。
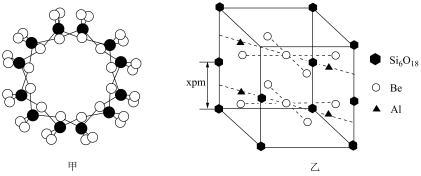
(6)绿柱石属于硅酸盐材料,其晶体结构中含有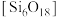 环状硅酸盐单元;z轴方向上,相邻两层
环状硅酸盐单元;z轴方向上,相邻两层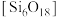 环投影图如图甲,晶胞结构如图乙。
环投影图如图甲,晶胞结构如图乙。
①z轴方向上,晶胞参数c为2xpm,而不是xpm的原因是___________ 。
②绿柱石的化学式为___________ 。
③已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1∶2.通过计算可确定Al的配付数应为___________ 。
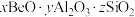 )获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
)获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
(1)为了提高“煅烧”反应的转化率,可采用的措施有
(2)“萃取”后,水相中主要含的金属离子为
 的萃取率达到99%以上,可采用的有效措施有
的萃取率达到99%以上,可采用的有效措施有(3)加
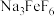 “煅烧”时,有
“煅烧”时,有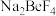 生成,则煅烧时发生的化学方程式为
生成,则煅烧时发生的化学方程式为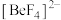 的VSEPR模型为
的VSEPR模型为(4)加入NaOH“除铁”时,是为了除去过量的
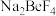 ,则发生的离子方程式为
,则发生的离子方程式为(5)加入NaOH“沉铍”时,为使得沉铍率达到99.9%,应调节溶液的pH值为
 ,
,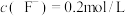 ;
; ,
,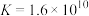 ;
;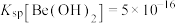 ;
; 。
。(6)绿柱石属于硅酸盐材料,其晶体结构中含有
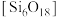 环状硅酸盐单元;z轴方向上,相邻两层
环状硅酸盐单元;z轴方向上,相邻两层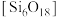 环投影图如图甲,晶胞结构如图乙。
环投影图如图甲,晶胞结构如图乙。①z轴方向上,晶胞参数c为2xpm,而不是xpm的原因是
②绿柱石的化学式为
③已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1∶2.通过计算可确定Al的配付数应为

更新时间:2023-05-14 16:00:34
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】1.亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究:
Ⅰ.鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10,分别向盛有5mL 0.0001 mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有_____ 溶液的试管。
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是_______ (用离子方程式解释)。
Ⅱ. 如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
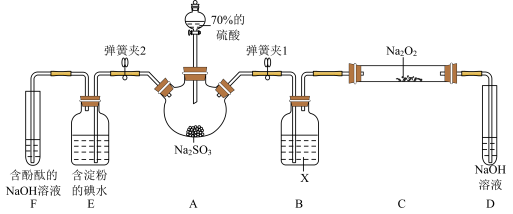
(1)装置B中试剂X是_______ ,装置D中盛放NaOH溶液的作用是_______________________ 。
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_____________________ 。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为______________ ;发生反应的离子方程式是_____________________ 。
Ⅲ. 用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
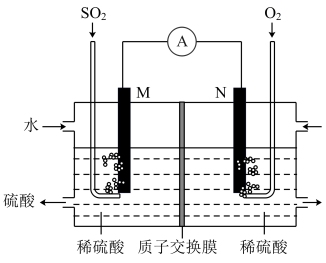
(1)M极发生的电极反应式为____________________________ 。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为_____ L(已知:1个e所带电量为1.6×10-19C)。(保留两位有效数字)
Ⅰ.鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10,分别向盛有5mL 0.0001 mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是
Ⅱ. 如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

(1)装置B中试剂X是
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为
Ⅲ. 用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

(1)M极发生的电极反应式为
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
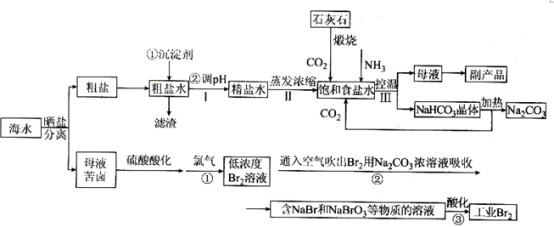
【推荐2】当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一,下面是利用海水等资源来制备Br2、Na2CO3的生产工艺流程图。
请回答:
(1)在处理粗盐水(含有少量Ca2+, Mg2+杂质)的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有__________ ;
(2)向饱和食盐水中首先通入的气体是__________ ;过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是__________ ;
(3)向母液中通氨气后再加入细小食盐颗粒.冷却析出的副产品是__________ ,加入细小食盐颗粒的作用是__________ ;
(4)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是__________ ;
(5)在制备Br2流程中:
①通入空气吹出Br2,并用Na2CO3浓溶液吸收的目的是__________ ;
②为了除去工业Br2中微量的Cl2,可向工业Br2中__________ ;(填字母序号)。
a.通入HBr b.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液

请回答:
(1)在处理粗盐水(含有少量Ca2+, Mg2+杂质)的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有
(2)向饱和食盐水中首先通入的气体是
(3)向母液中通氨气后再加入细小食盐颗粒.冷却析出的副产品是
(4)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是
(5)在制备Br2流程中:
①通入空气吹出Br2,并用Na2CO3浓溶液吸收的目的是
②为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
您最近一年使用:0次
【推荐3】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__ 。
(2)用盐酸酸浸时发生反应的离子方程式为:__ ,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__ 。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__ 。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__ 。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__ 。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___ 。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__ mol/L。

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:
(2)用盐酸酸浸时发生反应的离子方程式为:
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:
②简述证明草酸氧化钛钡晶体已洗净的操作及现象
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】由B、N、O、Fe等元素组成的新型材料有着广泛用途。
(1)基态Fe2+离子的核外电子有_______ 种空间运动状态。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过反应: 3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________ 。(填标号)
A H3BNH3与(HB=NH)3分子中B原子的杂化类型相同
B CH4、H2O、CO2分子空间构型分别是:正四面体形、角形、直线形
C 第一电离能:N>O>C>B
D 化合物A中存在配位键
②1个(HB=NH)3分子中有_______ 个σ键。
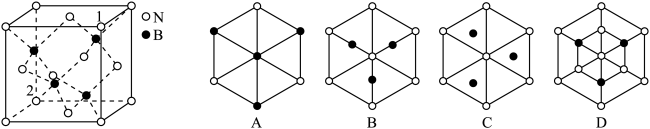
(3)立方氮化硼(BN)是具有广泛应用的新型无机非金属材料,结构和硬度都与金刚石相似。
①立方氮化硼熔点比金刚石低,原因是______________ 。
②立方氮化硼晶胞如下图所示,则立方氮化硼晶胞沿着1→2方向的体对角线垂直在纸平面上的投影图应该是图_____ (从A~D图中选填)。
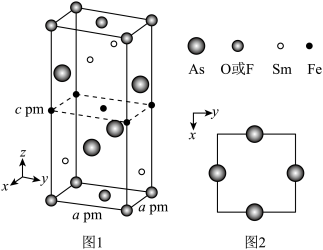
(4)一种O(或F)、Fe、As、Sm形成的四方结构超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____ 。通过测定密度ρ(g/cm3)和晶胞参数,可以计算该物质的x值,完成它们关系的表达式:x=_____ 。
(1)基态Fe2+离子的核外电子有
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过反应: 3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是
A H3BNH3与(HB=NH)3分子中B原子的杂化类型相同
B CH4、H2O、CO2分子空间构型分别是:正四面体形、角形、直线形
C 第一电离能:N>O>C>B
D 化合物A中存在配位键
②1个(HB=NH)3分子中有
(3)立方氮化硼(BN)是具有广泛应用的新型无机非金属材料,结构和硬度都与金刚石相似。
①立方氮化硼熔点比金刚石低,原因是
②立方氮化硼晶胞如下图所示,则立方氮化硼晶胞沿着1→2方向的体对角线垂直在纸平面上的投影图应该是图

(4)一种O(或F)、Fe、As、Sm形成的四方结构超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】含碳物质广泛存在于有机物和无机物中。回答下列问题:
(1)基态C原子的未成对电子数为___________ 。
(2)科学家正致力于研究温室气体CH4和CO2的转化和利用。
①下列有关CH4和CO2的说法正确的是___________ (填标号)。
a.两者都为含有极性共价键的极性分子
b.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
c.CH4与SiH4互为等电子体,故SiO2与CO2互为等电子体
d.电负性大小:O>C>H
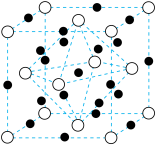
一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

②“可燃冰”中分子间存在的2种作用力是___________ 。
③为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想的依据是:___________ 。
(3)发现C60的三位科学家荣获了1996年的诺贝尔化学奖。
①C60的分子结构如图所示,则1 mol C60分子含有的σ键的数目为___________ 。

②根据理论计算,C60中碳原子的杂化方式既不是sp2,也不是sp3,而是介于两者之间的sp2.28.据此推测,下列球碳(碳原子彼此链接形成类似C60的球形结构)中的碳原子的杂化方式,最接近sp2杂化的是___________ 。
a.C20 b.C80 c.C240 d.C540
③C60分子中成键方式可视为每个原子接2个单键和1个双键,它能与F2发生加成反应,其加成产物为___________ 。
④C60与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。K与C60形成的一种超导材料的晶胞如图所示,图中白球表示C60,黑球表示钾原子。该材料的化学式为___________ 。已知晶胞边长为a=1424 pm,则该超导材料的理论密度ρ的计算式为___________ 。
(1)基态C原子的未成对电子数为
(2)科学家正致力于研究温室气体CH4和CO2的转化和利用。
①下列有关CH4和CO2的说法正确的是
a.两者都为含有极性共价键的极性分子
b.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
c.CH4与SiH4互为等电子体,故SiO2与CO2互为等电子体
d.电负性大小:O>C>H
一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

| 参数分子 | 分子直径/nm | 分子与H2O的结合能 E/(kJ·mol-1) |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
③为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想的依据是:
(3)发现C60的三位科学家荣获了1996年的诺贝尔化学奖。
①C60的分子结构如图所示,则1 mol C60分子含有的σ键的数目为

②根据理论计算,C60中碳原子的杂化方式既不是sp2,也不是sp3,而是介于两者之间的sp2.28.据此推测,下列球碳(碳原子彼此链接形成类似C60的球形结构)中的碳原子的杂化方式,最接近sp2杂化的是
a.C20 b.C80 c.C240 d.C540
③C60分子中成键方式可视为每个原子接2个单键和1个双键,它能与F2发生加成反应,其加成产物为
④C60与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。K与C60形成的一种超导材料的晶胞如图所示,图中白球表示C60,黑球表示钾原子。该材料的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】砷(As)是VA 族元素,砷及其化合物被应用于农药和合金中。回答下列问题:
(1)基态砷原子的电子排布式为___________________ ,第四周期元素中,第一电离能低于砷原子的p区元素有____________ (填元素符号)。
(2)氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是____________ 。
(3)AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是____________ 。
(4)亚砷酸( H3AsO3)分子中,中心原子砷的VSEPR 模型是____________ ,砷原子杂化方式为____________ 。
(5)砷化镍的晶胞如图。晶胞参数a=360.2 pm, c=500.9 pm, γ=120°。
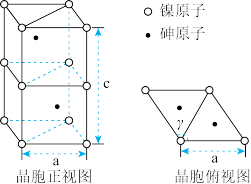
①镍原子配位数为____________ ,配原子构成的几何体是____________ 。
②该晶体密度的计算式为____________ g·cm-3。
(1)基态砷原子的电子排布式为
(2)氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是
(3)AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是
(4)亚砷酸( H3AsO3)分子中,中心原子砷的VSEPR 模型是
(5)砷化镍的晶胞如图。晶胞参数a=360.2 pm, c=500.9 pm, γ=120°。

①镍原子配位数为
②该晶体密度的计算式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】科学家对多种过渡金属元素进行深入的研究,在新能源、新材料研发,医疗等领域应用广泛。回答下列问题:
(1)基态 原子核外电子共有
原子核外电子共有_______ 种空间运动状态;锌在反应中易失去2个电子,则基态 的价电子轨道表示式(电子排布图)为
的价电子轨道表示式(电子排布图)为_______ 。
(2) 的
的 键和
键和 键数目之比为
键数目之比为_______ 。
(3) 有如图两种平行四边形结构:
有如图两种平行四边形结构:
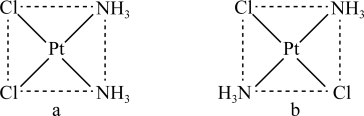
①研究表明,图a分子可用于抗癌药物,在图a中用箭头标出配位键_______ 。
②解释图b分子不溶于水的原因:_______ 。
(4) 是一种使用广泛的荧光材料。已知立方
是一种使用广泛的荧光材料。已知立方 的晶胞结构如图所示:
的晶胞结构如图所示:
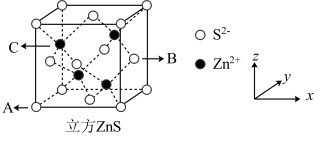
(1)已知 点的原子坐标分别为
点的原子坐标分别为 和
和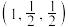 ,则
,则 点的原子坐标为
点的原子坐标为_______ 。
(2)立方 的密度为
的密度为 ,则
,则 的晶胞参数
的晶胞参数
_______  (用含
(用含 的代数式表示,设
的代数式表示,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态
 原子核外电子共有
原子核外电子共有 的价电子轨道表示式(电子排布图)为
的价电子轨道表示式(电子排布图)为(2)
 的
的 键和
键和 键数目之比为
键数目之比为(3)
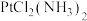 有如图两种平行四边形结构:
有如图两种平行四边形结构: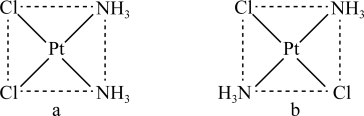
①研究表明,图a分子可用于抗癌药物,在图a中用箭头标出配位键
②解释图b分子不溶于水的原因:
(4)
 是一种使用广泛的荧光材料。已知立方
是一种使用广泛的荧光材料。已知立方 的晶胞结构如图所示:
的晶胞结构如图所示:
(1)已知
 点的原子坐标分别为
点的原子坐标分别为 和
和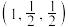 ,则
,则 点的原子坐标为
点的原子坐标为(2)立方
 的密度为
的密度为 ,则
,则 的晶胞参数
的晶胞参数
 (用含
(用含 的代数式表示,设
的代数式表示,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO 的结构密切相关,PO
的结构密切相关,PO 的立体构型为
的立体构型为____________ 。P、O、S的电负性从大到小的顺序为__________ 。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(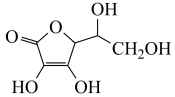 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是_______________ ,抗坏血酸中碳原子的杂化方式为_______ ,1 mol抗坏血酸中手性碳原子的数目为_____ 。
(3)目前最常用的电极材料有锂钴复合氧化物和石墨。
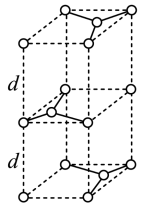
石墨晶胞(如图)层间距为d pm,C—C键长为a pm,石墨晶体的密度为ρ g·cm-3,列式表示阿伏加德罗常数为________ mol-1。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO
 的结构密切相关,PO
的结构密切相关,PO 的立体构型为
的立体构型为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是(3)目前最常用的电极材料有锂钴复合氧化物和石墨。
石墨晶胞(如图)层间距为d pm,C—C键长为a pm,石墨晶体的密度为ρ g·cm-3,列式表示阿伏加德罗常数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】氨酸络合剂指含有—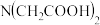 基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。
基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。
Ⅰ、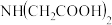 Ⅱ、
Ⅱ、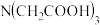 Ⅲ、
Ⅲ、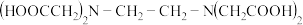
(1)基态氮原子价电子排布式为___________ 。
(2) 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为___________ 。
(3)Ⅰ、Ⅱ、Ⅲ都可以与 形成络合物
形成络合物
①铜元素位于元素周期表第四周期第___________ 族。
②预测___________ (填编号“Ⅰ”、“Ⅱ”、“Ⅲ”)与 形成的络合物最稳定。
形成的络合物最稳定。
(4)下列说法正确的有___________ 。
A.在Ⅰ、Ⅱ、Ⅲ中N原子采取的都是 杂化
杂化
B.在Ⅱ中C元素的电负性最大
C.在Ⅲ中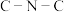 键角是
键角是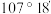
D.在Ⅲ中N元素的第一电离能最大。
E.在Ⅲ中碳氧键的键能均相等
(5)某杂志报道了一种磷化硼纳米颗粒作为高选择性 电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
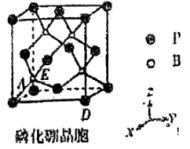
①磷化硼晶体中与硼原子距离最近且相等的硼原子数为___________ 。
②若图中A处磷原子坐标为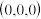 ,D处磷原子坐标为
,D处磷原子坐标为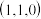 ,则E处的硼原子坐标为
,则E处的硼原子坐标为___________ 。
③已知磷化硼晶胞中A处磷原子与D处磷原子间的距离为a ,则硼原子与最近磷原子的核间距为
,则硼原子与最近磷原子的核间距为___________  。
。
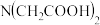 基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。
基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。Ⅰ、
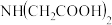 Ⅱ、
Ⅱ、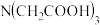 Ⅲ、
Ⅲ、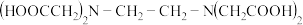
(1)基态氮原子价电子排布式为
(2)
 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为(3)Ⅰ、Ⅱ、Ⅲ都可以与
 形成络合物
形成络合物①铜元素位于元素周期表第四周期第
②预测
 形成的络合物最稳定。
形成的络合物最稳定。(4)下列说法正确的有
A.在Ⅰ、Ⅱ、Ⅲ中N原子采取的都是
 杂化
杂化B.在Ⅱ中C元素的电负性最大
C.在Ⅲ中
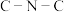 键角是
键角是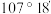
D.在Ⅲ中N元素的第一电离能最大。
E.在Ⅲ中碳氧键的键能均相等
(5)某杂志报道了一种磷化硼纳米颗粒作为高选择性
 电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
①磷化硼晶体中与硼原子距离最近且相等的硼原子数为
②若图中A处磷原子坐标为
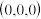 ,D处磷原子坐标为
,D处磷原子坐标为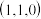 ,则E处的硼原子坐标为
,则E处的硼原子坐标为③已知磷化硼晶胞中A处磷原子与D处磷原子间的距离为a
 ,则硼原子与最近磷原子的核间距为
,则硼原子与最近磷原子的核间距为 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)
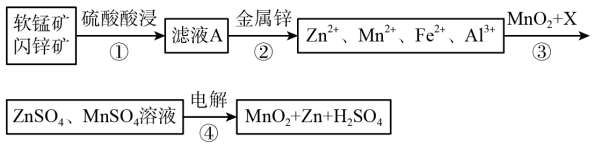
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______ 。
(2)步骤③中MnO2的其作用是______ ,另外一种物质X可以是______ 。
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式______ 。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______ .
(4)已知:H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10-4 mol·L-1时,Mn2+开始沉淀,则a=______ 。[已知:Ksp(MnS)=1.4×10-15]

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式
(2)步骤③中MnO2的其作用是
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
(4)已知:H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10-4 mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
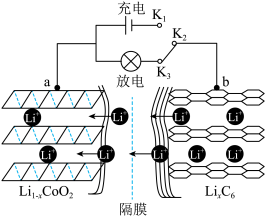
① 放电时,电子的流动方向为______ 。(用a、b、K2、K3)
② 放电时,正极的电极反应式为______ 。
(2)钴酸锂回收再生流程如下:
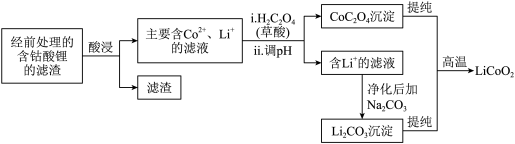
① 用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______ 。
② 用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸。主要原因是:
ⅰ.会产生有毒、有污染的气体。写出相应反应的化学方程式_______ 。
ⅱ.Cl-对建筑材料的腐蚀及带来的水体问题等。
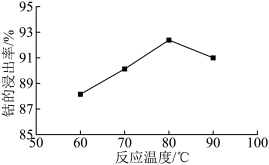
③ 其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2混合液中的浸出率曲线如图,请解释随着温度升高,钴的浸出率先升高后降低的原因:______ 。
④ 已知草酸为二元弱酸,应用化学平衡移动原理,结合化学用语解释CoC2O4沉淀的同时溶液酸性增强的原因:______ 。
⑤ 高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______ 。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:

① 放电时,电子的流动方向为
② 放电时,正极的电极反应式为
(2)钴酸锂回收再生流程如下:

① 用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是
② 用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸。主要原因是:
ⅰ.会产生有毒、有污染的气体。写出相应反应的化学方程式
ⅱ.Cl-对建筑材料的腐蚀及带来的水体问题等。
③ 其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2混合液中的浸出率曲线如图,请解释随着温度升高,钴的浸出率先升高后降低的原因:

④ 已知草酸为二元弱酸,应用化学平衡移动原理,结合化学用语解释CoC2O4沉淀的同时溶液酸性增强的原因:
⑤ 高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】用铬渣[含有Na2SO4及少量Na2Cr2O7、Fe2(SO4)3]为原料提取硫酸钠的工艺流程如图1所示:
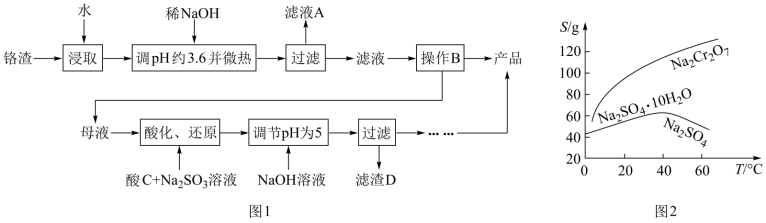
已知:常温下Fe3+、Cr3+完全沉淀时pH分别为3.6和5。
回答下列问题:
(1)为了提高铬渣的浸取率,还可以进行的操作是___ (写出一条即可)
(2)滤渣A的主要成分是___ (填化学式),工艺流程中调节pH约为3.6并微热操作中“微热”的目的是___ 。
(3)根据图2所示溶解度—温度曲线信息,通过操作B制备无水Na2SO4的实验方案是:___ ,用少量乙醇洗涤,干燥,密封保存。
(4)酸化、还原时,酸C应选___ (盐酸、稀硫酸、硝酸),选择理由是___ 。
(5)母液酸化后与Na2SO3发生反应的离子方程式为___ 。
(6)已知Cr(OH)3在溶液中存在平衡:H++CrO +H2O
+H2O Cr(OH)3(s)
Cr(OH)3(s) Cr3++3OH-加入NaOH溶液时要控制pH为5,pH不能过高的理由是
Cr3++3OH-加入NaOH溶液时要控制pH为5,pH不能过高的理由是___ 。

已知:常温下Fe3+、Cr3+完全沉淀时pH分别为3.6和5。
回答下列问题:
(1)为了提高铬渣的浸取率,还可以进行的操作是
(2)滤渣A的主要成分是
(3)根据图2所示溶解度—温度曲线信息,通过操作B制备无水Na2SO4的实验方案是:
(4)酸化、还原时,酸C应选
(5)母液酸化后与Na2SO3发生反应的离子方程式为
(6)已知Cr(OH)3在溶液中存在平衡:H++CrO
 +H2O
+H2O Cr(OH)3(s)
Cr(OH)3(s) Cr3++3OH-加入NaOH溶液时要控制pH为5,pH不能过高的理由是
Cr3++3OH-加入NaOH溶液时要控制pH为5,pH不能过高的理由是
您最近一年使用:0次



