C、CO是常见的还原剂,碳与氧气的反应涉及以下三个:
Ⅰ:
Ⅱ: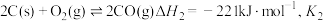
Ⅲ: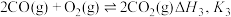
请回答:
(1)
___________  ,
,
___________ (用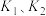 表示)。
表示)。
(2)①碳与氧气反应的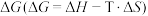 与T的关系如下图,反应Ⅱ对应的曲线是
与T的关系如下图,反应Ⅱ对应的曲线是___________ 。
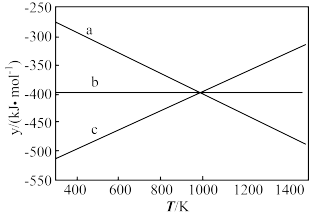
A.a B.b C.c D.无法确定
②下列说法不正确 的是___________ 。
A.熵增有利于反应的进厅,工业生产中可将BaCO3与碳混合煅烧以制取BaO
B.反应的自发性由 共同决定
共同决定
C.随着反应温度的升高,碳被氧化为CO的倾向明显的增强
D.冶金生产中,都可以用碳作还原剂
(3)水煤气反应: ,工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
,工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是___________ 。
(4)在 作催化剂的条件下合成甲醇:
作催化剂的条件下合成甲醇: ,向恒容密闭容器中通入
,向恒容密闭容器中通入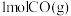 和
和 ,反应过程中转化率
,反应过程中转化率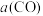 与时间
与时间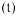 、温度的关系如下图所示。
、温度的关系如下图所示。
①若初始压强为 下该反应平衡常数
下该反应平衡常数
___________ ( 为以分压表示的平衡常数)
为以分压表示的平衡常数)
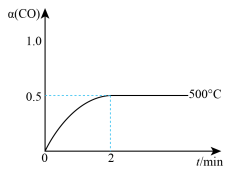
②在500℃恒压条件下,请画出反应体系中a(CO)与时间(t)变化趋势图。______
Ⅰ:

Ⅱ:
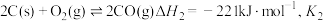
Ⅲ:
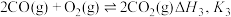
请回答:
(1)

 ,
,
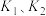 表示)。
表示)。(2)①碳与氧气反应的
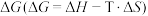 与T的关系如下图,反应Ⅱ对应的曲线是
与T的关系如下图,反应Ⅱ对应的曲线是
A.a B.b C.c D.无法确定
②下列说法
A.熵增有利于反应的进厅,工业生产中可将BaCO3与碳混合煅烧以制取BaO
B.反应的自发性由
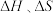 共同决定
共同决定C.随着反应温度的升高,碳被氧化为CO的倾向明显的增强
D.冶金生产中,都可以用碳作还原剂
(3)水煤气反应:
 ,工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
,工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是(4)在
 作催化剂的条件下合成甲醇:
作催化剂的条件下合成甲醇: ,向恒容密闭容器中通入
,向恒容密闭容器中通入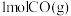 和
和 ,反应过程中转化率
,反应过程中转化率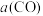 与时间
与时间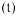 、温度的关系如下图所示。
、温度的关系如下图所示。①若初始压强为
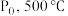 下该反应平衡常数
下该反应平衡常数
 为以分压表示的平衡常数)
为以分压表示的平衡常数)②在500℃恒压条件下,请画出反应体系中a(CO)与时间(t)变化趋势图。

更新时间:2023-06-24 18:30:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】已知:
反应Ⅰ: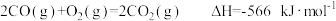 ;
;
反应Ⅱ: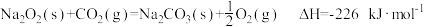 。
。
回答下列问题:
(1)能否通过反应Ⅰ判断等物质的量的CO、 具有能量的高低?
具有能量的高低?___________ (填“能”或“不能”)。
(2)CO的燃烧热
___________  。
。
(3)下列各图中表示反应Ⅱ能量变化的是___________(填字母)。
(4) 与
与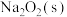 反应生成
反应生成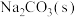 ,该反应的热化学方程式为
,该反应的热化学方程式为___________ 。
(5)依据反应Ⅱ,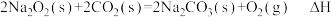
___________ (填“>”“<”或“=”)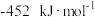 。
。
反应Ⅰ:
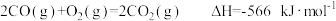 ;
;反应Ⅱ:
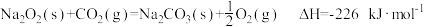 。
。回答下列问题:
(1)能否通过反应Ⅰ判断等物质的量的CO、
 具有能量的高低?
具有能量的高低?(2)CO的燃烧热

 。
。(3)下列各图中表示反应Ⅱ能量变化的是___________(填字母)。
A.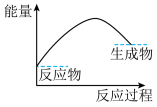 | B.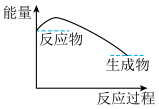 |
C.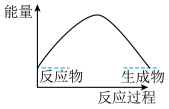 | D.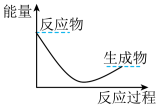 |
 与
与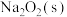 反应生成
反应生成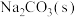 ,该反应的热化学方程式为
,该反应的热化学方程式为(5)依据反应Ⅱ,
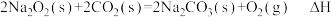
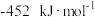 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】十九大报告提出“要像对待生命一样对待生态环境”,对硫、氮、碳元素形成的有毒有害气体进行处理成为科学研究热点。请回答下列问题:
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为___________ 。
(2)利用现代传感技术探究压强对2NO2 (g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。

①B、E两点对应的正反应速率大小为vB_____ vE(填“>” 或“<”)。
②E、F、H三点对应气体的平均相对分子质量最大的点为_____ (填字母序号)。
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为_________ 。

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g) HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:
(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
①已知:vp(B)= 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为__________ kPa∙min-1。
②T1℃时,反应的平衡常数Kp=______ kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数;结果保留三位有效数字)。
Ⅰ.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-12NO(g)+O2(g)=2NO2(g) ΔH2=-113.0 kJ·mol-1
则NO2氧化SO2的热化学方程式为
(2)利用现代传感技术探究压强对2NO2 (g)
 N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如下图所示。
①B、E两点对应的正反应速率大小为vB
②E、F、H三点对应气体的平均相对分子质量最大的点为
(3)可用下图装置将雾霾中的NO、SO2转化为(NH4)2SO4,则阴极的电极反应式为

Ⅱ.利用CO2制取甲醛可以缓解温室效应,反应方程式为CO2(g)+2H2(g)
 HCHO(g)+H2O(g)。请回答下列问题:
HCHO(g)+H2O(g)。请回答下列问题:(4)T1℃时,将体积比为1: 2的CO2和H2混合气体充入恒容密闭容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)=
 。前10 min,用H2的压强变化表示该反应的平均反应速率为
。前10 min,用H2的压强变化表示该反应的平均反应速率为②T1℃时,反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6(g) C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1
C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1
②H2(g)+ O2(g)
O2(g) H2O(l) ΔH2=-285.8kJ·mol-1
H2O(l) ΔH2=-285.8kJ·mol-1
③C2H4(g)+3O2(g) 2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1
2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1
则表示C2H6(g)燃烧热的热化学方程式为____ 。
(2)1000℃时,在某刚性容器内充入一定量的C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%。
①乙烷分解前容器压强为____ Pa,1000℃时,反应①的平衡常数Kp=____ Pa[气体分压(Pa)=气体总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____ 40%(填“>”“<”或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:
C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,
C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,
①反应C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g) ΔH=-149kJ·mol-1的正活化能和逆活化能中较大的是
C2H4(g)+H2O(g) ΔH=-149kJ·mol-1的正活化能和逆活化能中较大的是____ 。
②800℃时,控制原料气的总物质的量一定,当C2H6和O2的物质的量之比为____ 时,乙烯的平衡产率最大,而当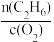 较小时,乙烯的平衡产率较低,可能的原因为
较小时,乙烯的平衡产率较低,可能的原因为____ 。
(1)已知:①C2H6(g)
 C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1
C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1②H2(g)+
 O2(g)
O2(g) H2O(l) ΔH2=-285.8kJ·mol-1
H2O(l) ΔH2=-285.8kJ·mol-1③C2H4(g)+3O2(g)
 2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1
2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1则表示C2H6(g)燃烧热的热化学方程式为
(2)1000℃时,在某刚性容器内充入一定量的C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%。
①乙烷分解前容器压强为
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:
C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,
C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,①反应C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g) ΔH=-149kJ·mol-1的正活化能和逆活化能中较大的是
C2H4(g)+H2O(g) ΔH=-149kJ·mol-1的正活化能和逆活化能中较大的是②800℃时,控制原料气的总物质的量一定,当C2H6和O2的物质的量之比为
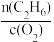 较小时,乙烯的平衡产率较低,可能的原因为
较小时,乙烯的平衡产率较低,可能的原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.一定条件下,在容积为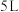 的密闭容器中,
的密闭容器中, 、B、C三种气体的物质的量
、B、C三种气体的物质的量 随时间
随时间 的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。____________ 。
(2)该反应的反应速率 随时间
随时间 的关系如图乙所示。
的关系如图乙所示。 时刻改变的外界条件是
时刻改变的外界条件是_____________ 。
② 、
、 、
、 对应的平衡状态中,C的体积分数最大的是状态
对应的平衡状态中,C的体积分数最大的是状态________ 。
③各阶段的平衡常数如下表所示:
 、
、 、
、 之间的大小关系为
之间的大小关系为__________ (用“ ”“
”“ ”或“
”或“ ”连接)。
”连接)。
Ⅱ.在密闭容器中充入一定量的 ,发生反应:
,发生反应:
 ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和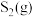 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
________ (填“ ”“
”“ ”或“
”或“ ”)0。
”)0。
(2)图丙中压强( 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为________ 。
(3)图丙中 点对应的平衡常数
点对应的平衡常数
________  (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)如果想进一步提高 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有__________ 。
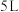 的密闭容器中,
的密闭容器中, 、B、C三种气体的物质的量
、B、C三种气体的物质的量 随时间
随时间 的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
(2)该反应的反应速率
 随时间
随时间 的关系如图乙所示。
的关系如图乙所示。
 时刻改变的外界条件是
时刻改变的外界条件是②
 、
、 、
、 对应的平衡状态中,C的体积分数最大的是状态
对应的平衡状态中,C的体积分数最大的是状态③各阶段的平衡常数如下表所示:
 | 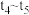 | 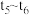 |
 |  |  |
 、
、 、
、 之间的大小关系为
之间的大小关系为 ”“
”“ ”或“
”或“ ”连接)。
”连接)。Ⅱ.在密闭容器中充入一定量的
 ,发生反应:
,发生反应:
 ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和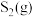 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。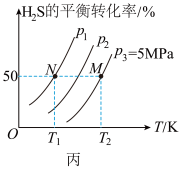

 ”“
”“ ”或“
”或“ ”)0。
”)0。(2)图丙中压强(
 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为(3)图丙中
 点对应的平衡常数
点对应的平衡常数
 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。(4)如果想进一步提高
 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业。利用工厂废气中的H2S和CO反应可以合成COS,回答下列问题:
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g) H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
④CO(g)+H2S(g) COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3
则ΔH3=_______ kJ•mol-1。
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是_______ (填“甲”或“乙”)。
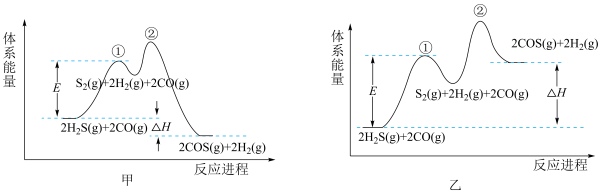
关于该反应的下列叙述正确的是_______ (填标号)。
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g) COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为______ ,COS的体积分数为______ 。在240℃下,要同时提高CO和H2S的转化率,可采取的措施是______ 。
(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是______ ,判断的理由是_______ 。
(1)已知:①CO的燃烧热为283kJ•mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ•mol-1
③COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH2=-18kJ•mol-1
H2S(g)+CO2(g) ΔH2=-18kJ•mol-1④CO(g)+H2S(g)
 COS(g)+H2(g) ΔH3
COS(g)+H2(g) ΔH3则ΔH3=
(2)以FeOOH作催化剂,由H2S和CO合成COS的反应分两步进行。下列示意图能正确体现上述反应能量变化的是

关于该反应的下列叙述正确的是
A.步骤①是慢反应,活化能较大 B.总反应的速率由步骤②决定
C.反应进程中S2属于中间产物 D.更换催化剂可改变E和ΔH
(3)在240℃,将等物质的量H2S和CO充入恒压(100kPa)的密闭容器中发生反应:CO(g)+H2S(g)
 COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆=
COS(g)+H2(g)。已知正反应速率v正=k正×p(CO)×p(H2S),v逆=k逆×p(COS)×p(H2),其中p为分压,该温度下k正=5.0×10-4kPa-1•s-1,反应达平衡时v逆= kPa-1•s-1测得,则H2S的转化率为
kPa-1•s-1测得,则H2S的转化率为(4)在两个密闭容器中都加入CO、H2S、COS、H2四种气体,起始时气体体积分数φ(CO)=φ(H2S),φ(COS)=p(H2),分别在300℃和320℃时反应,容器中H2S(g)和COS(g)的体积分数(φ)随时间(t)的变化关系如图所示。

320℃时,φ(COS)随时间变化关系的曲线是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
(1)AlN的制备—碳还原法:以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:i.2Al2O3(s) 4Al(g)+3O2(g)
4Al(g)+3O2(g) =+3351kJ·mol-1
=+3351kJ·mol-1
ii.2C(石墨,s)+O2(g)=2CO(g) =-221kJ·mol-1
=-221kJ·mol-1
iii.铝蒸气和氮气反应生成氮化铝,生成41gAlN放出159kJ热量。写出该反应的热化学方程式___________ 。运用平衡移动原理分析反应ii对反应i的可能影响:___________ 。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。解释t1-t2时间内两条曲线差异的可能原因:___________ 。

(3)AlN含量检测。向agAlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余的H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则样品中AlN的质量分数是___________ 。
(1)AlN的制备—碳还原法:以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:i.2Al2O3(s)
 4Al(g)+3O2(g)
4Al(g)+3O2(g) =+3351kJ·mol-1
=+3351kJ·mol-1ii.2C(石墨,s)+O2(g)=2CO(g)
 =-221kJ·mol-1
=-221kJ·mol-1iii.铝蒸气和氮气反应生成氮化铝,生成41gAlN放出159kJ热量。写出该反应的热化学方程式
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。解释t1-t2时间内两条曲线差异的可能原因:

(3)AlN含量检测。向agAlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余的H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则样品中AlN的质量分数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在恒压、将一定量的NO和O2混合,一定的条件下,反应相同时间,测得不同温度下NO转化为NO2的转化率如图所示。回答下列问题:
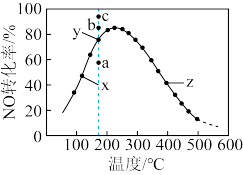
(1)由图可知,反应2NO(g)+O2(g) 2NO2(g)的ΔH
2NO2(g)的ΔH___ 0(填>,<,=)。
(2)图中___ 点(填x,y,z)在该温度下达到了平衡状态。
(3)图中y点所示条件下,增加O2的浓度___ 提高NO转化率(填能或不能)。
(4)380℃下,c起始(O2)=c起始(NO)=5.0×10-4mol·L-1,NO平衡转化率为50%,则平衡常数K___ 2000(填>,<,=)。
(5)图中x点,其v正___ v逆的(填>,<,=)。
(6)y点所对应的温度下,NO的平衡转化率对应的点是___ (填a,b,c)。

(1)由图可知,反应2NO(g)+O2(g)
 2NO2(g)的ΔH
2NO2(g)的ΔH(2)图中
(3)图中y点所示条件下,增加O2的浓度
(4)380℃下,c起始(O2)=c起始(NO)=5.0×10-4mol·L-1,NO平衡转化率为50%,则平衡常数K
(5)图中x点,其v正
(6)y点所对应的温度下,NO的平衡转化率对应的点是
您最近一年使用:0次
【推荐2】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知: N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol
若某反应的平衡常数表达式为: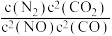 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_______ 。
(2)利用H2和CO2在一定条件下可以合成乙烯(CH2=CH2):6H2(g)+2CO2(g)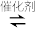 CH2=CH2(g)+4H2O(g),已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是
CH2=CH2(g)+4H2O(g),已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______ (填序号)。
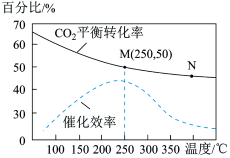
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(3)在密闭容器中充入5 mol CO和4 mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度: T1_____ T2 (填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2 L,则此时的平衡常数K=_______ (保留两位有效数字);用CO的浓度变化表示的平均反应速率v(CO)=________ 。
(1)已知: N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol
若某反应的平衡常数表达式为:
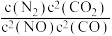 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)利用H2和CO2在一定条件下可以合成乙烯(CH2=CH2):6H2(g)+2CO2(g)
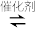 CH2=CH2(g)+4H2O(g),已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是
CH2=CH2(g)+4H2O(g),已知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(3)在密闭容器中充入5 mol CO和4 mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度: T1
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2 L,则此时的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氯气是一种重要的化工原料,主要用于生产塑料、合成纤维、染料、农药、消毒剂、漂白剂以及各种氯化物。氯气的制法(地康法)—1868年,狄肯和洪特发明了用氯化铜作催化剂,在加热条件下,用空气中的氧气来氧化氯化氢气体制取氯气的方法,其反应的化学方程式为: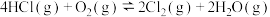 。下图为在体积不变的密闭容器中,进料浓度比
。下图为在体积不变的密闭容器中,进料浓度比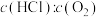 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
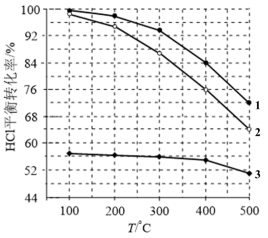
(1)由图可知反应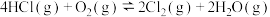 的
的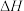
_______ 0(填“>”或“<”),曲线_______ (填“1”“2”或“3”)表示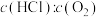 为7:1。
为7:1。
(2)400℃时,按进料浓度比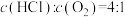 投料,设HCl的初始浓度为
投料,设HCl的初始浓度为 ,反应经5min达到平衡,在0~5min时段,反应速率
,反应经5min达到平衡,在0~5min时段,反应速率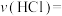
_______  (用含
(用含 的表达式表示),该条件下的平衡常数
的表达式表示),该条件下的平衡常数
_______ (只列出计算式,不计算结果)。进料浓度比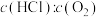 过高的不利影响是
过高的不利影响是_______ 。
(3)地康法的反应原理如下,已知:
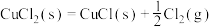
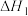



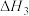
则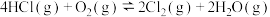 的
的
_______ 。
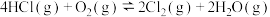 。下图为在体积不变的密闭容器中,进料浓度比
。下图为在体积不变的密闭容器中,进料浓度比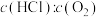 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
(1)由图可知反应
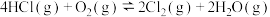 的
的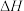
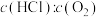 为7:1。
为7:1。(2)400℃时,按进料浓度比
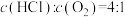 投料,设HCl的初始浓度为
投料,设HCl的初始浓度为 ,反应经5min达到平衡,在0~5min时段,反应速率
,反应经5min达到平衡,在0~5min时段,反应速率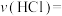
 (用含
(用含 的表达式表示),该条件下的平衡常数
的表达式表示),该条件下的平衡常数
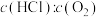 过高的不利影响是
过高的不利影响是(3)地康法的反应原理如下,已知:
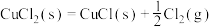
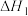



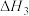
则
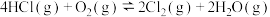 的
的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ,则该反应的热化学方程式为____________________ 。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:NiOOH + H2 2 Ni(OH)2。
2 Ni(OH)2。
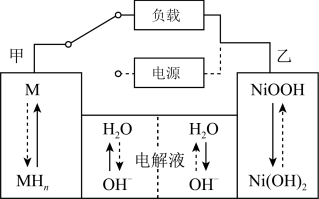
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将_______ (填“增大”、“不变”或“减小”),该电极的电极反应式为_________________ 。
(3)有人建议汽车尾气中的CO,可用加入催化剂催化热分解的方法消除。已知热分解反应CO(g)=C(s)+O2(g)的△H=+110.5kJ/mol,△S=-0.089kJ·mol-1·K-1,这一方案理论上是否可行________ (选填:“可行”或“不可行”),理由是______________ 。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ,则该反应的热化学方程式为
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:NiOOH + H2
 2 Ni(OH)2。
2 Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(3)有人建议汽车尾气中的CO,可用加入催化剂催化热分解的方法消除。已知热分解反应CO(g)=C(s)+O2(g)的△H=+110.5kJ/mol,△S=-0.089kJ·mol-1·K-1,这一方案理论上是否可行
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】丙烯是重要的石油化工中间体,工业上常用丙烷催化脱氢和甲醇催化分解等方法制备。回答下列问题:
I.丙烷催化脱氢法制丙烯:C3H8(g) C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
(1)该反应在___________ (填“高温”、“低温”或“任意温度”)时可自发进行。
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp=________ kPa。(结果保留3位有效数字,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压-总压×物质的量分数)
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g) C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为___________ 。
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
(5)该反应的实验数据遵循 Arhenius 经验公式: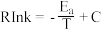 (Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
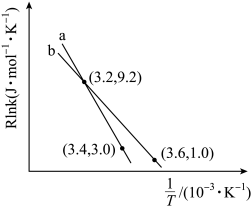
(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得___________ 。(填“越多”或“越少”)。根据如图曲线a计算该反应的活化能E,为___________ kJ·mol-1。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是___________ 。
I.丙烷催化脱氢法制丙烯:C3H8(g)
 C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。
C3H6(g)+H2(g) ΔH1=+123.8kJ/mol。(1)该反应在
(2)570℃、100kPa,用n(C3H8):n(H2O)=1:9的混合气进行直接脱氢反应,3h后达到平衡,(C3H8的平衡转化率为 80%,脱氢反应的)Kp=
Ⅱ. 二氧化碳耦合丙烷脱氢制丙烯:
CO2(g)+H2(g)=H2O(g)+CO(g) ΔH2
CO2(g)+C3H8(g)
 C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol
C3H6(g)+H2O(g)+CO(g) ΔH3=+165kJ/mol(3)相同温度下的恒压密闭容器中,在丙烷催化脱氢法的基础上充入CO2,即为二氧化碳耦合丙烷脱氢法,该方法的优点为
(4)下列能说明该体系在恒温恒压密闭容器中反应达到平衡状态的是___________(填序号)。
| A.CO2的物质的量分数保持不变 |
| B.n(H2O):n(CO)保持不变 |
| C.气体密度保持不变 |
| D.速率关系:v(C3H8)=c(C3H6) |
Ⅲ. 甲醇催化分解:3CH3OH(g)=C3H6(g)+3H2O(g)
(5)该反应的实验数据遵循 Arhenius 经验公式:
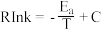 (Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
(Ea为活化能,假设其受温度影响忽略不计,k为速率常数,R和C为常数),此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】乙酸水蒸气重整制氢气是一项极具前景的制氢工艺,该过程中发生下列反应:
反应Ⅰ:
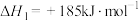
反应Ⅱ:

回答下列问题:
(1)反应Ⅰ在___________ 条件下能自发进行。
(2)已知:水碳比(S/C)是指转化进料中水蒸气分子总数与碳原子总数的比值,水碳比(S/C)分别为2和4时,反应温度对H2(g)平衡产率的影响如图1所示:___________ (填“a”或“b”);
②水碳比(S/C)=2时,H2(g)平衡产率随温度升高先增大后逐渐减小,H2(g)平衡产率逐渐减小的原因可能是___________ 。
(3)已知:S表示选择性,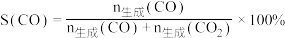 。在
。在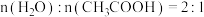 时,1 MPa下,平衡时S(CO)和S(CO2)随温度的变化;350℃下,平衡时S(CO)和S(CO2)随压强的变化均如图2所示。平衡常数随温度变化如图3所示
时,1 MPa下,平衡时S(CO)和S(CO2)随温度的变化;350℃下,平衡时S(CO)和S(CO2)随压强的变化均如图2所示。平衡常数随温度变化如图3所示___________ (填字母)。
②图中B、C、D、M、N、P、Q7个点中与A点处于相同化学平衡状态的点有___________ 个。
③在一定温度和压强下,向容积可变的密闭容器中通入2 mol H2O和1 mol CH3COOH,同时发生反应Ⅰ和反应Ⅱ达到平衡点C,测得平衡时体系中气体物质的量增加40%,则反应Ⅱ的
___________ (保留2位有效数字)。
反应Ⅰ:

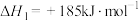
反应Ⅱ:


回答下列问题:
(1)反应Ⅰ在
(2)已知:水碳比(S/C)是指转化进料中水蒸气分子总数与碳原子总数的比值,水碳比(S/C)分别为2和4时,反应温度对H2(g)平衡产率的影响如图1所示:

②水碳比(S/C)=2时,H2(g)平衡产率随温度升高先增大后逐渐减小,H2(g)平衡产率逐渐减小的原因可能是
(3)已知:S表示选择性,
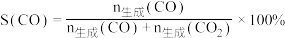 。在
。在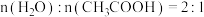 时,1 MPa下,平衡时S(CO)和S(CO2)随温度的变化;350℃下,平衡时S(CO)和S(CO2)随压强的变化均如图2所示。平衡常数随温度变化如图3所示
时,1 MPa下,平衡时S(CO)和S(CO2)随温度的变化;350℃下,平衡时S(CO)和S(CO2)随压强的变化均如图2所示。平衡常数随温度变化如图3所示
②图中B、C、D、M、N、P、Q7个点中与A点处于相同化学平衡状态的点有
③在一定温度和压强下,向容积可变的密闭容器中通入2 mol H2O和1 mol CH3COOH,同时发生反应Ⅰ和反应Ⅱ达到平衡点C,测得平衡时体系中气体物质的量增加40%,则反应Ⅱ的

您最近一年使用:0次



