齐家坪遗址是一处新石器时代晚期文化遗址,出土的铜镜是迄今为止我国发现最早的铜镜。铜及其化合物在工农业生产中有广泛的应用。
I.金属铜的晶胞结构模型如图1所示。 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为___________ 。
(2)设晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞密度为
,则该晶胞密度为___________ 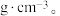
II. 能与
能与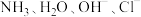 等形成配位数为4的配合物。
等形成配位数为4的配合物。
将 投入
投入 的混合溶液中进行“氨浸”,控制温度为
的混合溶液中进行“氨浸”,控制温度为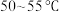 ,
, 约为9.5,
约为9.5, 转化为
转化为 溶液。
溶液。
(3) 中基态铜离子核外电子排布式为
中基态铜离子核外电子排布式为___________ 。
(4) 结构中,若用两个
结构中,若用两个 代替两个
代替两个 ,可以得到两种不同结构的化合物,由此推测
,可以得到两种不同结构的化合物,由此推测 的空间结构为
的空间结构为___________ 。
(5) 可以与乙二胺
可以与乙二胺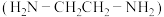 形成配离子,如图2所示:
形成配离子,如图2所示: 原子成键时采取的杂化方式是
原子成键时采取的杂化方式是___________ 杂化。
②乙二胺和三甲胺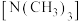 均属于胺,但乙二胺比三甲胺的溶解度大很多,原因是
均属于胺,但乙二胺比三甲胺的溶解度大很多,原因是___________ 。
III.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。
(6)下列物质中,属于顺磁性物质的是___________ (填字母)。
A.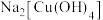 B.
B. C.
C.
I.金属铜的晶胞结构模型如图1所示。
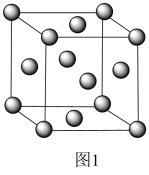
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为(2)设晶胞参数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞密度为
,则该晶胞密度为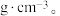
II.
 能与
能与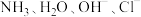 等形成配位数为4的配合物。
等形成配位数为4的配合物。将
 投入
投入 的混合溶液中进行“氨浸”,控制温度为
的混合溶液中进行“氨浸”,控制温度为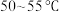 ,
, 约为9.5,
约为9.5, 转化为
转化为 溶液。
溶液。(3)
 中基态铜离子核外电子排布式为
中基态铜离子核外电子排布式为(4)
 结构中,若用两个
结构中,若用两个 代替两个
代替两个 ,可以得到两种不同结构的化合物,由此推测
,可以得到两种不同结构的化合物,由此推测 的空间结构为
的空间结构为(5)
 可以与乙二胺
可以与乙二胺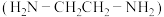 形成配离子,如图2所示:
形成配离子,如图2所示: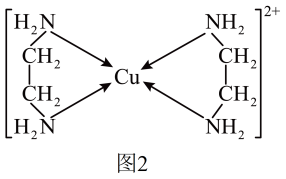
 原子成键时采取的杂化方式是
原子成键时采取的杂化方式是②乙二胺和三甲胺
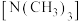 均属于胺,但乙二胺比三甲胺的溶解度大很多,原因是
均属于胺,但乙二胺比三甲胺的溶解度大很多,原因是III.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。
(6)下列物质中,属于顺磁性物质的是
A.
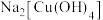 B.
B. C.
C.
更新时间:2023-07-15 15:29:05
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】以物质的量之比3:1的Fe和Al共熔后结晶得Fe3Al晶体,晶胞结构如图一所示,该晶胞为立方晶胞,晶胞参数为a pm。血红素(如图二)是血红蛋白的活性部位,其中心元素是Fe( II)。二者是常见的含铁物质,请回答下列问题。
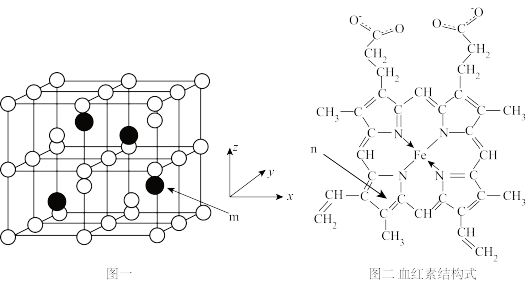
(1)Fe2+的价电子排布式为:_______ 。
(2)血红素分子中非金属元素电负性由大到小的顺序是_______ (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是_______ (用化学式表示);C、N、O三种元素形成一种阴离子CNO-,其结构中有_______ 个σ键,_______ 个π键。
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为_______ ;该环_______ (填“有”、“无”)芳香性。
(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为_______ (以含π的代数式表示)。
(5)m原子的原子分数坐标为_______ . ;晶胞内任意两个A1原子之间的距离为_______ pm。
(6)Fe3Al晶体的密度为_______ g·cm-3。

(1)Fe2+的价电子排布式为:
(2)血红素分子中非金属元素电负性由大到小的顺序是
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3
 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为
(5)m原子的原子分数坐标为
(6)Fe3Al晶体的密度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】用低品铜矿(主要含CuS、FeO)制备Cu2O的一种流程如下:
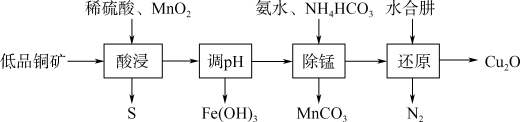
(1)“酸浸”中CuS发生反应的化学方程式为_______ 。
(2)写出基态Mn2+的核外电子排布式_______ 。
(3)“调pH”后溶液pH约4,此时溶液Fe3+物质的量浓度为_______ 。[Ksp[Fe(OH)3]=1×10-38]
(4)“除锰”时的离子方程式为_______ 。
(5)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O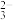 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度_______ 。
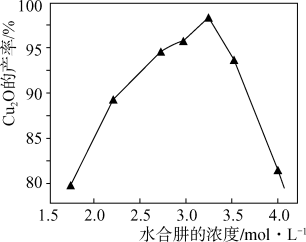
(6)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是_______ 。

(1)“酸浸”中CuS发生反应的化学方程式为
(2)写出基态Mn2+的核外电子排布式
(3)“调pH”后溶液pH约4,此时溶液Fe3+物质的量浓度为
(4)“除锰”时的离子方程式为
(5)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O
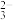 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度(6)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
(1)基态Ti原子的核外电子排布式为___________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
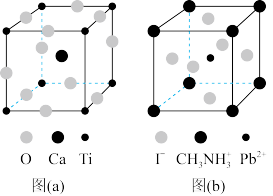
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是___________ ;金属离子与氧离子间的作用力为___________ ,Ca2+的配位数是___________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中___________ 的空间位置相同。有机碱CH3NH 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ 。若晶胞参数为a nm,则晶体密度为___________ g·cm-3(列出计算式)。
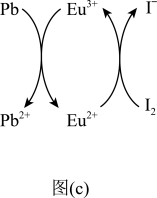
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:___________ ,Eu3+在反应中的功能___________ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH
 ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu2+基态价电子排布式为___________ 。
(2) 的空间构型为
的空间构型为___________ ,与 互为等电子体的分子和离子分别为
互为等电子体的分子和离子分别为___________ 、___________ (各写一种即可)。
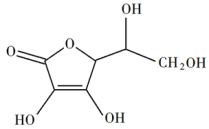
(3)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为___________ 。
(4)一个Cu2O晶胞(如图)中若晶胞的密度为ag/cm3,则该晶胞的边长为___________ nm。

(1)Cu2+基态价电子排布式为
(2)
 的空间构型为
的空间构型为 互为等电子体的分子和离子分别为
互为等电子体的分子和离子分别为(3)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为
(4)一个Cu2O晶胞(如图)中若晶胞的密度为ag/cm3,则该晶胞的边长为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为:[Ar]___________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间提供孤电子对的成键原子是___________ 。
③氨的沸点___________ (“高于”或“低于”)膦(PH3),原因是___________ 。
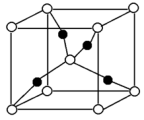
(3)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为___________ 。
②若合金的密度为d g∙cm-3,晶胞参数为a cm,则阿伏加德罗常数为___________ (用a、d表示)。
(1)镍元素基态原子的电子排布式为:[Ar]
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间提供孤电子对的成键原子是
③氨的沸点
(3)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为d g∙cm-3,晶胞参数为a cm,则阿伏加德罗常数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态电子排布式可表示为________ 。
(2)MX3-的空间构型是________ (用文字描述)。H2X分子的VSEPR模型名称为________ 。
(3)含Z(H2X)42+的溶液中通入MH3,会生成Z(MH3)42+的原因___________________________ 。(从电负性角度解释)
(4) 1 mol WX2中含有的π键数目为________ 。
(5) AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
①磷化铝的晶体类型为_____________ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
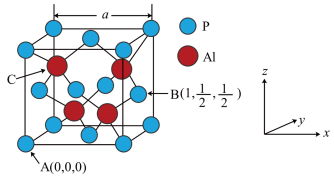
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为____________ g/cm3(列出计算式即可,用NA表示阿伏伽德罗常数的数值)。
(1)Y3+基态电子排布式可表示为
(2)MX3-的空间构型是
(3)含Z(H2X)42+的溶液中通入MH3,会生成Z(MH3)42+的原因
(4) 1 mol WX2中含有的π键数目为
(5) AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为

③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为____ , Y2X2分子中σ键和π键个数比为_______ 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____ 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是_______ 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为______ 。
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于________ (填晶体类型)。
(5)下列有关的说法正确的是________________ 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_____ 。已知该晶胞密度为ρ g/cm3,阿伏加 德罗常数为NA,求晶胞边长a=_____ cm。(用含ρ、NA的计算式表示)
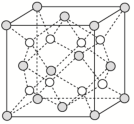
(1)Y2X2分子中Y原子轨道的杂化类型为
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于
(5)下列有关的说法正确的是
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
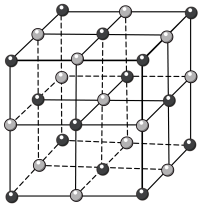
【推荐2】以镁橄榄石2MgO·SiO2(简写为M2Si)为主晶相制作的镁橄榄石砖是一种弱碱性耐火材料。可用于有色金属熔炼炉、炼钢平炉蓄热室和水泥回转窑等的内衬。
(1)基态硅原子的价电子排布式为_____________ 。
(2)与镁和硅都相邻的元素是铝,则3种元素的第一电离能从大到小的顺序为______________ (用元素符号表示)。
(3)高纯硅一般通过SiCl4还原得到,晶体硅中硅原子的杂化方式为________ ,写出与SiCl4互为等电子体的一种阴离子的化学式________ 。
(4)已知氧化镁与氯化钠具有相同的晶胞结构(如图),与镁离子最近的氧离子所构成的几何结构为________ ,与镁离子最近的镁离子有________ 个;已知氧化镁的密度为3.58 g/cm3,则氧化镁的晶胞边长为________ cm(列出表达式即可)。
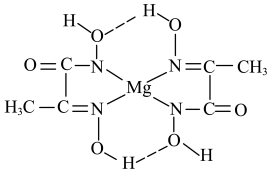
(5)某镁的化合物结构简式如图,其分子不含有________ 。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(1)基态硅原子的价电子排布式为
(2)与镁和硅都相邻的元素是铝,则3种元素的第一电离能从大到小的顺序为
(3)高纯硅一般通过SiCl4还原得到,晶体硅中硅原子的杂化方式为
(4)已知氧化镁与氯化钠具有相同的晶胞结构(如图),与镁离子最近的氧离子所构成的几何结构为

(5)某镁的化合物结构简式如图,其分子不含有

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】(1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____ 。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________ 。
②MgCO3分解温度比CaCO3低的原因是___________ 。
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________ 。
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有 键的数目为
键的数目为________ 。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(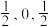 ),C为(
),C为(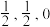 );则D原子的坐标参数为
);则D原子的坐标参数为________ 。____ ,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为 g/cm3,则Mn-Se键的键长为
g/cm3,则Mn-Se键的键长为_____ nm(写表达式即可)。 g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______ (写表达式即可)。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是
②MgCO3分解温度比CaCO3低的原因是
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有
 键的数目为
键的数目为(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(
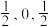 ),C为(
),C为(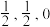 );则D原子的坐标参数为
);则D原子的坐标参数为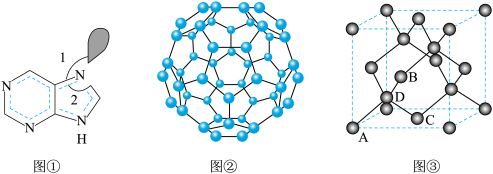
 g/cm3,则Mn-Se键的键长为
g/cm3,则Mn-Se键的键长为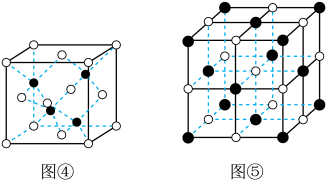
 g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
g/cm3,K和I的摩尔质量分别为Mk g・mol-1和MI g・mol-1,原子半径分别为rk pm和rI pm,阿伏加 德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次



