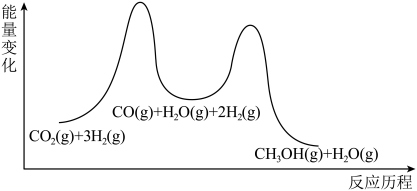
工业上常用天然气作为制备 的原料。已知:
的原料。已知:
①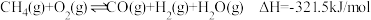
②
③
(1) 与
与 化合生成
化合生成 的热化学方程式是
的热化学方程式是___________ 。
(2)利用③的原理 ,向密闭容器中充入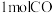 与
与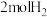 ,在不同压强下合成甲醇。CO的平衡转化率与温度、压强(P)的关系如图所示:
,在不同压强下合成甲醇。CO的平衡转化率与温度、压强(P)的关系如图所示:
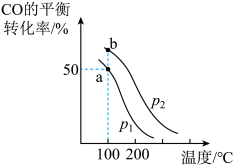
①压强
___________  (填“<”或“>”)
(填“<”或“>”)
②根据图中a点的数据(此时容器体积为 ),可知,a点平衡时
),可知,a点平衡时 的浓度为
的浓度为___________ 。
③若反应刚好至a点时,所需时间为 ,则
,则 内用
内用 表示该反应的平均反应速率
表示该反应的平均反应速率
___________ 。
④维持与a点相同的温度,在恒容密闭容器中加入一定量的 与
与 ,发生反应③。测得某时刻各组分浓度如下表所示。此时反应处于
,发生反应③。测得某时刻各组分浓度如下表所示。此时反应处于___________ (填“正向进行”或“逆向进行”或“己达平衡”)状态。
 的原料。已知:
的原料。已知:①
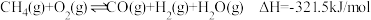
②

③

(1)
 与
与 化合生成
化合生成 的热化学方程式是
的热化学方程式是(2)利用
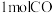 与
与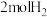 ,在不同压强下合成甲醇。CO的平衡转化率与温度、压强(P)的关系如图所示:
,在不同压强下合成甲醇。CO的平衡转化率与温度、压强(P)的关系如图所示:
①压强

 (填“<”或“>”)
(填“<”或“>”)②根据图中a点的数据(此时容器体积为
 ),可知,a点平衡时
),可知,a点平衡时 的浓度为
的浓度为③若反应刚好至a点时,所需时间为
 ,则
,则 内用
内用 表示该反应的平均反应速率
表示该反应的平均反应速率
④维持与a点相同的温度,在恒容密闭容器中加入一定量的
 与
与 ,发生反应③。测得某时刻各组分浓度如下表所示。此时反应处于
,发生反应③。测得某时刻各组分浓度如下表所示。此时反应处于| 物质 |  |  |  |
浓度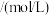 |  | 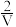 |  |
更新时间:2023-10-16 20:32:33
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】烟气中通常含有高浓度SO2、氮氧化物及粉尘颗粒等有害物质,在排放前必须进行脱硫脱硝处理。
(1) 利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=________ kJ·mol-1。
(2) H2O2在催化剂αFeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图1所示。
①写出·OH氧化NO的化学反应方程式:________ 。
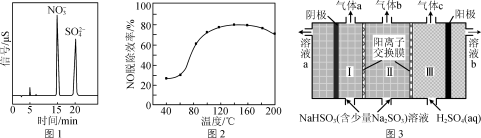
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是______________________________ ,温度高于180 ℃,NO的脱除效率降低的原因是________ 。
(3) 工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2,其工作原理如图3所示。
① SO2气体在________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)室生成。
②用离子方程式表示吸收液再生的原理:________ 。
(4) 新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能将烟气中SO2分解除去,若1 mol ZnFe2Ox与足量SO2生成1 mol ZnFe2O4和0.5 mol S,则x=________ 。
(1) 利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=
(2) H2O2在催化剂αFeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图1所示。

①写出·OH氧化NO的化学反应方程式:
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是
(3) 工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2,其工作原理如图3所示。
① SO2气体在
②用离子方程式表示吸收液再生的原理:
(4) 新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能将烟气中SO2分解除去,若1 mol ZnFe2Ox与足量SO2生成1 mol ZnFe2O4和0.5 mol S,则x=
您最近一年使用:0次
【推荐2】CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善,回答下列问题:
Ⅰ.CO2和CH4都是主要的温室气体。已知25℃时,相关物质的燃烧热数据如下表:
(1)25℃时,CO2(g)和CH4(g)生成水煤气的热化学方程式为___________ 。
(2)在恒温恒容装置中通入等体积CO2和CH4,发生上述反应,起始压强为p,CO2的平衡转化率为α。达平衡时,容器内总压为___________ 。该反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.CO2制甲醇反应为: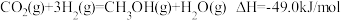 。起始投料为
。起始投料为 不变,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如图所示。其中,
不变,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如图所示。其中,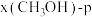 图在t=250℃下测得,
图在t=250℃下测得,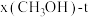 图在
图在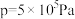 下测得。
下测得。
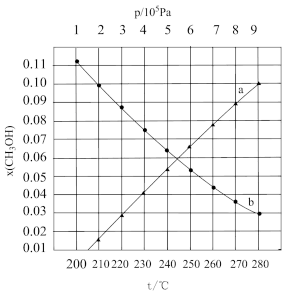
(3)图中等压过程的曲线是___________ (填“a”或“b”),判断的依据是:___________ ;
(4)当 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
Ⅲ.运用电化学原理可以很好利用CO2资源。
(5)火星大气由96%的二氧化碳气体组成,火星探测器采用Li- CO2电池供电,其反应机理如下图:
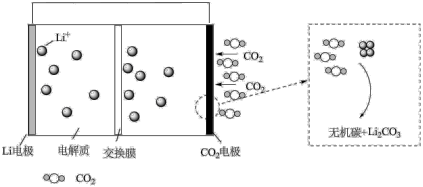
电池中的“交换膜”应为___________ 交换膜(填“阳离子”或“阴离子”)。写出CO2电极反应式:___________ 。
Ⅰ.CO2和CH4都是主要的温室气体。已知25℃时,相关物质的燃烧热数据如下表:
| 物质 | H2(g) | CO(g) | CH4(g) |
| 燃烧热△H(kJ/mol) | -285.8 | -283.0 | -890.3 |
(2)在恒温恒容装置中通入等体积CO2和CH4,发生上述反应,起始压强为p,CO2的平衡转化率为α。达平衡时,容器内总压为
Ⅱ.CO2制甲醇反应为:
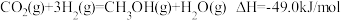 。起始投料为
。起始投料为 不变,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如图所示。其中,
不变,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如图所示。其中,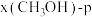 图在t=250℃下测得,
图在t=250℃下测得,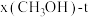 图在
图在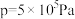 下测得。
下测得。
(3)图中等压过程的曲线是
(4)当
 时,反应条件可能为
时,反应条件可能为Ⅲ.运用电化学原理可以很好利用CO2资源。
(5)火星大气由96%的二氧化碳气体组成,火星探测器采用Li- CO2电池供电,其反应机理如下图:

电池中的“交换膜”应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: ,
,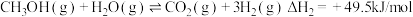 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是________ 。
(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
①p1____ p2(填“<”或“>”)。
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=_______ ,H2的转化率为______ (保留1位小数)。
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是_______ (填字母)。
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
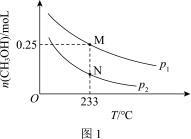
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯: 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
①b、c、d三点中,尚未达到化学平衡状态的点是________ 。
②该反应是_______ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:________ 。
(1)已知一定条件下,发生反应:
 ,
, ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。

①p1
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯:
 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
①b、c、d三点中,尚未达到化学平衡状态的点是
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。
甲醇的合成方法是:(ⅰ)CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.1 kJ· mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ· mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0 kJ· mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(ⅳ)CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH=+41.1 kJ· mol-1
(1)甲醇的燃烧热为______ kJ· mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为_ 。
(3)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是___ 。
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如表:
①x=_______ 。
②前2 min内H2的平均反应速率为v(H2)=__ 。该温度下,反应(ⅰ)的平衡常数K=____ 。
③反应进行到第2 min时,改变了反应条件,改变的这个条件可能是___ (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)图是温度、压强与反应(ⅰ)中CO转化率的关系:
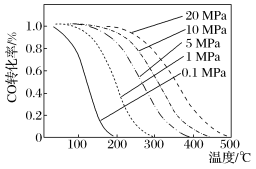
①由图象可知,较低温度时,CO转化率对________ (选填“温度”或“压强”)敏感。
②由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400 ℃和10 MPa的条件,其原因是___________ 。
(6)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol 的H2,在一定条件下发生反应(ⅰ)。该反应的逆反应速率与时间的关系如图所示:
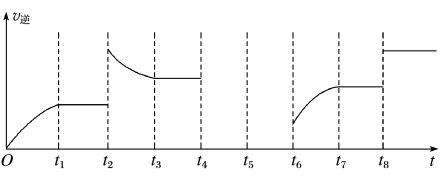
①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是________________ 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在上图中画出t4~t6时逆反应速率与时间的关系曲线________ 。
甲醇的合成方法是:(ⅰ)CO(g)+2H2(g)⇌CH3OH(g) ΔH=-90.1 kJ· mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ· mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0 kJ· mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(ⅳ)CO2(g)+H2(g) ⇌CO(g)+H2O(g) ΔH=+41.1 kJ· mol-1
(1)甲醇的燃烧热为
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为
(3)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如表:
| 浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①x=
②前2 min内H2的平均反应速率为v(H2)=
③反应进行到第2 min时,改变了反应条件,改变的这个条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)图是温度、压强与反应(ⅰ)中CO转化率的关系:

①由图象可知,较低温度时,CO转化率对
②由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400 ℃和10 MPa的条件,其原因是
(6)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol 的H2,在一定条件下发生反应(ⅰ)。该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在上图中画出t4~t6时逆反应速率与时间的关系曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(一)环氧乙烷(EO)是一种重要的化工原料,可用于生产乙二醇、乙醇胺等化工产品,目前乙烯直接氧化法被广泛应用于环氧乙烷的生产并得到广泛关注。制备环氧乙烷工艺装置如图: ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:
主反应①:2CH2=CH2(g)+O2(g)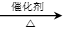 2
2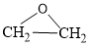 (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:CH2=CH2(g)+3O2(g) 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2 (g)+5O2(g)
(g)+5O2(g)  4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;
副反应④: (g)
(g) CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol
已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=______ kJ/mol;
(2)下列有关环氧乙烷制备说法不正确的是______
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛
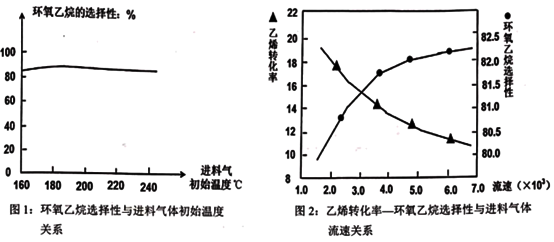
(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:
请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:______ 。
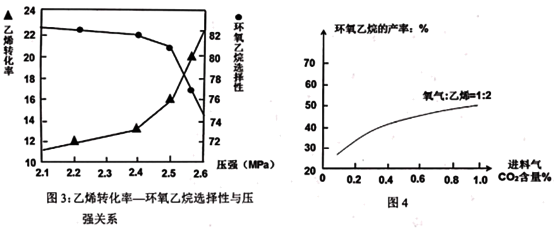
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线_______ 。
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。

(1)写出a电极的电极反应式:__________ ;
(2)写出b电极区域生成环氧丙烷的化学方程式:__________ 。
 ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:主反应①:2CH2=CH2(g)+O2(g)
 2
2 (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;副反应②:CH2=CH2(g)+3O2(g)
 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;副反应③:2
 (g)+5O2(g)
(g)+5O2(g)  4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;副反应④:
 (g)
(g) CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol 已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=
(2)下列有关环氧乙烷制备说法不正确的是
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛

(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:

请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。

(1)写出a电极的电极反应式:
(2)写出b电极区域生成环氧丙烷的化学方程式:
您最近一年使用:0次
【推荐3】铜锈中含有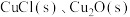 和
和 。有人提出腐蚀途径如下:
。有人提出腐蚀途径如下:
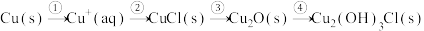
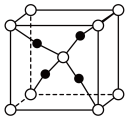
(1)上图所示晶体结构表示铜锈中___________ 物质(填写化学式)。
(2)过程①是典型的电化学腐蚀,其负极反应为___________
(3)过程③、④涉及的反应方程式包括:
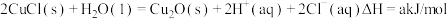
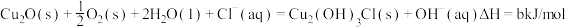
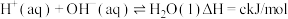
则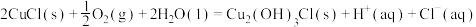 的
的
_______  。
。
(4)环境越潮湿、氧气含量越___________ 、气温越___________ ,铜的腐蚀越严重。
(5)铜锈还含有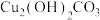 ,其分解方程式为:
,其分解方程式为: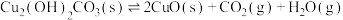 。该反应的
。该反应的 随温度的变化关系如图所示,
随温度的变化关系如图所示,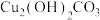 分解的最低温度为
分解的最低温度为___________ K,当温度从 升高到
升高到 时,平衡向
时,平衡向___________ 移动,判定理由是___________ 。

(6)某温度下,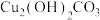 在恒容密闭容器中的分解达平衡时,容器内压强为
在恒容密闭容器中的分解达平衡时,容器内压强为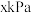 ,则反应平衡常数
,则反应平衡常数
_______ 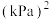 。
。
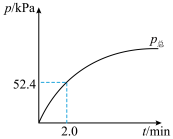
(7) 分解过程中总压强随时间的变化关系如图所示,则在
分解过程中总压强随时间的变化关系如图所示,则在 内,
内, 的平均生成速率
的平均生成速率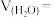
_______  。
。
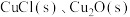 和
和 。有人提出腐蚀途径如下:
。有人提出腐蚀途径如下: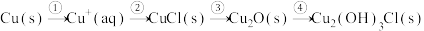

(1)上图所示晶体结构表示铜锈中
(2)过程①是典型的电化学腐蚀,其负极反应为
(3)过程③、④涉及的反应方程式包括:
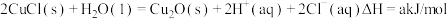
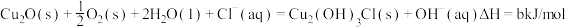
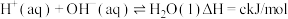
则
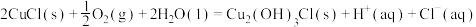 的
的
 。
。(4)环境越潮湿、氧气含量越
(5)铜锈还含有
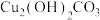 ,其分解方程式为:
,其分解方程式为: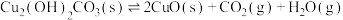 。该反应的
。该反应的 随温度的变化关系如图所示,
随温度的变化关系如图所示,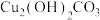 分解的最低温度为
分解的最低温度为 升高到
升高到 时,平衡向
时,平衡向
(6)某温度下,
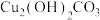 在恒容密闭容器中的分解达平衡时,容器内压强为
在恒容密闭容器中的分解达平衡时,容器内压强为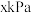 ,则反应平衡常数
,则反应平衡常数
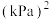 。
。(7)
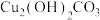 分解过程中总压强随时间的变化关系如图所示,则在
分解过程中总压强随时间的变化关系如图所示,则在 内,
内, 的平均生成速率
的平均生成速率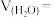
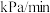 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】乙醇是一种重要的工业原料,被广泛应用于能源、化工、食品等领域,以下两种方法可实现乙醇的制备。
Ⅰ.工业上采用催化乙烯水合制乙醇,该反应过程中能量变化如图所示:

(1)反应物分子有效碰撞几率最大的步骤对应的基元反应为___________ 。
(2)制备的无水乙醇在25℃,101kPa下,完全燃烧时放出热量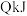 ,其燃烧生成的
,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得
 沉淀,则乙醇燃烧热的热化学方程式为
沉淀,则乙醇燃烧热的热化学方程式为___________ 。
Ⅱ.以合成气催化合成乙醇是近年来研究的热点,其中乙酸甲酯 催化加氢是制取乙醇的关键步骤之一,包括以下主要反应:
催化加氢是制取乙醇的关键步骤之一,包括以下主要反应:
①
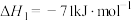
②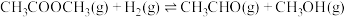
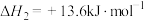
(3)反应CH3CHO(g)+H2(g) CH3CH2OH(g)的
CH3CH2OH(g)的
___________  。
。
(4)若在体积为2L的密闭容器中,控制 流速为
流速为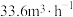 (已换算为标准状况),
(已换算为标准状况), 的转化率为80.0%,则
的转化率为80.0%,则 的反应速率为
的反应速率为___________  (保留三位有效数字),
(保留三位有效数字), 流速过大时乙酸甲酯的转化率下降,原因是
流速过大时乙酸甲酯的转化率下降,原因是___________ 。
(5)一定条件下在1L密闭容器内通入
 和
和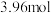
 发生反应①和②,测得不同温度下达平衡时
发生反应①和②,测得不同温度下达平衡时 转化率和乙醇的选择性如下图所示,260℃时反应①的平衡常数
转化率和乙醇的选择性如下图所示,260℃时反应①的平衡常数
___________ ;温度高于240℃时,随温度升高乙醇的选择性降低的原因可能是___________ 。[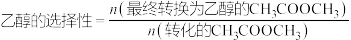 ]
]
Ⅰ.工业上采用催化乙烯水合制乙醇,该反应过程中能量变化如图所示:

(1)反应物分子有效碰撞几率最大的步骤对应的基元反应为
(2)制备的无水乙醇在25℃,101kPa下,完全燃烧时放出热量
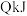 ,其燃烧生成的
,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得
 沉淀,则乙醇燃烧热的热化学方程式为
沉淀,则乙醇燃烧热的热化学方程式为Ⅱ.以合成气催化合成乙醇是近年来研究的热点,其中乙酸甲酯
 催化加氢是制取乙醇的关键步骤之一,包括以下主要反应:
催化加氢是制取乙醇的关键步骤之一,包括以下主要反应:①

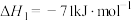
②
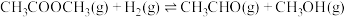
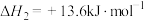
(3)反应CH3CHO(g)+H2(g)
 CH3CH2OH(g)的
CH3CH2OH(g)的
 。
。(4)若在体积为2L的密闭容器中,控制
 流速为
流速为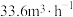 (已换算为标准状况),
(已换算为标准状况), 的转化率为80.0%,则
的转化率为80.0%,则 的反应速率为
的反应速率为 (保留三位有效数字),
(保留三位有效数字), 流速过大时乙酸甲酯的转化率下降,原因是
流速过大时乙酸甲酯的转化率下降,原因是(5)一定条件下在1L密闭容器内通入

 和
和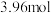
 发生反应①和②,测得不同温度下达平衡时
发生反应①和②,测得不同温度下达平衡时 转化率和乙醇的选择性如下图所示,260℃时反应①的平衡常数
转化率和乙醇的选择性如下图所示,260℃时反应①的平衡常数
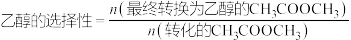 ]
]
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(1)已知:FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①该反应平衡常数的表达式是___________ 。
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质量___________ (填“增大”、“减小”或“不变”)该反应正反应是 ___________ 反应(填“吸热”或“放热”)。
(2)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①检验TiO2·xH2O中Cl-是否被除净的方法是___________ 。
②滴定终点的判定现象是___________ 。
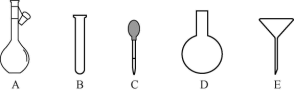
③配制NH4Fe(SO4)2标准溶液时,加入一定量硫酸的原因是___ ;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__ (填字母代号)。
④TiCl4水解生成TiO2·xH2O的化学方程式为___________ 。
 Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①该反应平衡常数的表达式是
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质量
(2)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①检验TiO2·xH2O中Cl-是否被除净的方法是
②滴定终点的判定现象是
③配制NH4Fe(SO4)2标准溶液时,加入一定量硫酸的原因是

④TiCl4水解生成TiO2·xH2O的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 和
和 是温室气体,将
是温室气体,将 和
和 转化为可利用的化学品,其能源和环境的双重意义不言自明,请回答以下问题:
转化为可利用的化学品,其能源和环境的双重意义不言自明,请回答以下问题:
(1)天然气还原 制备合成气的有关反应如下:
制备合成气的有关反应如下:
①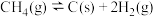
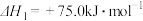
②

③
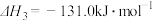
则
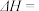
___________  。该反应自发进行的条件是
。该反应自发进行的条件是 ___________ (填“较高温度”或“较低温度”或“任何温度”)。
(2)H2在一定条件下还原 制备
制备 (沸点:100.7℃),能量变化如图所示。
(沸点:100.7℃),能量变化如图所示。

已知: ,
, 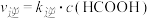 (
(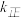 、
、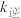 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
在1L恒容密闭容器中充入一定量 、
、 ,发生如下反应:
,发生如下反应:
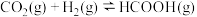

某温度下反应达到平衡, 的平衡转化率为80%,
的平衡转化率为80%,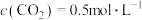 。
。
①达到平衡后,仅升高温度,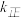 增大的倍数
增大的倍数 ___________ (填“大于”“小于”或“等于”)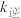 增大的倍数。
增大的倍数。
②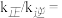
___________ 。
③使用高效催化剂,下列活化能变化合理的是___________ (填字母)。
 和
和 是温室气体,将
是温室气体,将 和
和 转化为可利用的化学品,其能源和环境的双重意义不言自明,请回答以下问题:
转化为可利用的化学品,其能源和环境的双重意义不言自明,请回答以下问题:(1)天然气还原
 制备合成气的有关反应如下:
制备合成气的有关反应如下:①
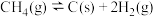
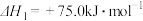
②


③

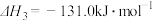
则

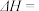
 。该反应自发进行的条件是
。该反应自发进行的条件是 (2)H2在一定条件下还原
 制备
制备 (沸点:100.7℃),能量变化如图所示。
(沸点:100.7℃),能量变化如图所示。
已知:
 ,
, 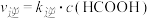 (
(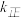 、
、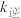 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。在1L恒容密闭容器中充入一定量
 、
、 ,发生如下反应:
,发生如下反应: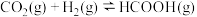

某温度下反应达到平衡,
 的平衡转化率为80%,
的平衡转化率为80%,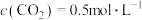 。
。①达到平衡后,仅升高温度,
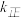 增大的倍数
增大的倍数 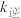 增大的倍数。
增大的倍数。②
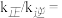
③使用高效催化剂,下列活化能变化合理的是
| 选项 | A | B | C | D |
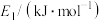 | 384 | 404 | 344 | 374 |
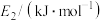 | 359 | 389 | 329 | 399 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】利用工业废气实现双减最有希望开展大规模应用的是 加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应
加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应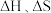 不随温度的改变而变化。
不随温度的改变而变化。
I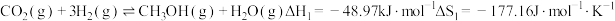
(1)该反应在________ 自发(填“低温”或“任意条件”或“高温”)
(2)在使用催化剂时,该反应由两个基元反应组成,写出决速步骤基元反应方程式________ 。 、总压
、总压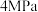 下,
下,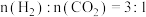 时,不同催化剂组成对
时,不同催化剂组成对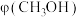 [
[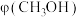 代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物
代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物 选择性的影响如下表:
选择性的影响如下表:
在实际生产过程中选择催化剂2、3组均可,请说明工业生产中应选择第2组催化剂最主要的原因________ ,选择催化剂3的最主要的原因________ 。
(4) 与
与 不同比例对
不同比例对 转化率和甲醇产率的影响如下图所示,在图中画出副产物
转化率和甲醇产率的影响如下图所示,在图中画出副产物 产率曲线
产率曲线________ (在图中标出与虚线的坐标)。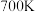 时,
时, 和
和 反应生成甲醇的平衡常数为
反应生成甲醇的平衡常数为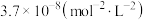 ,在恒容容器中按照
,在恒容容器中按照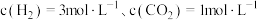 投料,若只发生反应Ⅰ,计算此时
投料,若只发生反应Ⅰ,计算此时 的平衡转化率
的平衡转化率________ 。
 加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应
加氢生成甲醇的反应。298K、100kPa条件下该反应焓变和熵变的数据如下,假设反应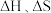 不随温度的改变而变化。
不随温度的改变而变化。I
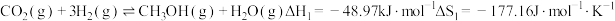
(1)该反应在
(2)在使用催化剂时,该反应由两个基元反应组成,写出决速步骤基元反应方程式
 、总压
、总压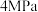 下,
下,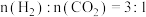 时,不同催化剂组成对
时,不同催化剂组成对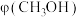 [
[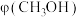 代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物
代表单位质量的催化剂在单位时间处理原料气的质量,体现出催化剂的处理能力]、甲醇选择性及副产物 选择性的影响如下表:
选择性的影响如下表: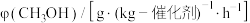 |  选择性(%) 选择性(%) | CO选择性(%) | |
| 催化剂1 | 78 | 40 | 60 |
| 催化剂2 | 88 | 100 | 0 |
| 催化剂3 | 138 | 91 | 9 |
(4)
 与
与 不同比例对
不同比例对 转化率和甲醇产率的影响如下图所示,在图中画出副产物
转化率和甲醇产率的影响如下图所示,在图中画出副产物 产率曲线
产率曲线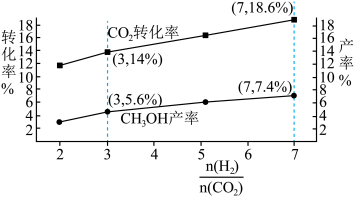
 时,
时, 和
和 反应生成甲醇的平衡常数为
反应生成甲醇的平衡常数为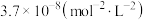 ,在恒容容器中按照
,在恒容容器中按照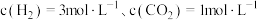 投料,若只发生反应Ⅰ,计算此时
投料,若只发生反应Ⅰ,计算此时 的平衡转化率
的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)++3CO2 (g)的△H=______ kJ/mol
Ⅱ.—定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2 L的密闭容器按甲、乙两种方式投入反应物发生反应:
CO2 (g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)

甲容器15 min后达到平衡,此时CO2的转化率为75%。则0〜15 min内平均反应速率_______ ,此条件下该反应的平衡常数K= ____ 。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是: y____ z(填或“>”“<”“ = ”),且y=_________ (用含的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3 (g)+CO2(g) C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:
C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:
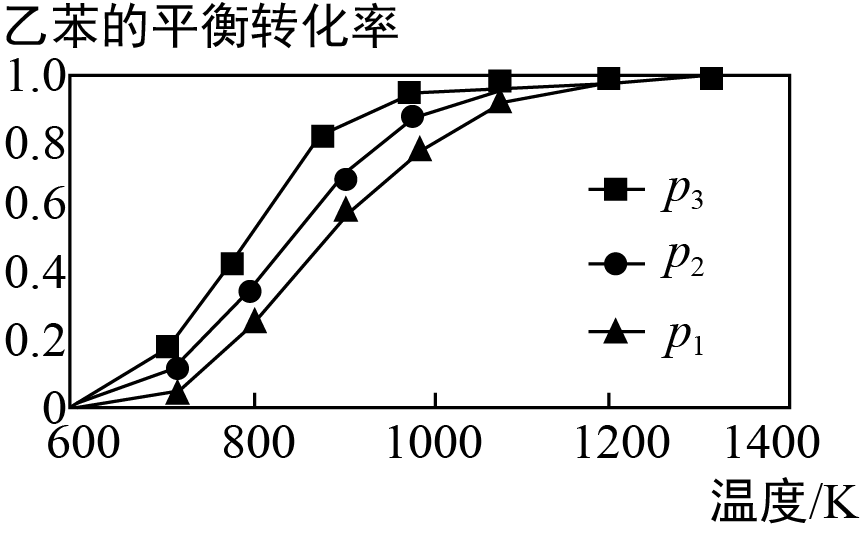
则△H_____ (填“>”、“<”或“ = ”),压强p1、p2、p3从大到小的顺序是_____ 。
(3)CO可被NO2氧化:CO+NO2 =CO2+ NO。当温度高于225℃时,反应速率 正=k正• c(CO) • c(NO2),
正=k正• c(CO) • c(NO2),  逆=k逆• c(CO2) • c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为
逆=k逆• c(CO2) • c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为___________ 。
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)++3CO2 (g)的△H=
Ⅱ.—定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2 L的密闭容器按甲、乙两种方式投入反应物发生反应:
CO2 (g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0〜15 min内平均反应速率
(2)研究表明,温度、压强对反应“C6H5CH2CH3 (g)+CO2(g)
 C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:
C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:
则△H
(3)CO可被NO2氧化:CO+NO2 =CO2+ NO。当温度高于225℃时,反应速率
 正=k正• c(CO) • c(NO2),
正=k正• c(CO) • c(NO2),  逆=k逆• c(CO2) • c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为
逆=k逆• c(CO2) • c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下面是有关化学反应速率与限度的研究。
I.已知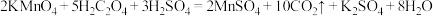
实验室利用下列方案探究影响化学反应速率的因素:
(1)实验时,分别量取稀硫酸酸化的 溶液和无色的草酸溶液,迅速混合并开始计时,通过测定
溶液和无色的草酸溶液,迅速混合并开始计时,通过测定___________ 来判断反应的快慢。
(2)实验①和②是探究___________ 对化学反应速率的影响。
(3)实验③从反应开始到结束用了t秒的时间,则用 表示0-t秒内该反应的平均速率为
表示0-t秒内该反应的平均速率为___________ mol/(L·s)(用含t的式子表示)
Ⅱ.一定条件下,在5L密闭容器内发生反应 ,
, 的物质的量随时间变化如表:
的物质的量随时间变化如表:
(4) 的平衡转化率为
的平衡转化率为___________ 。第2s时 的体积分数为
的体积分数为___________ 。
(5)恒温恒容下,不能说明该反应已经达到平衡状态的是___________(填序号)
(6)为加快该反应速率,可以采取的措施是___________。
I.已知
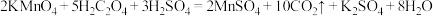
实验室利用下列方案探究影响化学反应速率的因素:
| 编号 | 温度/℃ | 草酸溶液( ) ) | 酸性 溶液 溶液 | ||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | ||
| ① | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| ② | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| ③ | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
 溶液和无色的草酸溶液,迅速混合并开始计时,通过测定
溶液和无色的草酸溶液,迅速混合并开始计时,通过测定(2)实验①和②是探究
(3)实验③从反应开始到结束用了t秒的时间,则用
 表示0-t秒内该反应的平均速率为
表示0-t秒内该反应的平均速率为Ⅱ.一定条件下,在5L密闭容器内发生反应
 ,
, 的物质的量随时间变化如表:
的物质的量随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
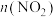 /mol /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 的平衡转化率为
的平衡转化率为 的体积分数为
的体积分数为(5)恒温恒容下,不能说明该反应已经达到平衡状态的是___________(填序号)
| A.容器内混合气体颜色不再变化 |
| B.容器内混合气体压强保持不变 |
| C.容器内混合气体密度保持不变 |
D. 和 和 的浓度之比2:1 的浓度之比2:1 |
| A.降低温度 | B.恒容时充入He(g) |
| C.恒压时充入He(g) | D.恒容时充入 (g) (g) |
您最近一年使用:0次



