常温下,向 某一元碱
某一元碱 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中
溶液,溶液中 、
、 、中和率的变化如图所示。
、中和率的变化如图所示。 为
为 的电离常数,
的电离常数,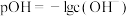 ,中和率
,中和率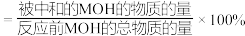 。下列说法正确的是
。下列说法正确的是
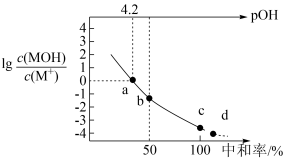
 某一元碱
某一元碱 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中
溶液,溶液中 、
、 、中和率的变化如图所示。
、中和率的变化如图所示。 为
为 的电离常数,
的电离常数,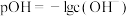 ,中和率
,中和率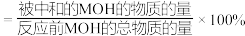 。下列说法正确的是
。下列说法正确的是
| A.根据a点数据计算,常温下MOH的电离平衡常数的数量级为10-4 |
| B.溶液中水的电离程度从a点到d点逐渐增大 |
C.b点时, |
D.c点溶液中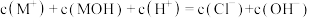 |
更新时间:2023-09-25 18:54:29
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】在2L由NaCl、 、
、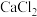 组成的混合液中,部分离子浓度大小如图所示,则此溶液中
组成的混合液中,部分离子浓度大小如图所示,则此溶液中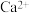 离子的物质的量是
离子的物质的量是
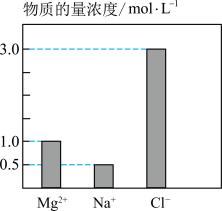
 、
、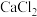 组成的混合液中,部分离子浓度大小如图所示,则此溶液中
组成的混合液中,部分离子浓度大小如图所示,则此溶液中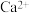 离子的物质的量是
离子的物质的量是
A.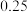 mol mol | B.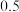 mol mol | C. mol mol | D. mol mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知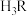 是二元弱酸,常温下向其溶液中加入NaOH调节溶液的pH,测得溶液中含R微粒的物质的量分数(
是二元弱酸,常温下向其溶液中加入NaOH调节溶液的pH,测得溶液中含R微粒的物质的量分数( )与溶液pH的关系如图所示,下列说法中错误的是
)与溶液pH的关系如图所示,下列说法中错误的是
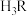 是二元弱酸,常温下向其溶液中加入NaOH调节溶液的pH,测得溶液中含R微粒的物质的量分数(
是二元弱酸,常温下向其溶液中加入NaOH调节溶液的pH,测得溶液中含R微粒的物质的量分数( )与溶液pH的关系如图所示,下列说法中错误的是
)与溶液pH的关系如图所示,下列说法中错误的是
A.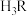 溶液中, 溶液中, |
B.常温下, 的数量级为 的数量级为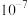 |
C.b点溶液中, |
D.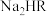 溶液中, 溶液中, |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
| A.c(H+)·c(OH-)=1×10-14 |
| B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-) |
| C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-) |
| D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】25℃时,下列溶液的微粒浓度关系正确的是
A.Na2CO3溶液:c(OH-)= c(H+)+c(HCO )+c(H2CO3) )+c(H2CO3) |
| B.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)+c(H+)=c(CH3COO-)+ c(OH-)+c(Cl-) |
| D.(NH4)2SO4溶液和NaOH溶液混合所得的中性溶液中:c(Na+)=c(NH3·H2O) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列操作不能达到实验目的的是
| 目的 | 操作 | |
| A | 验证淀粉未水解 | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,观察颜色变化。 |
| B | 验证 结合H+的能力比 结合H+的能力比 强 强 | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液的pH约为10;0.1mol/LNaHSO3溶液的pH约为5. |
| C | 探究维生素C的还原性 | 向盛有2mL黄色FeCl3溶液的试管中滴加浓的维生素C溶液,观察颜色变化。 |
| D | 研究温度对化学平衡的影响 | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温,观察颜色变化。 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列实验对应的离子方程式书写正确的是


A.①:H2S+CO =S2-+H2O+CO2 =S2-+H2O+CO2 |
B.②:2Al3++3SO +3Ba2++6OH—=2A1(OH)3↓+3BaSO4↓ +3Ba2++6OH—=2A1(OH)3↓+3BaSO4↓ |
C.③:SO +Cl2+H2O=SO +Cl2+H2O=SO +2Cl—+2H+ +2Cl—+2H+ |
D.④:2Cl—+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】溶洞水体中的H2CO3与空气中的CO2保持平衡。现测得溶洞水体中lgc(X)(X为H2CO3、CO 或Ca2+)与pH的关系如图所示,Ksp(CaCO3)=2.8×10-9。下列说法错误的是
或Ca2+)与pH的关系如图所示,Ksp(CaCO3)=2.8×10-9。下列说法错误的是

 或Ca2+)与pH的关系如图所示,Ksp(CaCO3)=2.8×10-9。下列说法错误的是
或Ca2+)与pH的关系如图所示,Ksp(CaCO3)=2.8×10-9。下列说法错误的是
A.线I代表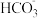 与pH的关系 与pH的关系 |
| B.溶洞水体中存在关系式:知2pH(b)<pH(a)+pH(c) |
| C.a点溶液中,c(Ca2+)=2.8mol/L |
D. =10-4 =10-4 |
您最近一年使用:0次

 2
2 +
+
 溶液中通入
溶液中通入 气体(气体体积换算成标准状况),发生反应:
气体(气体体积换算成标准状况),发生反应: ,测得溶液
,测得溶液 与通入
与通入 的酸性比
的酸性比
 约为
约为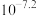
 的值保持不变
的值保持不变

