Ⅰ.已知t℃时, KOH溶液的
KOH溶液的 ,
, 的HA溶液中
的HA溶液中 。
。
请回答下列问题:
(1)该温度下,水的离子积
___________ 。
(2)该温度下,l00mL pH=a的稀硫酸与10mL pH=b的NaOH溶液混合,溶液呈中性,则a、b的关系为___________ 。
(3)在室温下,用蒸馏水稀释 HA溶液时,下列呈减小趋势的是___________(填序号)
HA溶液时,下列呈减小趋势的是___________(填序号)
Ⅱ.室温下,分别取pH=2的盐酸和HX溶液各10mL,向其中加入适量的水稀释,稀释过程中两溶液的pH变化如图所示:

(4)图中表示HX溶液pH变化曲线的是___________ (填“A”或“B”)。
(5)取pH=2的盐酸10mL加入等体积的 的氨水充分反应后,溶液中各种离子的浓度大小顺序为
的氨水充分反应后,溶液中各种离子的浓度大小顺序为___________ 。
 KOH溶液的
KOH溶液的 ,
, 的HA溶液中
的HA溶液中 。
。请回答下列问题:
(1)该温度下,水的离子积

(2)该温度下,l00mL pH=a的稀硫酸与10mL pH=b的NaOH溶液混合,溶液呈中性,则a、b的关系为
(3)在室温下,用蒸馏水稀释
 HA溶液时,下列呈减小趋势的是___________(填序号)
HA溶液时,下列呈减小趋势的是___________(填序号)A.溶液中 | B. |
| C.水的电离程度 | D.溶液中 和 和 的乘积 的乘积 |
Ⅱ.室温下,分别取pH=2的盐酸和HX溶液各10mL,向其中加入适量的水稀释,稀释过程中两溶液的pH变化如图所示:

(4)图中表示HX溶液pH变化曲线的是
(5)取pH=2的盐酸10mL加入等体积的
 的氨水充分反应后,溶液中各种离子的浓度大小顺序为
的氨水充分反应后,溶液中各种离子的浓度大小顺序为
更新时间:2024-01-07 22:06:36
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】请回答下列问题:
(1)25℃时, 的HA溶液中
的HA溶液中 ,该HA溶液的
,该HA溶液的
___________ 。
(2)pH相等的NaOH溶液与 溶液,分别加热到相同的温度后,
溶液,分别加热到相同的温度后, 溶液的pH
溶液的pH___________ NaOH溶液的pH(填“>”“<””或“=”)。
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中的 ,则盐酸的体积
,则盐酸的体积___________ 氨水的体积(填“>”“<””或“=”)
(1)25℃时,
 的HA溶液中
的HA溶液中 ,该HA溶液的
,该HA溶液的
(2)pH相等的NaOH溶液与
 溶液,分别加热到相同的温度后,
溶液,分别加热到相同的温度后, 溶液的pH
溶液的pH(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中的
 ,则盐酸的体积
,则盐酸的体积
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在水的电离平衡中, 和
和 的关系如图所示:
的关系如图所示:

(1)A点水的离子积为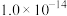 ,B点水的离子积为
,B点水的离子积为___________ 。造成水的离子积变化的原因是___________ 。
(2)下列说法正确的是___________ (填字母)。
a.图中A、B、D三点处 的大小关系:
的大小关系: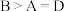
b.在 温度下,向水中加入少量的NaOH可实现由A点向D点移动
温度下,向水中加入少量的NaOH可实现由A点向D点移动
c.AB线上任意点的溶液均呈中性
d.图中温度
(3)①在 温度下,浓度为的
温度下,浓度为的 的
的 溶液中由水电离的
溶液中由水电离的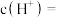
___________ mol/L,将该溶液稀释10000倍,溶液中c(H+)∶c(SO )=
)=___________ 。
②保持 温度不变,将pH=2的
温度不变,将pH=2的 溶液VaL与
溶液VaL与 的KOH溶液VbL混合后溶液pH=6 (忽略混合时溶液体积变化),则
的KOH溶液VbL混合后溶液pH=6 (忽略混合时溶液体积变化),则
___________ 。
③曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用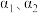 表示,则
表示,则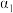
___________ (填“>”“=”或“<”)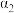 。
。
 和
和 的关系如图所示:
的关系如图所示:
(1)A点水的离子积为
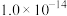 ,B点水的离子积为
,B点水的离子积为(2)下列说法正确的是
a.图中A、B、D三点处
 的大小关系:
的大小关系: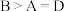
b.在
 温度下,向水中加入少量的NaOH可实现由A点向D点移动
温度下,向水中加入少量的NaOH可实现由A点向D点移动c.AB线上任意点的溶液均呈中性
d.图中温度

(3)①在
 温度下,浓度为的
温度下,浓度为的 的
的 溶液中由水电离的
溶液中由水电离的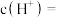
 )=
)=②保持
 温度不变,将pH=2的
温度不变,将pH=2的 溶液VaL与
溶液VaL与 的KOH溶液VbL混合后溶液pH=6 (忽略混合时溶液体积变化),则
的KOH溶液VbL混合后溶液pH=6 (忽略混合时溶液体积变化),则
③曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用
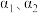 表示,则
表示,则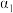
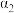 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________ , 反应的离子方程式为______________________ 。
(3)下列说法不正确的是_____________ 。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
①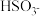 的电离常数表达式 K =
的电离常数表达式 K =_____________ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________ 。
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到
(3)下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比
 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大(4)25 ℃,两种常见酸的电离常数如下表所示。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
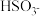 的电离常数表达式 K =
的电离常数表达式 K =②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】今有 、
、 、
、 三种弱酸,根据强酸制弱酸的反应规律,它们之间发生下列反应:
三种弱酸,根据强酸制弱酸的反应规律,它们之间发生下列反应: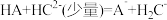 ;
;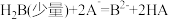 ;
; ,回答下列问题:
,回答下列问题:
(1)相同条件下, 、
、 、
、 三种酸中,酸性最强的是
三种酸中,酸性最强的是___________ ;
(2)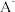 、
、 、
、 、
、 、
、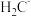 、
、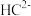 六种离子中,最容易结合质子
六种离子中,最容易结合质子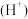 的是
的是___________ ;最难结合质子的是___________ ;
(3)完成下列反应的离子方程式
①
___________ ;
②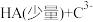
___________ 。
 、
、 、
、 三种弱酸,根据强酸制弱酸的反应规律,它们之间发生下列反应:
三种弱酸,根据强酸制弱酸的反应规律,它们之间发生下列反应: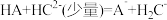 ;
;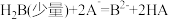 ;
; ,回答下列问题:
,回答下列问题:(1)相同条件下,
 、
、 、
、 三种酸中,酸性最强的是
三种酸中,酸性最强的是(2)
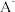 、
、 、
、 、
、 、
、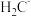 、
、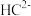 六种离子中,最容易结合质子
六种离子中,最容易结合质子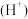 的是
的是(3)完成下列反应的离子方程式
①

②
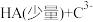
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按要求填空。
(1)浓度均为0.1 mol/L的①硫酸 ②氢氧化钠③氯化铵三种溶液中由水电离出的H+浓度由大到小的顺序是_________________________ (填序号)。
(2)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有____________________________________________________ 。
(3)常温下,用0.01 mol/L HCl溶液完全中和pH=11的下列溶液各100mL,需HCl溶液体积的大小关系是_________________________________________ (填序号)
①NaOH ②Ba(OH)2 ③NH3·H2O
(1)浓度均为0.1 mol/L的①硫酸 ②氢氧化钠③氯化铵三种溶液中由水电离出的H+浓度由大到小的顺序是
(2)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
(3)常温下,用0.01 mol/L HCl溶液完全中和pH=11的下列溶液各100mL,需HCl溶液体积的大小关系是
①NaOH ②Ba(OH)2 ③NH3·H2O
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】I.回答下列问题:
(1)现有以下物质:①NaCl晶体②SO2③液态醋酸④铜⑤固体BaSO4⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KHSO4⑨氨水⑩液氮。请回答下列问题。(填相应序号)
①以上物质能导电的是____ 。
②以上物质属于非电解质的是____ 。
③以上物质属于强电解质的是____ 。
II.A、B、C、D四种物分别是HCl、NH3·H2O、CH3COOH、NaOH中的一种。常温下进行下列实验:
(2)0.001mol/L的A溶液pH=3,则A是____ 。
(3)B溶液和D溶液显碱性,等浓度两者pH关系B<D;
①D是____ 溶液。
②用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是____ (填写序号)。
A.c(OH-) B.c(H+) C.c(H+)与c(OH-)的乘积 D.OH-的物质的量
(4)pH相同,等体积的两份溶液A和C,分别与不同质量的锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是____ (填写序号)。
①反应所需要的时间C>A
②开始反应时的速率A>C
③参加反应的锌的物质的量A=C
④反应过程的平均速率C>A
⑤A溶液里有锌剩余
⑥C溶液里有锌剩余
(1)现有以下物质:①NaCl晶体②SO2③液态醋酸④铜⑤固体BaSO4⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KHSO4⑨氨水⑩液氮。请回答下列问题。(填相应序号)
①以上物质能导电的是
②以上物质属于非电解质的是
③以上物质属于强电解质的是
II.A、B、C、D四种物分别是HCl、NH3·H2O、CH3COOH、NaOH中的一种。常温下进行下列实验:
(2)0.001mol/L的A溶液pH=3,则A是
(3)B溶液和D溶液显碱性,等浓度两者pH关系B<D;
①D是
②用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是
A.c(OH-) B.c(H+) C.c(H+)与c(OH-)的乘积 D.OH-的物质的量
(4)pH相同,等体积的两份溶液A和C,分别与不同质量的锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间C>A
②开始反应时的速率A>C
③参加反应的锌的物质的量A=C
④反应过程的平均速率C>A
⑤A溶液里有锌剩余
⑥C溶液里有锌剩余
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】现有浓度均为0.1mol/L的下列溶液:① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦氨水,请回答下列问题:
⑦氨水,请回答下列问题:
(1)①②③④⑤⑥⑦七种溶液中 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号)___________ 。
(2)溶液②中各离子浓度由大到小的顺序是___________ 。
(3)室温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)已知t℃, ,在t℃时将pH=11的NaOH溶液aL与pH=2的
,在t℃时将pH=11的NaOH溶液aL与pH=2的 的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=
的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(5)硫酸肼(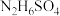 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似,写出硫酸肼第一步水解反应的离子方程式:
类似,写出硫酸肼第一步水解反应的离子方程式:___________ 。
(6)常温下,将 的醋酸与
的醋酸与 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在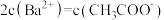 ,则该混合溶液中醋酸的电离常数Ka=
,则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦氨水,请回答下列问题:
⑦氨水,请回答下列问题:(1)①②③④⑤⑥⑦七种溶液中
 浓度由大到小的顺序是(填序号)
浓度由大到小的顺序是(填序号)(2)溶液②中各离子浓度由大到小的顺序是
(3)室温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)已知t℃,
 ,在t℃时将pH=11的NaOH溶液aL与pH=2的
,在t℃时将pH=11的NaOH溶液aL与pH=2的 的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=
的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=(5)硫酸肼(
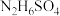 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似,写出硫酸肼第一步水解反应的离子方程式:
类似,写出硫酸肼第一步水解反应的离子方程式:(6)常温下,将
 的醋酸与
的醋酸与 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在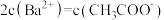 ,则该混合溶液中醋酸的电离常数Ka=
,则该混合溶液中醋酸的电离常数Ka=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH__ 。(填“大”“小”或“相等”)
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为__ 。
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)__________ 。
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)对于反应3X(g)+Y(g)⇌Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
①升高温度:_______ ;
②增大容器容积:_______ 。
(2)已知2CO(g)⇌CO2(g)+C(s),T=980k时,△H-TΔS=0。当体系温度低于980k时,估计△H-T△S的正负符号为_______ (填“正”或“负”),所以正反应_______ 进行(填“自发”或“非自发”)。
(3)在25℃时,1mol乙醇(C2H5OH)在氧气中完全燃烧放出的热量为1366.8kJ,写出表示乙醇燃烧热的热化学方程式_______ 。
(4)NH4Cl溶液中,各离子的物质的量浓度由大到小的顺序是________ 。
(1)对于反应3X(g)+Y(g)⇌Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
①升高温度:
②增大容器容积:
(2)已知2CO(g)⇌CO2(g)+C(s),T=980k时,△H-TΔS=0。当体系温度低于980k时,估计△H-T△S的正负符号为
(3)在25℃时,1mol乙醇(C2H5OH)在氧气中完全燃烧放出的热量为1366.8kJ,写出表示乙醇燃烧热的热化学方程式
(4)NH4Cl溶液中,各离子的物质的量浓度由大到小的顺序是
您最近一年使用:0次



