甘氨酸(H2NCH2COOH)是最简单的氨基酸,25℃时Ka=1.7×10-10。下列叙述错误的是
| A.加水稀释甘氨酸稀溶液,其电离程度和c(H+)都会增大 |
| B.甘氨酸是既能与盐酸反应,又能与NaOH反应的两性化合物 |
| C.H2NCH2COONa稀溶液中:c(Na+)>c(H2NCH2COO-)>c(OH-) |
| D.308 K下,甘氨酸的Ka>1.7×10-10 |
更新时间:2024-01-22 15:08:40
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】25℃时,0.2 mol·L-1的HX溶液中c(HX):c(X-)=99:1,下列说法正确的是
| A.升温至 30℃时,溶液 c(HX):c(X)=99:1 | B.25℃时K(HX)≈2×l0-5 |
| C.向溶液中加入适量NaX溶液,酸的电离平衡向左移动,新平衡时c(X-)减小 | D.加水稀释后,溶液中c(X-)、c(H+)、c(OH-)均减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温下,通过下列实验探究H2C2O4溶液的性质:
下列说法正确的是
| 编号 | 实验操作 |
| 1 | 用pH试纸测定0.1mol⋅L-1的H2C2O4溶液,测得pH约为2 |
| 2 | 向0.1mol·L-1的H2C2O4溶液中逐滴加入等体积0.1mol⋅L-1的KOH溶液,测得所得溶液的pH约为4 |
| 3 | 将4mL0.01mol·L-1KMnO4酸性溶液与4mL0.1mol·L-1H2C2O4溶液混合,溶液褪色 |
| A.H2C2O4的Ka1约为10-2 |
| B.实验2溶液pH由2到4的过程中水的电离程度不断减小 |
C.实验2所得溶液中继续加 溶液至溶液呈中性:c(K+)>2c( 溶液至溶液呈中性:c(K+)>2c( )+c( )+c( ) ) |
| D.实验3中酸性KMnO4溶液褪色证明H2C2O4具有漂白性 |
您最近一年使用:0次
【推荐3】下列实验操作、现象、结论均正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液 | 气泡生成速率加快 | CuSO4是该反应的催化剂 |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 溶液颜色变浅 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取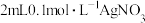 溶液,先后滴加3滴 溶液,先后滴加3滴 溶液和5滴 溶液和5滴 溶液,观察沉淀情况 溶液,观察沉淀情况 | 先生成白色沉淀,后变为黄色沉淀 |  > > |
| D | 已知H3BO3:Ka=5.8×10-10;H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11向饱和硼酸溶液中滴加碳酸钠溶液 | 无明显现象 | H3BO3与碳酸钠不反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
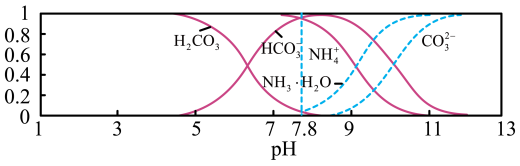

| A.常温下Kb(NH3·H2O)> Kal(H2CO3) |
| B.向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小 |
| C.NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO32-)+c( H2 CO3) |
| D.当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO32-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向20.00mL0.2000mol·L-1的醋酸溶液中逐滴加入0.2000mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法正确的是
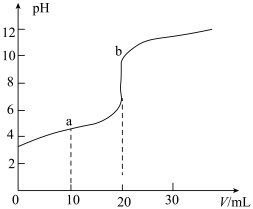

| A.水的电离程度:a>b |
| B.当pH=7时,消耗NaOH溶液的体积等于20.00mL |
| C.当V=20.00mL时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在滴定过程中,一定存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
您最近一年使用:0次

 的溶液中,离子浓度由大到小的顺序正确的是
的溶液中,离子浓度由大到小的顺序正确的是





