工业上常用H2S处理废水中的Ni2+和Cd2+,对其工艺条件进行研究。处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol∙L–1,在一定pH范围内,溶液中HS–、S2–、Ni2+和Cd2+浓度的—lg(c/mol·L–1)随pH的变化关系如图,已知pH=2时溶液中仅有CdS沉淀生成,下列说法正确的是


| A.X点:c(H+)>c(Cd2+)=c(S2—) |
| B.Ka2(H2S)=10–14.6 |
| C.m=9.2 |
D.反应Cd2+(aq)+HS—(aq) CdS(s)+H+(aq)的平衡常数K=10–11.4(mol·L–1)–1 CdS(s)+H+(aq)的平衡常数K=10–11.4(mol·L–1)–1 |
更新时间:2024-02-24 19:58:07
|
相似题推荐
多选题
|
较难
(0.4)
【推荐1】25℃是,向20mL0.1mol•L-1盐酸溶液中逐滴加入等浓度的氨水溶液,溶液中pH与pOH(pOH=一lgc(OH-))的变化关系如图所示。下列说法正确的是


| A.b点消耗氨水的体积为20mL |
| B.向a点所示溶液中加入少量的HCl(aq)或NaOH(aq),溶液的pH变化很少 |
| C.a点和c点所示溶液中水所电离出的c(OH-)分别为10-9mol•L-1和10-5mol•L-1 |
| D.ab段所示溶液中相关料子浓度关系可能为:c(NH4+>c(Cl-)>C(NH3·H2O) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】在25℃时,将1.0 L y mol·L-1 HF溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HF或加入NaF固体(忽略体积和温度变化),溶液pH随通入HF(或加入NaF固体)物质的量的变化如图所示。下列叙述正确的是
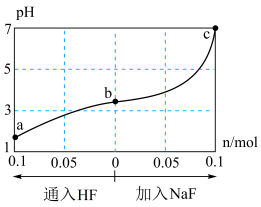

| A.水的电离程度:c>b>a |
| B.a点对应的混合溶液中,c(Na+)=c(HF) |
C.从b到a的过程中,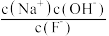 逐渐减小 逐渐减小 |
D.该温度下,氢氟酸的电离平衡常数Ka= |
您最近一年使用:0次
【推荐1】常温下,将0.05mol BaSO4粉末置于盛有1L蒸馏水的烧杯中,向烧杯中加入Na2CO3固体(忽略溶液体积变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中各离子浓度变化曲线如图所示。已知:lg2=0.3;lg2.5=0.4;lg5=0.7,下列说法错误的是
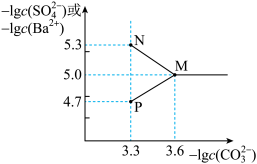

| A.图中表示c(Ba2+)的曲线是MN |
B.P点溶液中离子浓度大小为: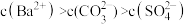 |
C.常温下 的平衡常数的数量级为10-2 的平衡常数的数量级为10-2 |
| D.若使0.05mol BaSO4全部转化为BaCO3,至少要加入1.25mol Na2CO3 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】已知常温下Ksp[Mg(OH)2]=3.2×10﹣11、Ksp[Fe(OH)3]=2.7×10﹣39,下列说法正确的是
| A.将10g氢氧化铁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化铁溶液,c(OH﹣)=3×10﹣10mol/L |
| B.将10g氢氧化镁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化镁溶液,加入酚酞试液后不能变红 |
| C.若1mol/L氯化镁溶液中混有氯化铁,调节pH=9,可以保证镁离子不沉淀而铁离子沉淀完全 |
| D.根据溶度积数据,可以计算出氢氧化铁固体与盐酸反应:Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数为2.7×103 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】谷氨酸[HOOC(CH2)2CH(NH3+ )COO-,用H2R表示]是人体内氮代谢的基本氨基酸之一,其盐酸盐(H3RCl)在水溶液中存在如下平衡:
H3R+ H2R
H2R HR-
HR-  R2-
R2-
常湿下,向一定浓度的H3RCl溶液中滴加NaOH溶液,混合溶液中lgx[x表示 、
、 或
或 ]随pOH[pOH= -lgc(OH- )]的变化如图所示,下列说法错误的是
]随pOH[pOH= -lgc(OH- )]的变化如图所示,下列说法错误的是

H3R+
 H2R
H2R HR-
HR-  R2-
R2-常湿下,向一定浓度的H3RCl溶液中滴加NaOH溶液,混合溶液中lgx[x表示
 、
、 或
或 ]随pOH[pOH= -lgc(OH- )]的变化如图所示,下列说法错误的是
]随pOH[pOH= -lgc(OH- )]的变化如图所示,下列说法错误的是
| A.K1的数量级为10-2 |
B.曲线I表示pOH与lg 的变化关系 的变化关系 |
| C.M点时,c(H+)+c(Na+)+c(H3R+)=c(OH-)+3c(HR-)+c(Cl-) |
| D.pH=7时,c(HR-)>c(H2R)>c(R2-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】已知CaF2是难溶于水、可溶于酸的盐。常温下,用盐酸调节CaF2浊液的pH,测得在不同pH条件下,体系中 与-lgc(X)(X为Ca2+或F- )的关系如图所示。
与-lgc(X)(X为Ca2+或F- )的关系如图所示。
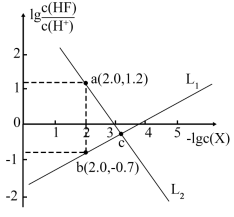
下列说法错误的是
 与-lgc(X)(X为Ca2+或F- )的关系如图所示。
与-lgc(X)(X为Ca2+或F- )的关系如图所示。
下列说法错误的是
A.L1表示-lgc(F- )与 的变化曲线 的变化曲线 |
| B.K sp(CaF2 )的数量级为10-10 |
| C.c点的溶液中: c(Cl-)<c(Ca2+) |
| D.a、b、c三点的溶液中: 2c(Ca2+)=c(F- )+c(HF) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐3】邻苯二甲酸(H2M)的pKa1=2.95,pKa2=5.41(已知pK= -lg K)。室温下,向一定浓度的H2M溶液中滴加0.1 mol·L-1NaOH溶液,混合溶液中x与pH的关系如图所示。其中x=lg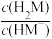 或lg
或lg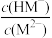 ,下列说法错误的是
,下列说法错误的是
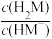 或lg
或lg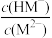 ,下列说法错误的是
,下列说法错误的是
| A.直线II上的所有点对应溶液中水的电离程度大于直线I |
| B.c(Na+ )=c(HM- ) +c(M2- )时,pH<7 |
| C.a=c=2.95,b=d=5.41 |
| D.溶液中c(M2- )>c(HM- )时,pH≥7 |
您最近一年使用:0次

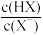 ]=-lg[
]=-lg[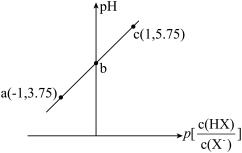
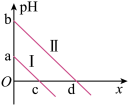
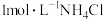 溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到从b点开始溶液中有白色沉淀生成。下列说法错误的是(已知
溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到从b点开始溶液中有白色沉淀生成。下列说法错误的是(已知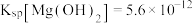 )
)
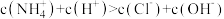

 的水解平衡常数的数量级为
的水解平衡常数的数量级为


